21.5: Ácidos y bases de Brønsted-Lowry
- Page ID
- 70676
El concepto Arrhenius de ácidos y bases fue una contribución significativa a la comprensión científica de ácidos y bases. Reemplazó y amplió la idea original de Lavoisier de que todos los ácidos contenían oxígeno. Sin embargo, la teoría de Arrhenius también tuvo sus carencias. No tomó en cuenta el papel del solvente. Además, este concepto no abordó el comportamiento ácido-base en solventes como el benceno, donde no pudo haber ionización. Entonces, era imperativa la formación de una nueva teoría, que se basaba en los hallazgos de Arrhenius, pero también iba más allá de ellos.
Ácidos y bases de Brønsted-Lowry
La definición de Arrhenius de ácidos y bases es algo limitada. Existen algunos compuestos cuyas propiedades sugieren que son ácidos o básicos, pero que no califican según la definición de Arrhenius. Un ejemplo es el amoníaco\(\left( \ce{NH_3} \right)\). Su solución acuosa se vuelve azul tornasol, reacciona con los ácidos y muestra todas las demás propiedades de una base. Sin embargo, no contiene el ión hidróxido. En 1923, el químico danés Johannes Brønsted (1879-1947) y el químico inglés Thomas Lowry (1874-1936) propusieron independientemente una definición más amplia de ácidos y bases. Un ácido de Brønsted-Lowry es una molécula o ion que dona un ión de hidrógeno en una reacción. Una base de Brønsted-Lowry es una molécula o ion que acepta un ion hidrógeno en una reacción. Un ion hidrógeno se conoce comúnmente como protón, por lo que los ácidos y bases son donantes de protones y aceptores de protones, respectivamente, según la definición de Brønsted-Lowry. Todas las sustancias que se clasifican como ácidos y bases bajo la definición de Arrhenius también se definen como tales bajo la definición de Brønsted-Lowry. La nueva definición, sin embargo, incluye algunas sustancias que quedan fuera de acuerdo con la definición de Arrhenius.
¿Qué tipo de molécula calificaría como base de Brønsted-Lowry? Estas moléculas necesitan ser capaces de aceptar un ion de hidrógeno (o protón). Dos posibilidades vienen a la mente: un anión que puede formar un compuesto neutro con un protón, o una molécula en la que uno o más átomos tiene electrones de par solitario. El anión más obvio es la base Arrhenius\(\ce{OH^-}\). Este ion puede formar una molécula de agua con un protón aceptando el protón. El anión acetato\(\ce{CH_3COO^-}\) es otro anión que puede combinarse con un protón para formar ácido acético. Los grupos de electrones de par solitario incluirían el átomo de nitrógeno (véase la figura a continuación). Los dos electrones en la parte superior del átomo de nitrógeno no están conectados en ningún tipo de enlace, pero sí interactúan fácilmente con un protón desnudo.
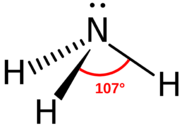
El oxígeno es otro átomo con electrones de par solitario que puede funcionar como una base de Brønsted-Lowry.

Los dos electrones simples (a la izquierda e inferior del átomo) pueden formar enlaces covalentes simples con otros átomos, mientras que los dos pares de electrones dobles (arriba y derecha) están disponibles para interactuar con un ión de hidrógeno.
Resumen
- Un ácido de Brønsted-Lowry es una molécula o ion que dona un ión de hidrógeno en una reacción.
- Una base de Brønsted-Lowry es una molécula o ion que acepta un ion hidrógeno en una reacción.

