25.5: Isómeros
- Page ID
- 70643
A medida que profundizamos en las complejidades de la química orgánica, veremos cómo la forma molecular afecta las reacciones. Una reacción común para los alquenos es la adición de hidrógeno a través del doble enlace para formar el alcano correspondiente. Debido a la geometría de la reacción, las diferentes formas de 2-buteno tienen diferentes calores de reacción. Estas diferencias son importantes, tanto desde el punto de vista teórico, como desde el punto de vista de las aplicaciones industriales. Mayores requerimientos energéticos significan un mayor costo y un producto más caro.
Isómeros
Uno de los aspectos interesantes de la química orgánica es que es tridimensional. Una molécula puede tener una forma en el espacio que puede contribuir a sus propiedades. Las moléculas pueden diferir en la forma en que están ordenados los átomos, la misma combinación de átomos se puede ensamblar de más de una manera. Estos compuestos se conocen como isómeros. Los isómeros son moléculas con las mismas fórmulas moleculares, pero diferentes disposiciones de átomos. Analizaremos algunas posibilidades de isómeros para alcanos y alquenos.
Isómeros estructurales
Un isómero estructural es aquel en el que dos o más compuestos orgánicos tienen las mismas fórmulas moleculares, pero diferentes estructuras. Las dos moléculas de pentano a continuación difieren solo en la ubicación del grupo metilo.
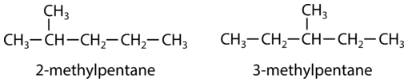
Los alquenos también pueden demostrar isomería estructural. En los alquenos, existen múltiples isómeros estructurales basados en dónde en la cadena se produce el doble enlace. Las fórmulas estructurales condensadas de 1-buteno y 2-buteno lo muestran.

El número en el nombre del alqueno se refiere al carbono numerado más bajo en la cadena que forma parte del doble enlace.
Isómeros geométricos
Con una molécula como el 2-buteno, se puede observar un tipo diferente de isomería llamado isomería geométrica. Los isómeros geométricos son isómeros en los que el orden de enlace de los átomos es el mismo, pero la disposición de los átomos en el espacio es diferente. El doble enlace en un alqueno no es libre de rotar debido a la naturaleza del enlace pi. Por lo tanto, existen dos formas diferentes de construir la molécula de 2-buteno. La siguiente imagen muestra los dos isómeros geométricos, llamados cis -2-buteno y trans- 2-buteno.
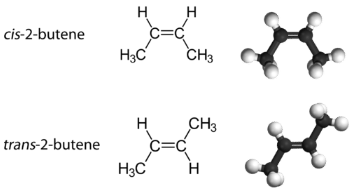
El isómero cis tiene los dos átomos de hidrógeno individuales en el mismo lado de la molécula, mientras que el isómero trans los tiene en lados opuestos de la molécula. En ambas moléculas, el orden de unión de los átomos es el mismo. Para que los isómeros geométricos existan, debe haber una estructura rígida en la molécula para evitar la libre rotación alrededor de un enlace. Si el doble enlace en un alqueno fuera capaz de rotar, los dos isómeros geométricos anteriores no existirían. Además, los dos átomos de carbono deben tener cada uno dos grupos diferentes unidos para que haya isómeros geométricos. El propeno no tiene isómeros geométricos porque uno de los átomos de carbono tiene dos hidrógenos individuales unidos a él.
Las propiedades físicas y químicas de los isómeros geométricos son generalmente diferentes. Mientras que el cis-2-buteno es una molécula polar, el trans--2-buteno es no polar. El calor o la irradiación con luz se puede utilizar para lograr la conversión de un isómero geométrico a otro. La entrada de energía debe ser lo suficientemente grande como para romper el enlace pi entre los dos átomos de carbono, que es más débil que el enlace sigma. En ese punto, el ahora enlace sencillo es libre de rotar, y los isómeros pueden interconvertir.
Al igual que con los alquenos, los alquinos muestran isomería estructural comenzando con 1-butina y 2-butina. Sin embargo, no hay isómeros geométricos con alquinos, porque solo hay otro grupo unido a los átomos de carbono que están involucrados en el triple enlace.
Resumen
- Los isómeros son moléculas con las mismas fórmulas moleculares, pero diferentes disposiciones de átomos.
- Un isómero estructural es aquel en el que dos o más compuestos orgánicos tienen las mismas fórmulas moleculares, pero diferentes estructuras.
- Los isómeros geométricos son isómeros en los que el orden de enlace de los átomos es el mismo, pero la disposición de los átomos en el espacio es diferente.
- Se dan ejemplos de isómeros de alcano y alqueno.

