25.9: Alcoholes
- Page ID
- 70660
El agua se congela en\(0^\text{o} \text{C}\), lo que crea problemas para los autos en el invierno. El agua en el motor se congelará y agrietará el bloque del motor. Para evitar esto, se agrega anticongelante para bajar el punto de congelación del líquido. El anticongelante más común es un alcohol conocido como propilenglicol. Ha reemplazado en gran medida al etilenglicol mucho más tóxico. El metanol también se puede utilizar como anticongelante, principalmente en el líquido del limpiaparabrisas.
Alcoholes
Un alcohol es un compuesto orgánico que contiene uno o más\(\left( \ce{-OH} \right)\) grupos hidroxilo. La fórmula general para los alcoholes es\(\ce{R-OH}\). No confundir alcoholes con bases inorgánicas que contengan el ion hidróxido\(\left( \ce{OH^-} \right)\). El\(\ce{-OH}\) grupo en un alcohol está unido covalentemente a un átomo de carbono y no se ioniza en solución. Los pasos para nombrar alcoholes se enumeran a continuación.
- Nombra el compuesto parental encontrando la cadena de átomos de carbono continua más larga que también contiene el grupo hidroxilo. Si hay un grupo hidroxilo en la molécula, cambie el -e final en el nombre del alcano a -ol. Si hay más de un grupo hidroxilo, usa el nombre completo del alcano y agrega un sufijo para indicar el número de grupos hidroxilo. Por ejemplo, dos grupos hidroxilo es -diol, tres es -triol, etc.
- Numerar la cadena de carbono de una manera que haga que la suma de los números de hidroxilo sea lo más baja posible.
- Agrega el prefijo numérico en el nombre antes del nombre del alcohol.
- Separe los números con comas y separe los números de los nombres o prefijos con un guión. No hay espacios en el nombre.
A continuación se presentan tres ejemplos de alcoholes y sus nombres IUPAC.

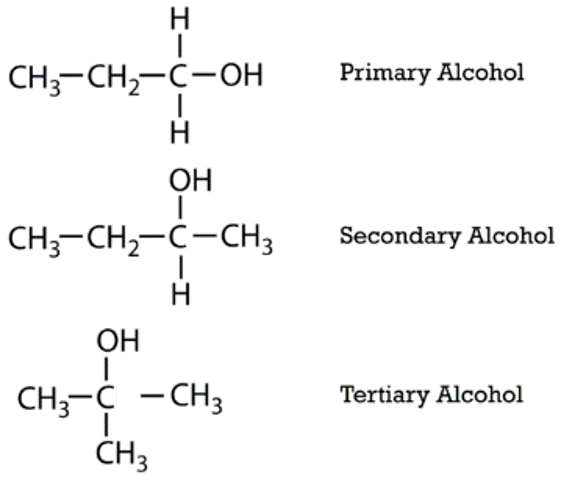
Los alcoholes alifáticos se pueden clasificar según el número de\(\ce{R}\) grupos unidos al carbono con el grupo hidroxilo. Si un\(\ce{R}\) grupo está unido a ese carbono, el alcohol es un alcohol primario. Si se adjuntan dos\(\ce{R}\) grupos, el alcohol es un alcohol secundario. Si se unen tres\(\ce{R}\) grupos, el alcohol es un alcohol terciario. A continuación se muestra un ejemplo de cada uno. El alcohol primario es 1-propanol, el alcohol secundario es 2-butanol y el alcohol terciario es 2-metil-2-propanol.
Propiedades de Alcoholes
Los alcoholes más pequeños y ligeros (metanol, etanol, propanol) son completamente solubles en agua en todas las proporciones. En una solución, los grupos hidroxilo de las moléculas de alcohol y las moléculas de agua forman enlaces de hidrógeno entre sí, lo que resulta en una miscibilidad completa. Sin embargo, a medida que aumenta la longitud de la cadena de carbono, la solubilidad disminuye. La solubilidad del 1-butanol es\(7.4 \: \text{g}\) por\(100 \: \text{g}\) agua, mientras que la del 1-pentanol es\(2.7 \: \text{g}\) por\(100 \: \text{g}\) de agua, y el 1-octanol es\(0.06 \: \text{g}\) por\(100 \: \text{g}\) de agua. La porción de la cadena carbonada de la molécula de alcohol más grande es no polar, y conduce a la disminución de la solubilidad del compuesto general.
La presencia de enlaces de hidrógeno en los alcoholes también explica los puntos de ebullición relativamente altos de los alcoholes en comparación con alcanos de masa molar similar (ver tabla a continuación).
| Compuesto | Fórmula | Masa molar\(\left( \text{g/mol} \right)\) | Punto de ebullición\(\left( ^\text{o} \text{C} \right)\) |
|---|---|---|---|
| etano | \(\ce{CH_3CH_3}\) | \ (\ izquierda (\ texto {g/mol}\ derecha)\) ">32 | \ (\ izquierda (^\ texto {o}\ texto {C}\ derecha)\) ">-88 |
| metanol | \(\ce{CH_3OH}\) | \ (\ izquierda (\ texto {g/mol}\ derecha)\) ">30 | \ (\ izquierda (^\ texto {o}\ texto {C}\ derecha)\) ">64.7 |
| propano | \(\ce{CH_3CH_2CH_3}\) | \ (\ izquierda (\ texto {g/mol}\ derecha)\) ">44 | \ (\ izquierda (^\ texto {o}\ texto {C}\ derecha)\) ">-42.1 |
| etanol | \(\ce{CH_3CH_2OH}\) | \ (\ izquierda (\ texto {g/mol}\ derecha)\) ">46 | \ (\ izquierda (^\ texto {o}\ texto {C}\ derecha)\) ">78,3 |
Solo las débiles fuerzas de dispersión de Londres mantienen unidas las moléculas de alcanos no polares en la fase líquida. En consecuencia, se requiere menos energía para separar estas moléculas de la superficie del líquido y convertirlas en vapor. El enlace de hidrógeno más fuerte entre las moléculas de alcohol significa que se requiere más energía para convertir el líquido en vapor y, por lo tanto, los puntos de ebullición son altos.
Resumen
- Un alcohol es un compuesto orgánico que contiene uno o más\(\left( \ce{-OH} \right)\) grupos hidroxilo.
- Los alcoholes más ligeros (metanol, etanol, propanol) son completamente solubles en agua en todas las proporciones; a medida que aumenta la longitud de la cadena carbonada, la solubilidad disminuye.
- La presencia de enlaces de hidrógeno en los alcoholes también explica los puntos de ebullición relativamente altos de los alcoholes en comparación con alcanos de masa molar similar.

