2.E: Mediciones (Ejercicios)
- Page ID
- 74965
2.1: Expresar números
1. Expresar estos números en notación científica.
- 56.9
- 563,100
- 0.0804
- 0.00000667
2. Expresar estos números en notación científica.
- −890.000
- 602,000,000,000
- 0.0000004099
- 0.000000000000011
3. Expresar estos números en notación científica.
- 0.00656
- 65,600
- 4,567,000
- 0.000005507
4. Expresar estos números en notación científica.
- 65
- −321.09
- 0.000077099
- 0.000000000218
5. Exprese estos números en notación estándar.
- 1.381 × 10 5
- 5.22 × 10 −7
- 9.998 × 10 4
6. Exprese estos números en notación estándar.
- 7.11 × 10 −2
- 9.18 × 10 2
- 3.09 × 10 −10
7. Exprese estos números en notación estándar.
- 8.09 × 10 0
- 3.088 × 10 −5
- −4.239 × 10 2
8. Exprese estos números en notación estándar.
- 2.87 × 10 −8
- 1.78 × 10 11
- 1.381 × 10 −23
9. Estos números no están escritos en notación científica propiamente dicha. Reescribirlos para que estén en la notación científica adecuada.
- 72.44 × 10 3
- 9,943 × 10 −5
- 588,399 × 10 2
10. Estos números no están escritos en notación científica propiamente dicha. Reescribirlos para que estén en la notación científica adecuada.
- 0.000077 × 10 −7
- 0.000111 × 10 8
- 602,000 × 10 18
11. Estos números no están escritos en notación científica propiamente dicha. Reescribirlos para que estén en la notación científica adecuada.
- 345.1 × 10 2
- 0.234 × 10 −3
- 1,800 × 10 −2
12. Estos números no están escritos en notación científica propiamente dicha. Reescribirlos para que estén en la notación científica adecuada.
- 8,099 × 10 −8
- 34.5 × 10 0
- 0.000332 × 10 4
13. Escribe estos números en notación científica contando el número de lugares donde se mueve el punto decimal.
- 123,456.78
- 98,490
- 0.000000445
14. Escribe estos números en notación científica contando el número de lugares donde se mueve el punto decimal.
- 0.000552
- 1,987
- 0.00000000887
15. Usa tu calculadora para evaluar estas expresiones. Expresar la respuesta final en notación científica adecuada.
- 456 × (7.4 × 10 8) =?
- (3.02 × 10 5) ÷ (9.04 × 10 15) =?
- 0.0044 × 0.000833 =?
16. Usa tu calculadora para evaluar estas expresiones. Expresar la respuesta final en notación científica adecuada.
- 98,000 × 23,000 =?
- 98,000 ÷ 23,000 =?
- (4.6 × 10 −5) × (2.09 × 10 3) =?
17. Usa tu calculadora para evaluar estas expresiones. Expresar la respuesta final en notación científica adecuada.
- 45 × 132 ÷ 882 =?
- [(6.37 × 10 4) × (8.44 × 10 −4)] ÷ (3.2209 × 10 15) =?
18. Usa tu calculadora para evaluar estas expresiones. Expresar la respuesta final en notación científica adecuada.
- (9.09 × 10 8) ÷ [(6.33 × 10 9) × (4.066 × 10 −7)] =?
- 9,345 × 34.866 ÷ 0.00665 =?
RESPUESTAS
-
- 5.69 × 10 1
- 5.631 × 10 5
- 8,04 × 10 −2
- 6.67 × 10 −6
-
- 6.56 × 10 −3
- 6.56 × 10 4
- 4.567 × 10 6
- 5.507 × 10 −6
-
- 138,100
- 0.000000522
- 99,980
-
- 8.09
- 0.00003088
- −423.9
-
- 7.244 × 10 4
- 9.943 × 10 −2
- 5.88399 × 10 7
-
- 3.451 × 10 4
- 2.34 × 10 −4
- 1.8 × 10 1
-
- 1.2345678 × 10 5
- 9.849 × 10 4
- 4.45 × 10 −7
-
- 3.3744 × 10 11
- 3.3407 × 10 −11
- 3.665 × 10 −6
-
- 6.7346 × 10 0
- 1.6691 × 10 −14
2.2: Unidades expresantes
1. Identificar la unidad en cada cantidad.
- 2 cajas de crayones
- 3.5 gramos de oro
2. Identificar la unidad en cada cantidad.
- 32 oz de queso cheddar
- 0.045 cm 3 de agua
3. Identificar la unidad en cada cantidad.
- 9.58 s (el récord mundial actual en el guión de 100 m)
- 6.14 m (el récord mundial actual en la bóveda con pértiga)
4. Identificar la unidad en cada cantidad.
- 2 docenas de huevos
- 2.4 km/s (la velocidad de escape de la luna, que es la velocidad que necesitas en la superficie para escapar de la gravedad de la luna)
5. Indicar qué multiplicador representa cada prefijo.
- k
- m
- M
6. Indicar qué multiplicador representa cada prefijo.
- c
- G
- μ
7. Dar el prefijo que representa cada multiplicador.
- 1/1.000 ×
- 1,000 ×
- 1,000,000,000 ×
8. Dar el prefijo que representa cada multiplicador.
- 1/1,000,000,000º ×
- 1/100 ×
- 1,000,000 ×
-
9. Complete la siguiente tabla con la información que falta.
Mesa con Unidades a la derecha y Abreviatura en el lado izquierdo. Faltan unidades en la segunda y tercera fila en el lado derecho de la mesa. Faltan abreviaturas en la primera y cuarta filas del lado izquierdo de la tabla. Unidad Abreviatura kilosegundo mL Mg centímetro -
10. Complete la siguiente tabla con la información que falta.
Mesa con Unidades a la derecha y Abreviatura en el lado izquierdo. Faltan unidades en la tercera y cuarta filas del lado derecho de la mesa. Faltan abreviaturas en la primera, segunda y quinta fila en el lado izquierdo de la tabla. Unidad Abreviatura kilómetro por segundo segundo cm 3 μL nanosegundo
11. Exprese cada cantidad en una unidad más apropiada. Puede haber más de una respuesta aceptable.
- 3.44 × 10 −6 s
- 3,500 L
- 0.045 m
12. Exprese cada cantidad en una unidad más apropiada. Puede haber más de una respuesta aceptable.
- 0.000066 m/s (Pista: hay que considerar solo la unidad en el numerador.)
- 4.66 × 10 6 s
- 7,654 L
13. Exprese cada cantidad en una unidad más apropiada. Puede haber más de una respuesta aceptable.
- 43,600 mL
- 0.0000044 m
- 1,438 ms
14. Exprese cada cantidad en una unidad más apropiada. Puede haber más de una respuesta aceptable.
- 0.000000345 m 3
- 47,000,000 mm 3
- 0.00665 L
15. Los prefijos multiplicativos también se utilizan para otras unidades, como la memoria de la computadora. La unidad básica de la memoria de la computadora es el byte (b). ¿Cuál es la unidad para un millón de bytes?
16. Es posible que haya escuchado los términos microescala o nanoescala para representar los tamaños de objetos pequeños. ¿Qué unidades de longitud crees que son útiles en estas escalas? ¿Qué fracciones de la unidad fundamental de longitud son estas unidades?
17. La aceleración se define como un cambio en la velocidad por tiempo. Proponer una unidad de aceleración en términos de las unidades fundamentales del SI.
18. La densidad se define como la masa de un objeto dividida por su volumen. Proponer una unidad de densidad en términos de las unidades fundamentales del SI.
RESPUESTAS
- cajas de crayones
- gramos de oro
3.
- segundos
- metros
5.
- 1,000 x
- 1/1,000 x
- 1,000,000 x
7.
- milli-
- kilo-
- giga-
9.
|
Abreviatura |
|---|---|
|
|
|
|
|
|
|
|
- 3.44 μs
- 3.5 kL
- 4.5 cm
13.
- 43.6 mL
- 4.4 m
- 1.438 s
15. megabytes (Mb
17. metros/segundo 2
2.3: Cifras significativas
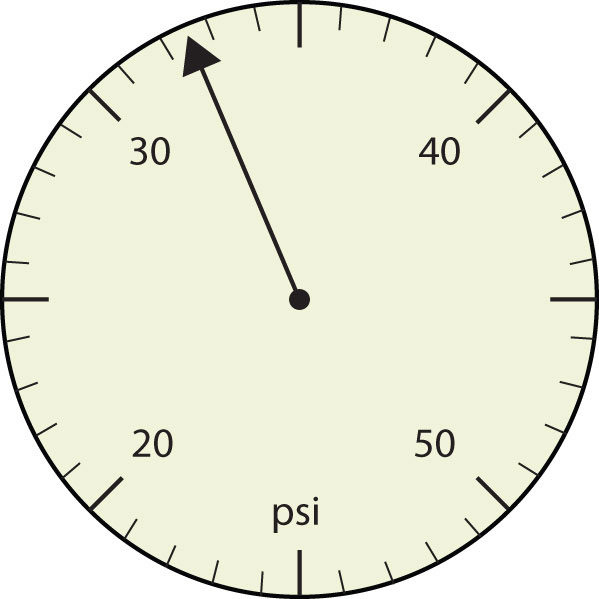
- 1. Expresar cada medición al número correcto de cifras significativas.
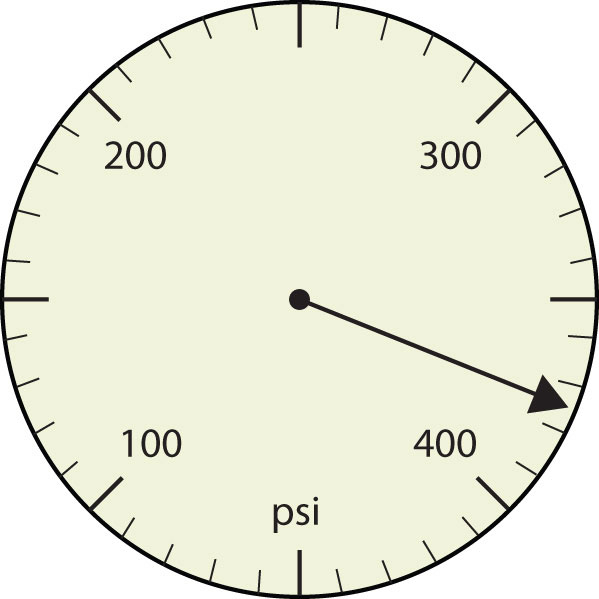
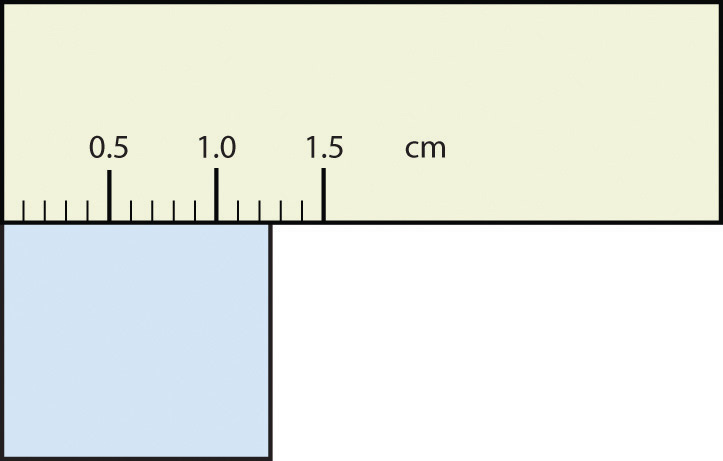
- 2. Expresar cada medición al número correcto de cifras significativas.
- ¿Cuántas cifras significativas tienen estos números?
- 23
- 23.0
- 0.00023
- 0.0002302
- ¿Cuántas cifras significativas tienen estos números?
- 5.44 × 10 8
- 1.008 × 10 −5
- 43.09
- 0.0000001381
5. ¿Cuántas cifras significativas tienen estos números?
- 765,890
- 765,890.0
- 1.2000 × 10 5
- 0.0005060
6. ¿Cuántas cifras significativas tienen estos números?
- 0.009
- 0.0000009
- 65,444
- 65,040
7. Calcular y expresar cada respuesta con el número adecuado de cifras significativas, redondeando según sea necesario.
- 56.0 + 3.44 =?
- 0.00665 + 1.004 =?
- 45.99 − 32.8 =?
- 45.99 − 32.8 + 75.02 =?
8. Calcular y expresar cada respuesta con el número adecuado de cifras significativas, redondeando según sea necesario.
- 1.005 + 17.88 =?
- 56,700 − 324 =?
- 405,007 − 123.3 =?
- 55.5 + 66.66 − 77.777 =?
9. Calcular y expresar cada respuesta con el número adecuado de cifras significativas, redondeando según sea necesario.
- 56.7 × 66.99 =?
- ÷ 77 =?
- ÷ 77.0 =?
- 6.022 × 1.89 =?
10. Calcular y expresar cada respuesta con el número adecuado de cifras significativas, redondeando según sea necesario.
- 0.000440 × 17.22 =?
- 203,000 ÷ 0.044 =?
- 67 × 85.0 × 0.0028 =?
- 999,999 ÷ 3,310 =?
11. Escribe el número 87.449 en notación científica con cuatro cifras significativas.
12. Escribe el número 0.000066600 en notación científica con cinco cifras significativas.
13. Escriba el número 306,000,000 en notación científica al número apropiado de figuras significativas.
14. Escribe el número 0.0000558 en notación científica con dos cifras significativas.
15. Realizar cada cálculo y limitar cada respuesta a tres cifras significativas.
- 67,883 × 0.004321 =?
- (9.67 × 10 3) × 0.0055087 =?
16. Realizar cada cálculo y limitar cada respuesta a cuatro cifras significativas.
- 18,900 × 76.33 ÷ 0.00336 =?
- 0.77604 ÷ 76,003 × 8.888 =?
RESPUESTAS
1.
- 375 psi
- 1.30 cm
3.
- dos
- tres
- dos
- cuatro
5.
- cinco
- siete
- cinco
- cuatro
7.
- 59.4
- 1.011
- 13.2
- 88.2
9.
- 3.80 × 10 3
- 0.013
- 0.0130
- 11.4
11.
- 8.745 × 10 4
- 6.6600 × 10 −5
15.
- 293
- 53.3
2.4: Conversión de Unidades
- Escribe los dos factores de conversión que existen entre las dos unidades dadas.
- mililitros y litros
- microsegundos y segundos
- kilómetros y metros
-
- Escribe los dos factores de conversión que existen entre las dos unidades dadas.
- kilogramos y gramos
- milisegundos y segundos
- centímetros y metros
-
- Realiza las siguientes conversiones.
- 5.4 km a metros
- 0.665 m a milímetros
- 0.665 m a kilómetros
-
- Realiza las siguientes conversiones.
- 90.6 mL a litros
- 0.00066 ML a litros
- 750 L a kilolitros
-
- Realiza las siguientes conversiones.
- 17.8 μg a gramos
- 7.22 × 10 2 kg a gramos
- 0.00118 g a nanogramos
-
- Realiza las siguientes conversiones.
- 833 ns a segundos
- 5.809 s a milisegundos
- 2.77 × 10 6 s a megaseconds
-
- Realiza las siguientes conversiones.
- 9.44 m 2 a centímetros cuadrados
- 3.44 × 10 8 mm 3 a metros cúbicos
-
- Realiza las siguientes conversiones.
- 0.00444 cm 3 a metros cúbicos
- 8.11 × 10 2 m 2 a nanómetros cuadrados
-
¿Por qué sería inapropiado convertir centímetros cuadrados en metros cúbicos?
-
¿Por qué sería inapropiado convertir de metros cúbicos a segundos cúbicos?
-
- Realiza las siguientes conversiones.
- 45.0 m/min Para metros/segundo
- 0.000444 m/s Para micrómetros/segundo
- 60.0 km/h Para kilómetros/segundo
-
- Realiza las siguientes conversiones.
- 3.4 × 10 2 cm/s a centímetros/minuto
- 26.6 mm/s Para milímetros/hora
- 13.7 Kg/L a kilogramos/mililitros
-
- Realiza las siguientes conversiones.
- 0.674 kL a mililitros
- 2.81 × 10 12 mm a kilómetros
- 94.5 kg a miligramos
-
- Realiza las siguientes conversiones.
- 6.79 × 10 −6 kg a microgramos
- 1.22 mL a kilolitros
- 9.508 × 10 −9 ks a milisegundos
-
- Realiza las siguientes conversiones.
- 6.77 × 10 14 ms a kilosegundos
- 34,550,000 cm a kilómetros
-
- Realiza las siguientes conversiones.
- 4.701 × 10 15 mL a kilolitros
- 8.022 × 10 −11 ks a microsegundos
-
- Realiza las siguientes conversiones. Ten en cuenta que tendrás que convertir unidades tanto en el numerador como en el denominador.
- 88 pies/s a millas/hora (Pista: usar 5,280 ft = 1 mi.)
- 0.00667 km/h a metros/segundo
-
- Realiza las siguientes conversiones. Ten en cuenta que tendrás que convertir unidades tanto en el numerador como en el denominador.
- 3.88 × 10 2 mm/s Para kilómetros/hora
- 1.004 Kg/L a gramos/mililitro
-
¿Cuál es el área en milímetros cuadrados de un rectángulo cuyos lados son 2.44 cm × 6.077 cm? Expresar la respuesta al número adecuado de cifras significativas.
-
¿Cuál es el volumen en centímetros cúbicos de un cubo con lados de 0.774 m? Expresar la respuesta al número adecuado de cifras significativas.
-
La fórmula para el área de un triángulo es 1/2 × base × altura. ¿Cuál es el área de un triángulo en centímetros cuadrados si su base es de 1.007 m y su altura es de 0.665 m? Expresar la respuesta al número adecuado de cifras significativas.
La fórmula para el área de un triángulo es 1/2 × base × altura. ¿Cuál es el área de un triángulo en metros cuadrados si su base es de 166 mm y su altura es de 930.0 mm? Expresar la respuesta al número adecuado de cifras significativas.
RESPUESTAS
-
- \[\frac{1000mL}{1L} and \frac{1L}{1000mL}\nonumber \]
- \[\frac{1000000\mu s}{1s}and \frac{1s}{1000000\mu s}\nonumber \]
- \[\frac{1000m}{1km}and \frac{1km}{1000m}\nonumber \]
- 5,400 m
- 665 mm
- 6.65 × 10 −4 km
-
- 1.78 × 10 −5 g
- 7.22 × 10 5 g
- 1.18 × 10 6 ng
-
- 94,400 cm 2
- 0.344 m 3
-
Una es una unidad de área y la otra es una unidad de volumen.
-
- 0.75 m/s
- 444 µm/s
- 1.666 × 10 −2 km/s
-
- 674,000 mL
- 2.81 × 10 6 km
- 9.45 × 10 7 mg
-
- 6.77 × 10 8 ks
- 345.5 km
-
- 6.0 × 10 1 mi/h
- 0.00185 m/s
-
1.48 × 10 3 mm 2
-
3.35 × 10 3 cm 2
2.5: Otras Unidades - Temperatura y Densidad
- Realiza las siguientes conversiones.
- 255°F a grados Celsius
- −255°F a grados Celsius
- 50.0°C a grados Fahrenheit
- −50.0°C a grados Fahrenheit
-
- Realiza las siguientes conversiones.
- 1,065°C a grados Fahrenheit
- −222°C a grados Fahrenheit
- 400.0°F a grados Celsius
- 200.0°F a grados Celsius
-
- Realiza las siguientes conversiones.
- 100.0°C a kelvin
- −100.0°C a kelvin
- 100 K a grados Celsius
- 300 K a grados Celsius
-
- Realiza las siguientes conversiones.
- 1,000.0 K a grados Celsius
- 50.0 K a grados Celsius
- 37.0°C a kelvins
- −37.0°C a kelvin
-
Convierte 0 K a grados Celsius. ¿Cuál es el significado de la temperatura en grados Celsius?
-
Convierte 0 K a grados Fahrenheit. ¿Cuál es el significado de la temperatura en grados Fahrenheit?
-
La temperatura más alta jamás registrada en la superficie de la tierra fue de 136°F en Libia en 1922. ¿Cuál es la temperatura en grados Celsius y en Kelvin?
-
La temperatura más fría jamás registrada en la superficie de la tierra fue de −128.6°F en Vostok, Antártida, en 1983. ¿Cuál es la temperatura en grados Celsius y en Kelvin?
-
Dar al menos tres unidades posibles para densidad.
-
¿Cuáles son las unidades cuando se invierte la densidad? Dar tres ejemplos.
-
Una muestra de hierro tiene un volumen de 48.2 cm 3. ¿Cuál es su masa?
-
Una muestra de aire tiene un volumen de 1,015 mL. ¿Cuál es su masa?
-
El volumen de hidrógeno utilizado por el Hindenburg, el dirigible alemán que explotó en Nueva Jersey en 1937, fue de 2.000 × 10 8 L. Si el gas hidrógeno tiene una densidad de 0.0899 g/L, ¿qué masa de hidrógeno utilizó el dirigible?
-
El volumen de una piscina olímpica es de 2.50 × 10 9 cm 3. Si la alberca está llena de alcohol (d = 0.789 g/cm 3), ¿qué masa de alcohol hay en la alberca?
-
Un anillo de compromiso típico tiene 0.77 cm 3 de oro. ¿Qué masa de oro está presente?
-
Un termómetro de mercurio típico tiene 0.039 mL de mercurio en él. ¿Qué masa de mercurio hay en el termómetro?
-
¿Cuál es el volumen de 100.0 g de plomo si el plomo tiene una densidad de 11.34 g/cm 3?
-
¿Cuál es el volumen de 255.0 g de uranio si el uranio tiene una densidad de 19.05 g/cm 3?
-
¿Cuál es el volumen en litros de 222 g de neón si el neón tiene una densidad de 0.900 g/L?
-
¿Cuál es el volumen en litros de 20.5 g de hexafluoruro de azufre si el hexafluoruro de azufre tiene una densidad de 6.164 g/L?
- ¿Cuál tiene el mayor volumen, 100.0 g de hierro (d = 7.87 g/cm 3) o 75.0 g de oro (d = 19.3 g/cm 3)?
- ¿Cuál tiene el mayor volumen, 100.0 g de gas hidrógeno (d = 0.0000899 g/cm 3) o 25.0 g de gas argón (d = 0.00178 g/cm 3)?
RESPUESTAS
- 124°C
- −159°C
- 122°F
- −58°F
-
- 373 K
- 173 K
- −173°C
- 27°C
-
−273°C. Esta es la temperatura más baja posible en grados Celsius.
-
57,8°C; 331 K
-
g/mL, g/L y Kg/L (las respuestas variarán)
-
379 g
-
1.80 × 10 7 g
-
15 g
-
8.818 cm 3
-
247 L
-
Los 100.0 g de hierro tienen el mayor volumen
Ejercicios adicionales
- Evaluar 0.00000000552 × 0.0000000006188 y expresar la respuesta en notación científica. Es posible que tengas que reescribir primero los números originales en notación científica.
-
Evalúa 333,999,500,000 ÷ 0.00000000003396 y expresa la respuesta en notación científica. Es posible que primero deba reescribir los números originales en notación científica.
-
Exprese el número 6.022 × 10 23 en notación estándar.
-
Exprese el número 6.626 × 10 −34 en notación estándar.
-
Cuando los poderes de 10 se multiplican juntos, los poderes se suman. Por ejemplo, 10 2 × 10 3 = 10 2+3 = 10 5. Con esto en mente, ¿puedes evaluar (4.506 × 10 4) × (1.003 × 10 2) sin ingresar notación científica en tu calculadora?
-
Cuando las potencias de 10 se dividen entre sí, el exponente inferior se resta del exponente superior. Por ejemplo, 10 5 /10 3 = 10 5−3 = 10 2. Con esto en mente, ¿puedes evaluar (8.552 × 10 6) ÷ (3.129 × 10 3) sin ingresar notación científica en tu calculadora?
-
Considera la cantidad dos docenas de huevos. ¿El número en esta cantidad es “dos” o “dos docenas”? Justifica tu elección.
-
Considera la cantidad dos docenas de huevos. ¿La unidad en esta cantidad es “huevos” o “docena de huevos”? Justifica tu elección.
-
Rellene el espacio en blanco: 1 km = ______________ μm.
-
Rellene el espacio en blanco: 1 Ms = ______________ ns.
-
Rellene el espacio en blanco: 1 cL = ______________ ML.
-
Rellene el blanco: 1 mg = ______________ kg.
-
Expresa 67.3 km/h en metros/segundo.
-
Express 0.00444 m/s en kilómetros/hora.
-
Usando la idea de que 1.602 km = 1.000 mi, convierta una velocidad de 60.0 mi/h en kilómetros/hora.
-
Usando la idea de que 1.602 km = 1.000 mi, convierta una velocidad de 60.0 km/h en millas/hora.
-
Convierte 52.09 km/h en metros/segundo.
-
Convierte 2.155 m/s en kilómetros/hora.
-
Utilice las fórmulas para convertir grados Fahrenheit en grados Celsius para determinar el tamaño relativo del grado Fahrenheit sobre el grado Celsius.
-
Utilice las fórmulas para convertir grados Celsius en kelvin para determinar el tamaño relativo del grado Celsius sobre kelvin.
-
¿Cuál es la masa de 12.67 L de mercurio?
-
¿Cuál es la masa de 0.663 m 3 de aire?
-
¿Cuál es el volumen de 2.884 kg de oro?
-
¿Cuál es el volumen de 40.99 kg de corcho? Asumir una densidad de 0.22 g/cm 3.
RESPUESTAS
- 3.42 × 10 −18
-
602,200,000,000,000,000,000,000
-
4.520 × 10 6
-
La cantidad es de dos; docena es la unidad.
-
1,000,000,000
-
1/100,000,000
-
18.7 m/s
-
96.1 km/h
-
14.47 m/s
-
Un grado Fahrenheit es nueve quintas partes del tamaño de un grado Celsius.
-
1.72 × 10 5 g
-
149 mL