3.2: Teoría atómica
- Page ID
- 74835
- Estado de la teoría atómica moderna.
- Aprende cómo se construyen los átomos.
La pieza más pequeña de un elemento que mantiene la identidad de ese elemento se llama átomo. Los átomos individuales son extremadamente pequeños. Se necesitarían unos cincuenta millones de átomos seguidos para hacer una línea de 1 cm de largo. El periodo al final de una oración impresa tiene varios millones de átomos en ella. Los átomos son tan pequeños que es difícil creer que toda la materia esté hecha de átomos, pero lo es.
El concepto de que los átomos juegan un papel fundamental en la química está formalizado por la teoría atómica moderna, planteada por primera vez por John Dalton, un científico inglés, en 1808. Consta de tres partes:
- Toda la materia está compuesta por átomos.
- Los átomos del mismo elemento son iguales; los átomos de diferentes elementos son diferentes.
- Los átomos se combinan en proporciones de número entero para formar compuestos.
Estos conceptos forman la base de la química. Aunque la palabra átomo proviene de una palabra griega que significa “indivisible”, ahora entendemos que los átomos mismos están compuestos por partes más pequeñas llamadas partículas subatómicas. La primera parte que se descubrió fue el electrón, una pequeña partícula subatómica con carga negativa. A menudo se representa como e −, con el superíndice correcto que muestra la carga negativa. Posteriormente, se descubrieron dos partículas más grandes. El protón es una partícula subatómica más masiva (pero aún diminuta) con una carga positiva, representada como p +. El neutrón es una partícula subatómica con aproximadamente la misma masa que un protón, pero sin carga. Se representa como n o n 0. Ahora sabemos que todos los átomos de todos los elementos están compuestos por electrones, protones y (con una excepción) neutrones. La tabla\(\PageIndex{1}\) resume las propiedades de estas tres partículas subatómicas.
| Nombre | Símbolo | Masa (aprox.; kg) | Cargar |
|---|---|---|---|
| Protón | p + | 1.6 × 10 −27 | 1+ |
| Neutrón | n, n 0 | 1.6 × 10 −27 | ninguno |
| Electron | e − | 9.1 × 10 −31 | 1− |
¿Cómo están dispuestas estas partículas en átomos? No están dispuestos al azar. Los experimentos de Ernest Rutherford en Inglaterra en la década de 1910 apuntaron a un modelo nuclear con átomos que tiene los protones y neutrones en un núcleo central con los electrones en órbita alrededor del núcleo. Los protones y neutrones relativamente masivos se recogen en el centro de un átomo, en una región llamada núcleo del átomo (núcleos plurales). Los electrones están fuera del núcleo y pasan su tiempo orbitando en el espacio alrededor del núcleo. (Figura\(\PageIndex{1}\)).
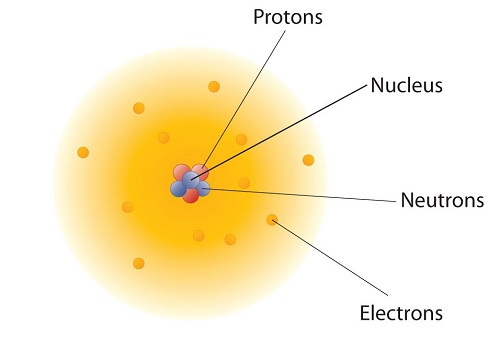
La teoría atómica moderna afirma que los átomos de un elemento son los mismos, mientras que los átomos de diferentes elementos son diferentes. ¿Qué hace que los átomos de diferentes elementos sean diferentes? La característica fundamental que comparten todos los átomos del mismo elemento es el número de protones. Todos los átomos de hidrógeno tienen un solo protón en el núcleo; todos los átomos de hierro tienen 26 protones en el núcleo. Este número de protones es tan importante para la identidad de un átomo que se le llama el número atómico. El número de protones en un átomo es el número atómico del elemento. Así, el hidrógeno tiene un número atómico de 1, mientras que el hierro tiene un número atómico de 26. Cada elemento tiene su propio número atómico característico.
Sin embargo, los átomos del mismo elemento pueden tener diferentes números de neutrones. Los átomos del mismo elemento (es decir, átomos con el mismo número de protones) con diferentes números de neutrones se denominan isótopos. La mayoría de los elementos naturales existen como isótopos. Por ejemplo, la mayoría de los átomos de hidrógeno tienen un solo protón en su núcleo. Sin embargo, un pequeño número (aproximadamente uno en un millón) de átomos de hidrógeno tienen un protón y un neutrón en sus núcleos. Este isótopo particular de hidrógeno se llama deuterio. Una forma muy rara de hidrógeno tiene un protón y dos neutrones en el núcleo; este isótopo de hidrógeno se llama tritio. La suma del número de protones y neutrones en el núcleo se denomina número de masa del isótopo.
Los átomos neutros tienen el mismo número de electrones que tienen protones, por lo que su carga general es cero. No obstante, como veremos más adelante, no siempre será así.
- Los átomos de carbono más comunes tienen seis protones y seis neutrones en sus núcleos. ¿Cuáles son el número atómico y el número de masa de estos átomos de carbono?
- Un isótopo de uranio tiene un número atómico de 92 y un número másico de 235. ¿Cuál es el número de protones y neutrones en el núcleo de este átomo?
Solución
- Si un átomo de carbono tiene seis protones en su núcleo, su número atómico es 6. Si también tiene seis neutrones en el núcleo, entonces el número de masa es 6 + 6, o 12.
- Si el número atómico del uranio es 92, entonces ese es el número de protones en el núcleo. Debido a que el número de masa es 235, entonces el número de neutrones en el núcleo es 235 − 92, o 143.
El número de protones en el núcleo de un átomo de estaño es de 50, mientras que el número de neutrones en el núcleo es de 68. ¿Cuáles son el número atómico y el número de masa de este isótopo?
- Responder
-
Número atómico = 50, número de masa = 118
Al referirnos a un átomo, simplemente usamos el nombre del elemento: el término sodio se refiere al elemento así como a un átomo de sodio. Pero puede ser difícil de manejar usar el nombre de los elementos todo el tiempo. En cambio, la química define un símbolo para cada elemento. El símbolo atómico es una representación de una o dos letras del nombre de un elemento. Por convención, la primera letra del símbolo de un elemento siempre está mayúscula, mientras que la segunda letra (si está presente) es minúscula. Así, el símbolo para hidrógeno es H, el símbolo para el sodio es Na y el símbolo para el níquel es Ni. La mayoría de los símbolos provienen del nombre inglés del elemento, aunque algunos símbolos provienen del nombre latino de un elemento. (El símbolo del sodio, Na, proviene de su nombre latino, natrium.) Tabla\(\PageIndex{2}\) enumera algunos elementos comunes y sus símbolos. Deberás memorizar los símbolos en Tabla\(\PageIndex{2}\), ya que así es como estaremos representando los elementos a lo largo de la química.
| Nombre del elemento | Símbolo | Nombre del elemento | Símbolo |
|---|---|---|---|
| Aluminio | Al | Mercurio | Hg |
| Argón | Ar | Molibdeno | Mo |
| Arsénico | Como | Neón | Ne |
| Bario | Ba | Níquel | Ni |
| Berilio | Be | Nitrógeno | N |
| Bismuto | Bi | Oxígeno | O |
| Boro | B | Palladium | Pd |
| Bromo | Br | Fosforo | P |
| Calcio | Ca | Platino | Pt |
| Carbono | C | Potasio | K |
| Cloro | Cl | Radio | Ra |
| Cromo | Cr | Radón | Rn |
| Cobalto | Co | Rubidio | Rb |
| Cobre | Cu | Scandium | Sc |
| Flúor | F | Selenio | Se |
| Galio | Ga | Silicio | Si |
| Germanio | Ge | Plata | Ag |
| Oro | Au | Sodio | Na |
| Helio | Él | Estroncio | Sr |
| Hidrógeno | H | Azufre | S |
| Yodo | I | Tantalio | Ta |
| Iridio | Ir | Estaño | Sn |
| Hierro | Fe | Titanio | Ti |
| Criptón | Kr | Tungsteno | W |
| Plomo | Pb | Uranio | U |
| Litio | Li | Xenon | Xe |
| Magnesio | Mg | Zinc | Zn |
| Manganeso | Mn | Circonio | Zr |
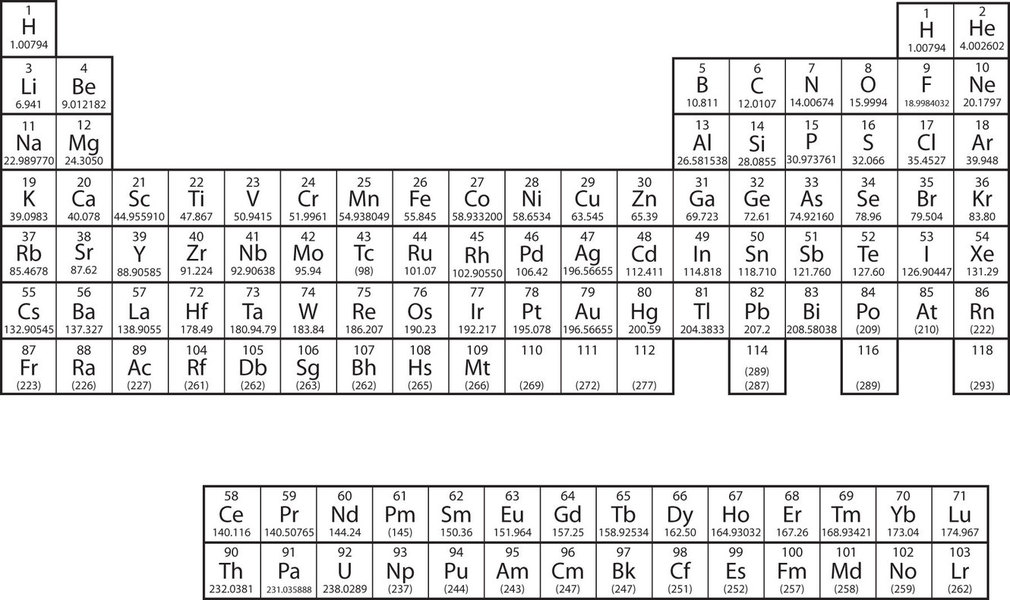
Los elementos se agrupan en una tabla especial llamada tabla periódica de todos los elementos. En la Figura se muestra una tabla periódica simple\(\PageIndex{2}\), mientras que se puede ver una tabla periódica más extensa de otra fuente. Los elementos de la tabla periódica se listan en orden de número atómico ascendente. La tabla periódica tiene una forma especial que será importante para nosotros cuando consideremos la organización de los electrones en átomos (Capítulo 8). Un uso inmediato de la tabla periódica nos ayuda a identificar metales y no metales. Los no metales se encuentran en la esquina superior derecha de la tabla periódica, en un lado de la línea pesada dividiendo la parte derecha del gráfico. Todos los demás elementos son metales.
Hay una manera fácil de representar isótopos usando los símbolos atómicos. Utilizamos la construcción:
\[\ce{_{Z}^{A}X}\nonumber \]
donde\(X\) está el símbolo del elemento,\(A\) es el número de masa, y\(Z\) es el número atómico. Así, para el isótopo de carbono que tiene 6 protones y 6 neutrones, el símbolo es:
\[\ce{_{6}^{12}C}\nonumber \]
donde\(C\) es el símbolo para el elemento, 6 representa el número atómico y 12 representa el número de masa.
- ¿Cuál es el símbolo de un isótopo de uranio que tiene un número atómico de 92 y un número de masa de 235?
- Cuántos protones y neutrones hay en\(\ce{_{26}^{56}Fe}\)
Solución
- El símbolo de este isótopo es\(\ce{_{92}^{235}U}\)
- Este átomo de hierro tiene 26 protones y 56 − 26 = 30 neutrones.
Cuántos protones hay en\(\ce{_{11}^{23} Na}\)
- Responder
-
11 protones
También es común indicar el número de masa después del nombre de un elemento para indicar un isótopo en particular. El carbono-12 representa un isótopo de carbono con 6 protones y 6 neutrones, mientras que el uranio-238 es un isótopo de uranio que tiene 146 neutrones.
Claves para llevar
- La química se basa en la teoría atómica moderna, que establece que toda la materia está compuesta por átomos.
- Los átomos mismos están compuestos por protones, neutrones y electrones.
- Cada elemento tiene su propio número atómico, que es igual al número de protones en su núcleo.
- Los isótopos de un elemento contienen diferentes números de neutrones.
- Los elementos están representados por un símbolo atómico.
- La tabla periódica es un gráfico que organiza todos los elementos.


