3.E: Átomos, Moléculas e Iones (Ejercicios)
- Page ID
- 74824
3.1: Teoría atómica
1. Enumerar las tres afirmaciones que conforman la teoría atómica moderna.
2. Explicar cómo se componen los átomos.
3. ¿Cuál es más grande, un protón o un electrón?
4. ¿Cuál es más grande, un neutrón o un electrón?
5. ¿Cuáles son las cargas por cada una de las tres partículas subatómicas?
6. ¿Dónde se encuentra la mayor parte de la masa de un átomo?
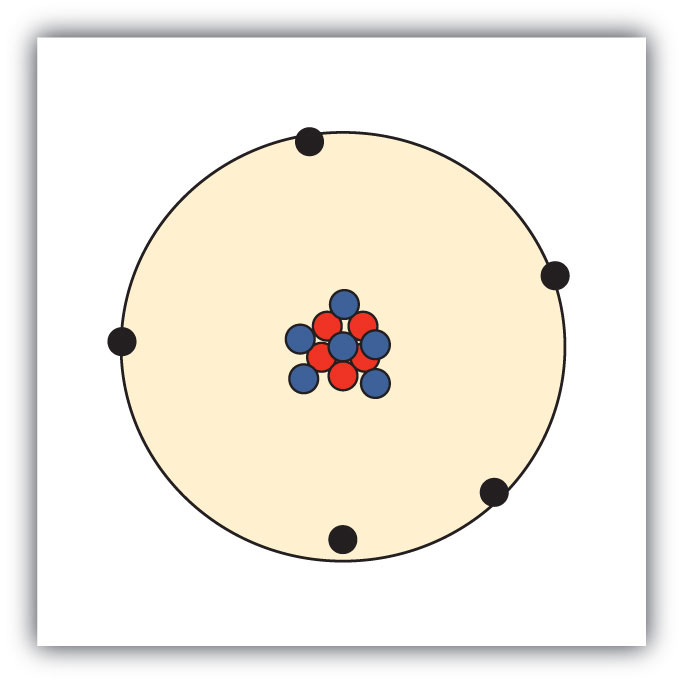
7. Esbozar un diagrama de un átomo de boro, que tiene cinco protones y seis neutrones en su núcleo.
8. Esbozar un diagrama de un átomo de helio, que tiene dos protones y dos neutrones en su núcleo.
9. Definir número atómico. ¿Cuál es el número atómico de un átomo de boro?
10. ¿Cuál es el número atómico del helio?
11. Definir isótopo y dar un ejemplo.
12. ¿Cuál es la diferencia entre deuterio y tritio?
13. ¿Qué par representa isótopos?
- \[_{2}^{4}\textrm{He} \, and\: \, _{2}^{3}\textrm{He}\]
- \[_{26}^{56}\textrm{Fe} \, and\: \, _{25}^{56}\textrm{Mn}\]
- \[_{14}^{28}\textrm{Si} \, and\: \, _{15}^{31}\textrm{P}\]
14. ¿Qué par representa isótopos?
- \[_{20}^{40}\textrm{Ca} \, and\: \, _{19}^{40}\textrm{K}\]
- \[_{26}^{56}\textrm{Fe} \, and\: \, _{28}^{56}\textrm{Fe}\]
- \[_{92}^{238}\textrm{U} \, and\: \, _{92}^{235}\textrm{U}\]
- Dar símbolos completos de cada átomo, incluyendo el número atómico y el número de masa.
a. un átomo de oxígeno con 8 protones y 8 neutrones
b. un átomo de potasio con 19 protones y 20 neutrones
c. un átomo de litio con 3 protones y 4 neutrones - Dar símbolos completos de cada átomo, incluyendo el número atómico y el número de masa.
a. un átomo de magnesio con 12 protones y 12 neutrones
b. un átomo de magnesio con 12 protones y 13 neutrones
c. un átomo de xenón con 54 protones y 77 neutrones -
El americio-241 es un isótopo utilizado en los detectores de humo. ¿Cuál es el símbolo completo de este isótopo?
18. El carbono-14 es un isótopo utilizado para realizar pruebas de datación radiactiva en material previamente vivo. ¿Cuál es el símbolo completo de este isótopo?
-
Dar símbolos atómicos para cada elemento.
a. sodio
b. argón
c. nitrógeno
d. radón -
Dar símbolos atómicos para cada elemento.a. platab. oroc. mercuriod. yodo
-
Dar el nombre del elemento.A.sib. Mnc. Fed. Cr
-
Dar el nombre del elemento.a. Fb. Clc. Brd. yo
RESPUESTAS
- Toda la materia está compuesta por átomos; los átomos del mismo elemento son los mismos, y los átomos de diferentes elementos son diferentes; los átomos se combinan en proporciones de número entero para formar compuestos.
-
-
Un protón es más grande que un electrón.
-
protón: 1+; electrón: 1−; neutrón: 0
- El número atómico es el número de protones en un núcleo. El boro tiene un número atómico de cinco.
-
-
Los isótopos son átomos del mismo elemento pero con diferentes números de neutrones. \[_{1}^{1}\textrm{H} \, and\: \, _{1}^{2}\textrm{H}\]
-
- isótopos
- no isótopos
- no isótopos
-
-
\[_{8}^{16}\textrm{O}\]
-
\[_{19}^{39}\textrm{K}\]
-
\[_{3}^{7}\textrm{Li}\]
-
-
\[_{95}^{241}\textrm{Am}\]
-
-
Na
-
Ar
-
N
-
Rn
-
-
- silicio
- manganeso
- hierro
- cromo
3.2: Moléculas y Nomenclatura Química
- ¿Cuál de estas fórmulas representa moléculas? Anote cuántos átomos hay en cada molécula.
- Fe
- PCl 3
- P 4
- Ar
- ¿Cuál de estas fórmulas representa moléculas? Anote cuántos átomos hay en cada molécula.
- I 2
- Él
- H 2 O
- Al
-
¿Cuál es la diferencia entre CO y Co?
-
¿Cuál es la diferencia entre H 2 O y H 2 O 2 (peróxido de hidrógeno)?
-
Dar la fórmula adecuada para cada elemento diatómico.
-
En 1986, cuando el cometa Halley pasó por última vez la tierra, los astrónomos detectaron la presencia de S 2 en sus telescopios. ¿Por qué el azufre no se considera un elemento diatómico?
-
¿Cuál es el tallo del flúor utilizado en los nombres de las moléculas? CF 4 es un ejemplo.
- ¿Cuál es el tallo del selenio utilizado en los nombres de moléculas? SiSe 2 es un ejemplo.
- Dar el nombre propio para cada molécula.
- PF 3
- TecL 2
- N 2 O 3
- Dar el nombre propio para cada molécula.
- NO
- CS 2
- Como 2 O 3
- Dar el nombre propio para cada molécula.
- xEF 2
- O 2 F 2
- SF 6
- Dar el nombre propio para cada molécula.
- P 4 O 10
- B 2 O 3
- P 2 S 3
- Dar el nombre propio para cada molécula.
- N 2 O
- N 2 O 4
- N 2 O 5
- Dar el nombre propio para cada molécula.
- SeO 2
- Cl 2 O
- xEF 6
- Dar la fórmula adecuada para cada nombre.
- pentóxido de dinitrógeno
- tricarburo de tetraborón
- pentacloruro de fósforo
- Dar la fórmula adecuada para cada nombre.
- triyoduro de nitrógeno
- trisulfuro de diarsénico
- tricloruro de yodo
- Dar la fórmula adecuada para cada nombre.
- dicloruro de dioxígeno
- trisulfuro de dinitrógeno
- tetrafluoruro de xenón
- Dar la fórmula adecuada para cada nombre.
- dióxido de cloro
- dibromuro de selenio
- trióxido de dinitrógeno
- Dar la fórmula adecuada para cada nombre.
- trifluoruro de yodo
- trióxido de xenón
- decafluoruro de disulfur
- Dar la fórmula adecuada para cada nombre.
- dióxido de germanio
- disulfuro de carbono
- dibromuro de diselenio
RESPUESTAS
-
- no una molécula
- una molécula; cuatro átomos en total
- una molécula; cuatro átomos en total
- El CO es un compuesto de carbono y oxígeno; el Co es el elemento cobalto.
- H 2, O 2, N 2, F 2, Cl 2, Br 2, I 2
- fluor-
-
- trifluoruro de fósforo
- dicloruro de teluro
- trióxido de dinitrógeno
-
- difluoruro de xenón
- difluoruro de dioxígeno
- hexafluoruro de azufre
-
- monóxido de dinitrógeno
- tetroxido de dinitrógeno
- pentóxido de dinitrógeno
-
- N 2 O 5
- B 4 C 3
- PCl 5
-
- O 2 Cl 2
- N 2 S 3
- xEF 4
-
- SI 3
- XEo 3
- S 2 F 10
3.3: Masas de átomos y moléculas
- Definir unidad de masa atómica. ¿Cuál es su abreviatura?
- Definir masa atómica. ¿Cuál es su unidad?
- Estimar la masa, en números enteros, de cada isótopo.
- hidrógeno-1
- hidrógeno-3
- hierro-56
- Estimar la masa, en números enteros, de cada isótopo.
- fósforo-31
- carbono-14
- americio-241
- Determinar la masa atómica de cada elemento, dada la composición isotópica.
- litio, que es 92.4% litio-7 (masa 7.016 u) y 7.60% litio-6 (masa 6.015 u)
- oxígeno, que es 99.76% oxígeno-16 (masa 15.995 u), 0.038% oxígeno-17 (masa 16.999 u) y 0.205% oxígeno-18 (masa 17.999 u)
- Determinar la masa atómica de cada elemento, dada la composición isotópica.
- neón, que es 90.48% neón-20 (masa 19.992 u), 0.27% neón-21 (masa 20.994 u) y 9.25% neón-22 (masa 21.991 u)
- uranio, que es 99.27% uranio-238 (masa 238.051 u) y 0.720% uranio-235 (masa 235.044 u)
- ¿Qué tan lejos estaría tu respuesta del Ejercicio 5a si usaras masas de número entero para isótopos individuales de litio?
- ¿Qué tan lejos estaría tu respuesta del Ejercicio 6b si usaras masas de número entero para isótopos individuales de uranio?
-
- ¿Cuál es la masa atómica de un átomo de oxígeno?
- ¿Cuál es la masa molecular del oxígeno en su forma elemental?
-
- ¿Cuál es la masa atómica del bromo?
- ¿Cuál es la masa molecular del bromo en su forma elemental?
- Determinar la masa de cada sustancia.
- F 2
- CO
- CO 2
- Determinar la masa de cada sustancia.
- Kr
- KRF 4
- PF 5
- Determinar la masa de cada sustancia.
- Na
- B 2 O 3
- S 2 Cl 2
- Determinar la masa de cada sustancia.
- iBr 3
- N 2 O 5
- CCl 4
- Determinar la masa de cada sustancia.
- GeO 2
- SI 3
- xEF 6
- Determinar la masa de cada sustancia.
- NO
- N 2 O 4
- Ca
RESPUESTAS
- La unidad de masa atómica se define como una doceava parte de la masa de un átomo de carbono-12. Su abreviatura es u.
-
- 1
- 3
- 56
-
- 6.940 u
- 16.000 u
- Obtendríamos 6.924 u.
-
- 15.999 u
- 31.998 u
-
- 37.996 u
- 28.010 u
- 44.009 u
-
- 22.990 u
- 69.619 u
- 135.036 u
-
- 104.64 u
- 183.898 u
- 245.281 u
3.4: Iones y Compuestos Iónicos
- Explica cómo se forman los cationes.
- Explica cómo se forman los aniones.
- Da la carga que toma cada átomo cuando forma un ion. Si es posible más de un cargo, enumere ambos.
- K
- O
- Co
- Da la carga que toma cada átomo cuando forma un ion. Si es posible más de un cargo, enumere ambos.
- Ca
- I
- Fe
- Da la carga que toma cada átomo cuando forma un ion. Si es posible más de un cargo, enumere ambos.
- Ag
- Au
- Br
- Da la carga que toma cada átomo cuando forma un ion. Si es posible más de un cargo, enumere ambos.
- S
- Na
- H
- Nombra los iones del Ejercicio 3.
- Nombra los iones del Ejercicio 4.
- Nombra los iones del Ejercicio 5.
- Nombra los iones del Ejercicio 6.
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- Mg 2 + y Cl −
- Fe 2 + y O 2−
- Fe 3 + y O 2−
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- K + y S 2−
- Ag + y Br −
- Sr 2 + y N 3−
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- Cu 2 + y F −
- Ca 2 + y O 2−
- K + y P 3−
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- Na + y N 3−
- Co 2 + y I −
- Au 3 + y S 2−
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- K + y SO 4 2 −
- NH 4 + y S 2−
- NH 4 + y PO 4 3 −
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- Ca 2 + y NO 3 −
- Ca 2 + y NO 2 −
- Sc 3 + y C 2 H 3 O 2 −
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- Pb 4 + y SO 4 2 −
- Na + y I 3 −
- Li + y Cr 2 O 7 2 −
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- NH 4 + y N 3−
- Mg 2 + y CO 3 2 −
- Al 3 + y OH −
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- Ag + y SO 3 2 −
- Na + y HCO 3 −
- Fe 3 + y ClO 3 −
- Dar la fórmula y el nombre para cada compuesto iónico formado entre los dos iones enumerados.
- Rb + y O 2 2 −
- Au 3 + y HSO 4 −
- Sr 2 + y NO 2 −
- ¿Cuál es la diferencia entre SO 3 y SO 3 2 −?
- ¿Cuál es la diferencia entre NO 2 y NO 2 −?
RESPUESTAS
- Los cationes se forman perdiendo electrones.
-
- 1+
- 2−
- 2+, 3+
-
- 1+
- 1+, 3+
- 1−
-
- el ion potasio
- el ion óxido
- los iones cobalto (II) y cobalto (III), respectivamente
-
- el ion de plata
- los iones oro (I) y oro (III), respectivamente
- el ion bromuro
-
- cloruro de magnesio, MgCl 2
- óxido de hierro (II), FeO
- óxido de hierro (III), Fe 2 O 3
-
- fluoruro de cobre (II), CuF 2
- óxido de calcio, CaO
- fosfuro de potasio, K 3 P
-
- sulfato de potasio, K 2 SO 4
- sulfuro de amonio, (NH 4) 2 S
- fosfato de amonio, (NH 4) 3 PO 4
-
- sulfato de plomo (IV), Pb (SO 4) 2
- triyoduro de sodio, NaI 3
- dicromato de litio, Li 2 Cr 2 O 7
-
- sulfito de plata, Ag 2 SO 3
- hidrogenocarbonato de sodio, NaHCO 3
- clorato de hierro (III), Fe (ClO 3) 3
- SO 3 es trióxido de azufre, mientras que SO 3 2 − es el ion sulfito.
3.5: Ácidos
- Dar la fórmula para cada ácido.
- ácido perclórico
- ácido hidriódico
- Dar la fórmula para cada ácido.
- ácido hidrosulfúrico
- ácido fosforoso
- Nombra cada ácido.
- HF (aq)
- HNO 3 (ac)
- H 2 C 2 O 4 (aq)
- Nombra cada ácido.
- H 2 SO 4 (aq)
- H 3 PO 4 (aq)
- HCl (aq)
- Nombra un ácido que se encuentra en los alimentos.
- Nombra algunas propiedades que los ácidos tienen en común.
RESPUESTAS
-
- HClO 4 (ac)
- HI (aq)
-
- ácido fluorhídrico
- ácido nítrico
- ácido oxálico
- ácido oxálico (las respuestas variarán)
Ejercicios adicionales
- ¿Cuántos electrones se necesitan para hacer la masa de un protón?
-
¿Cuántos protones se necesitan para hacer la masa de un neutrón?
-
La versión inicial de Dalton de la teoría atómica moderna dice que todos los átomos del mismo elemento son iguales. ¿Es esto realmente correcto? ¿Por qué o por qué no?
-
¿Cómo son iguales los átomos del mismo elemento? ¿En qué se diferencian los átomos del mismo elemento?
-
Dar símbolos atómicos completos para los tres isótopos conocidos de hidrógeno.
-
Un isótopo raro de helio tiene un solo neutrón en su núcleo. Escribe el símbolo atómico completo de este isótopo.
-
Utilice su lugar en la tabla periódica para determinar si el indio, In, número atómico 49, es un metal o un no metal.
-
Sólo se han detectado unos pocos átomos de astatina, At, número atómico 85. En base a su posición sobre la tabla periódica, ¿esperaría que fuera un metal o un no metal?
-
El americio-241 es una parte crucial de muchos detectores de humo. ¿Cuántos neutrones están presentes en su núcleo?
- El potasio-40 es un isótopo radiactivo del potasio que está presente en el cuerpo humano. ¿Cuántos neutrones están presentes en su núcleo?
- Determinar la masa atómica de rutenio a partir de los datos de abundancia y masa dados.
| Rutenio-96 | 5.54% | 95.907 u |
| Rutenio-98 | 1.87% | 97.905 u |
| Rutenio-99 | 12.76% | 98.906 u |
| Rutenio-100 | 12.60% | 99.904 u |
| Rutenio-101 | 17.06% | 100.906 u |
| Rutenio-102 | 31.55% | 101.904 u |
| Rutenio-104 | 18.62% | 103.905 u |
- Determinar la masa atómica del teluro a partir de los datos de abundancia y masa dados.
| Telurio-120 | 0.09% | 119.904 u |
| Telurio-122 | 2.55% | 121.903 u |
| Tellurio-123 | 0.89% | 122.904 u |
| Tellurio-124 | 4.74% | 123.903 u |
| Telurio-125 | 7.07% | 124.904 u |
| Telurio-126 | 18.84% | 125.903 u |
| Telurio-128 | 31.74% | 127.904 u |
| Telurio-130 | 34.08% | 129.906 u |
- Una unidad de masa atómica tiene una masa de 1.6605 × 10 −24 g. ¿Cuál es la masa de un átomo de sodio?
-
Una unidad de masa atómica tiene una masa de 1.6605 × 10 −24 g. ¿Cuál es la masa de un átomo de uranio?
-
Una unidad de masa atómica tiene una masa de 1.6605 × 10 −24 g. ¿Cuál es la masa de una molécula de H 2 O?
-
Una unidad de masa atómica tiene una masa de 1.6605 × 10 −24 g. ¿Cuál es la masa de una molécula de PF 5?
-
A partir de sus posiciones en la tabla periódica, ¿el Cu y yo formaremos un compuesto molecular o un compuesto iónico?
- A partir de sus posiciones en la tabla periódica, ¿N y S formarán un compuesto molecular o un compuesto iónico?
- El mercurio es un elemento inusual en que cuando toma una carga 1+ como catión, siempre existe como el ion diatómico.
- Proponer una fórmula para el ion mercurio (I).
- ¿Cuál es la fórmula del cloruro de mercurio (I)?
- Proponer una fórmula para el peróxido de hidrógeno, sustancia utilizada como agente blanqueador. (Curiosamente, este compuesto no se comporta como un ácido, a pesar de su fórmula. Se comporta más como un compuesto molecular clásico no metálico, no metálico).
- El catión uranilo tiene la fórmula UO 2 2 +. Proponer fórmulas y nombres para los compuestos iónicos entre el catión uranilo y F −, SO 4 2 − y PO 4 3 −.
- El anión permanganato tiene la fórmula MnO 4 −. Proponer fórmulas y nombres para los compuestos iónicos entre el ion permanganato y K +, Ca 2 + y Fe 3 +.
RESPUESTAS
- cerca de 1,800 electrones
-
-
No es estrictamente correcto por la existencia de isótopos.
-
-
\[_{1}^{1}\textrm{H},\; _{1}^{2}\textrm{H},\, and\; _{1}^{3}\textrm{H}\]
-
-
Es un metal.
-
-
146 neutrones
-
-
101.065 u
-
-
3.817 × 10 −23 g
-
-
2.991 × 10 −23 g
-
-
iónico
-
-
-
Hg 2 2 +
-
Hg 2 Cl 2
-
-
-
fluoruro de uranilo, UO 2 F 2; sulfato de uranilo, UO 2 SO 4; fosfato de uranilo, (UO 2) 3 (PO 4) 2