8.4: Organización de los Electrones en Átomos
- Page ID
- 74864
- Aprende cómo se organizan los electrones dentro de los átomos.
- Representar la organización de los electrones por una configuración electrónica.
Ahora que sabes que los electrones tienen números cuánticos, ¿cómo están dispuestos en átomos? La clave para entender la disposición electrónica se resume en el principio de exclusión de Pauli: no hay dos electrones en un átomo que puedan tener el mismo conjunto de cuatro números cuánticos. Esto limita drásticamente el número de electrones que pueden existir en un caparazón o en una subcapa.
Los electrones se organizan típicamente alrededor de un átomo comenzando primero en los números cuánticos más bajos posibles, que son las cáscaras subcáscaras con energías más bajas. Considera H, un átomo con un solo electrón solamente. En condiciones normales, el electrón único entraría en el caparazón n = 1, que solo tiene una única subcapa s con un orbital (porque m l puede ser igual solo a 0). La convención es etiquetar la combinación shell-subshell con el número del shell y la letra que representa el subshell. Por lo tanto, el electrón va en la combinación 1s shell-subshell. Por lo general, no es necesario especificar los números cuánticos de m l o m s, pero para el átomo de H, el electrón tiene m l = 0 (el único valor posible) y un m s de +1/2 o −1/2.
El átomo de He tiene dos electrones. El segundo electrón también puede entrar en la combinación 1s shell-subshell, pero solo si su número cuántico de espín es diferente del número cuántico de espín del primer electrón. Así, los conjuntos de números cuánticos para los dos electrones son {1, 0, 0, +1/2} y {1, 0, 0, −1/2}. Observe que el conjunto general es diferente para los dos electrones, como lo requiere el principio de exclusión de Pauli.
El siguiente átomo es Li, con tres electrones. Sin embargo, ahora el principio de exclusión de Pauli implica que no podemos poner ese electrón en la shell subshell 1s porque no importa cómo lo intentemos, este tercer electrón tendría el mismo conjunto de cuatro números cuánticos que uno de los dos primeros electrones. Por lo que este tercer electrón debe ser asignado a una combinación diferente shell-subshell. Sin embargo, el shell n = 1 no tiene otro subshell; está restringido a tener solo l = 0, o un subshell s. Por lo tanto, este tercer electrón tiene que ser asignado a la cáscara n = 2, que tiene una subcapa s (l = 0) y una subcapa p (l = 1). Nuevamente, generalmente comenzamos con el número cuántico más bajo, por lo que este tercer electrón se asigna a la combinación 2s shell-subshell de números cuánticos.
El principio de exclusión de Pauli tiene el efecto neto de limitar el número de electrones a los que se les puede asignar una combinación de números cuánticos de shell y subshell. Por ejemplo, en cualquier subshell s, no importa cuál sea el número de shell, puede haber un máximo de solo dos electrones. Una vez que se llena la subcapa s, cualquier electrón adicional debe ir a otra subcapa en la cáscara (si existe), o a una cáscara numerada más alta. Un análisis similar muestra que una subcapa p puede contener un máximo de seis electrones. Una subcapa d puede contener un máximo de 10 electrones, mientras que una subcapa f puede tener un máximo de 14 electrones. Al limitar las subconchas a estos máximos, podemos distribuir los electrones disponibles a sus conchas y subcáscaras.
¿Cómo se asignarían los seis electrones para C a los números cuánticos n y l?
Solución
Los dos primeros electrones entran en la combinación 1s shell-subshell. Dos electrones adicionales pueden entrar en la shell subshell 2s, pero ahora esta subcapa se llena con el número máximo de electrones. El shell n = 2 también tiene una subcapa p, por lo que los dos electrones restantes pueden entrar en la subcapa 2p. El subshell 2p no está completamente lleno porque puede contener un máximo de seis electrones.
¿Cómo se asignarían los 11 electrones para Na a los números cuánticos n y l?
Contestar
dos electrones 1s, dos electrones 2s, seis electrones 2p y un electrón 3s
Ahora que vemos cómo se dividen los electrones entre las conchas y subconchas, necesitamos una forma más concisa de comunicar esta partición. Los químicos utilizan una configuración electrónica para representar la organización de electrones en conchas y subconchas en un átomo. Una configuración electrónica simplemente enumera las etiquetas de shell y subshell, con un superíndice derecho que da el número de electrones en esa subcapa. Las conchas y subconchas se enumeran en el orden de llenado.
Por ejemplo, un átomo de H tiene un solo electrón en la subcapa 1s. Su configuración electrónica es
H: 1s 1
El átomo de He tiene dos electrones en la subcapa 1s. Su configuración electrónica es
Él: 1s 2
Los tres electrones para Li están dispuestos en la subcapa 1s (dos electrones) y la subcapa 2s (un electrón). La configuración electrónica de Li es
Li: 1s 2 2s 1
El átomo Be tiene cuatro electrones, dos en la subcapa 1s y dos en la subcapa 2s. Su configuración electrónica es
Ser: 1s 2 2s 2
Ahora que la subcapa 2s está llena, los electrones en átomos más grandes deben entrar en la subcapa 2p, que puede contener un máximo de seis electrones. Los siguientes seis elementos llenan progresivamente el subshell 2p:
- B: 1s 2 2s 2 2p 1
- C: 1s 2 2s 2 2p 2
- N: 1s 2 2s 2 2p 3
- O: 1s 2 2s 2 2p 4
- F: 1s 2 2s 2 2p 5
- Ne: 1s 2 2s 2 2p 6
Ahora que la subcapa 2p está llena (todas las subcáscaras posibles en el caparazón n = 2), el siguiente electrón para el átomo siguiente más grande debe entrar en el caparazón n = 3, subshell s.
¿Cuál es la configuración electrónica para Na, que tiene 11 electrones?
Solución
Los dos primeros electrones ocupan la subcapa 1s. Los dos siguientes ocupan la subcapa 2s, mientras que los siguientes seis electrones ocupan la subcapa 2p. Esto nos da 10 electrones hasta el momento, con 1 electrón a la izquierda. Este último electrón entra en el caparazón n = 3, s subshell. Así, la configuración electrónica de Na es 1s 2 2s 2 2p 6 3s 1.
¿Cuál es la configuración electrónica para Mg, que tiene 12 electrones?
Contestar
1s 2 2s 2 2p 6 3s 2
Para átomos más grandes, la disposición de los electrones se vuelve más complicada. Esto se debe a que después de llenar el subshell 3p, llenar primero el subshell 4s en realidad conduce a una menor energía general que llenar el subshell 3d. Recordemos que si bien el número cuántico principal dicta en gran medida la energía de un electrón, el número cuántico de momento angular también tiene un impacto en la energía; para cuando llegamos a las subconchas 3d y 4s, vemos superposición en el relleno de las conchas. Así, después de que la subcapa 3p esté completamente llena (lo que ocurre para Ar), el siguiente electrón para K ocupa la subcapa 4s, no la subcapa 3d:
K: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1,
no
K: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1
Para átomos cada vez más grandes, el orden de llenado de las conchas y subcáscaras parece volverse aún más complicado. Hay algunas formas útiles de recordar el orden, como la que se muestra en la Figura\(\PageIndex{1}\). Si sigues las flechas en orden, éstas pasan a través de las subconchas en el orden en que están llenas de electrones en átomos más grandes. Inicialmente, el orden es el mismo que el orden esperado-subcaparazón, pero para átomos más grandes, hay algunos cambios alrededor de los números cuánticos principales. Sin embargo, la Figura\(\PageIndex{1}\) da un orden válido de relleno de subconchas con electrones para la mayoría de los átomos.
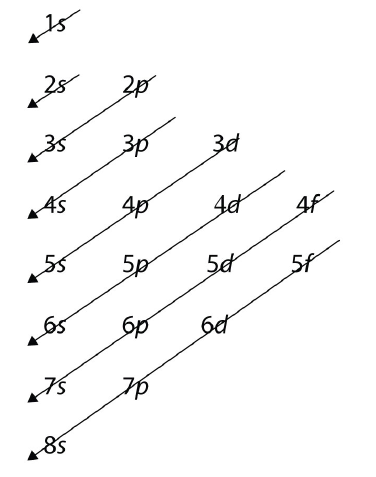
¿Cuál es la configuración electrónica predicha para Sn, que tiene 50 electrones?
Solución
Seguiremos la tabla de la Figura 8.4., hasta que podamos acomodar 50 electrones en las subconchas en el orden adecuado: Sn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2
Verificar sumando los superíndices, que indican el número de electrones: 2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 6 + 2 + 10 + 2 = 50, por lo que hemos colocado los 50 electrones en subconchas en el orden adecuado.
¿Cuál es la configuración electrónica para Ba, que tiene 56 electrones?
Contestar
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2
Como demostró el ejemplo anterior, las configuraciones de electrones pueden llegar a ser bastante largas. Una configuración electrónica abreviada utiliza uno de los elementos de la última columna de la tabla periódica, que contiene los gases nobles, para representar el núcleo de los electrones hasta ese elemento. Entonces, los electrones restantes se listan explícitamente. Por ejemplo, la configuración abreviada de electrones para Li, que tiene tres electrones, sería
Li: [Él] 2s 1
donde [Él] representa el núcleo de dos electrones que es equivalente a la configuración electrónica de He. Los corchetes representan la configuración electrónica de un gas noble. Esto no es mucho de una abreviatura. Sin embargo, considere la configuración abreviada de electrones para W, que tiene 74 electrones:
W: [Xe] 6s 2 4f 14 5d 4
Esta es una simplificación significativa sobre una lista explícita de los 74 electrones. Entonces, para elementos más grandes, la configuración electrónica abreviada puede ser una taquigrafía muy útil.
¿Cuál es la configuración abreviada de electrones para P, que tiene 15 electrones?
Solución
Con 15 electrones, la configuración electrónica de P es
P: 1s 2 2s 2 2p 6 3s 2 3p 3
El primer gas noble inmediato es Ne, que tiene una configuración electrónica de 1s 2 2s 2 2p 6. Usando la configuración electrónica de Ne para representar los primeros 10 electrones, la configuración electrónica abreviada de P es
P: [Ne] 3s 2 3p 3
¿Cuál es la configuración abreviada de electrones para Rb, que tiene 37 electrones?
Contestar
[Kr] 5S 1
Hay algunas excepciones al riguroso llenado de subconchas por electrones. En muchos casos, un electrón va de un caparazón numerado más alto a un subcaparazón de número inferior, pero llenado más tarde, para llenar la subcapa de relleno posterior. Un ejemplo es Ag. Con 47 electrones, se predice que su configuración electrónica sea
Ag: [Kr] 5s 2 4d 9
Sin embargo, los experimentos han demostrado que la configuración electrónica es en realidad
Ag: [Kr] 5s 1 4d 10
Esto, entonces, califica como una excepción a nuestras expectativas. En este punto, no es necesario memorizar las excepciones; pero si te encuentras con una, entiende que es una excepción a las reglas normales de llenar subshells con electrones, lo que puede suceder.
Resumen
El principio de exclusión de Pauli limita el número de electrones en las subconchas y conchas. Los electrones en átomos más grandes llenan conchas y subconchas en un patrón regular que se puede seguir. Las configuraciones de electrones son un método abreviado para indicar qué subconchas ocupan los electrones en los átomos. Las configuraciones de electrones abreviadas son una forma más simple de representar configuraciones de electrones para átomos más grandes. Se dan excepciones al estricto llenado de subconchas con electrones.


