8.3: Números cuánticos para electrones
- Page ID
- 74863
- Explique qué son los espectros.
- Aprende los números cuánticos que se asignan a los electrones.
Hay dos formas fundamentales de generar luz: o calentar un objeto hasta que esté tan caliente que brilla, o pasar una corriente eléctrica a través de una muestra de materia (generalmente un gas). Las luces incandescentes y fluorescentes generan luz a través de estos dos métodos, respectivamente.
Un objeto caliente emite un continuo de luz. Esto lo notamos cuando la porción visible del espectro electromagnético pasa a través de un prisma: el prisma separa la luz en sus colores constituyentes, y todos los colores están presentes en un arco iris continuo (Figura\(\PageIndex{1a}\) - Prismas y Luz). Esta imagen es conocida como espectro continuo. Sin embargo, cuando la electricidad pasa a través de un gas y se emite luz y esta luz pasa a través de un prisma, solo vemos ciertas líneas de luz en la imagen (Figura\(\PageIndex{1b}\)). Esta imagen se llama espectro de líneas. Resulta que cada elemento tiene su propio espectro de líneas único y característico.

¿Por qué la luz emitida por un gas excitado eléctricamente tiene solo ciertos colores, mientras que la luz emitida por objetos calientes tiene un espectro continuo? Durante mucho tiempo, no estuvo bien explicado. Particularmente simple fue el espectro del gas hidrógeno, que podría describirse fácilmente mediante una ecuación; ningún otro elemento tiene un espectro que sea tan predecible (Figura\(\PageIndex{2}\) - Espectro de Hidrógeno). Científicos de finales del siglo XIX encontraron que las posiciones de las líneas obedecían un patrón dado por la ecuación
\[\frac{1}{\lambda }=(109,700cm^{-1})\left ( \frac{1}{4} -\frac{1}{n^{2}}\right )\nonumber \]
donde n = 3, 4, 5, 6, etc. Sin embargo, no pudieron explicar por qué esto era así.

En 1913, el científico danés Niels Bohr sugirió una razón por la que el espectro de átomos de hidrógeno se veía de esta manera. Sugirió que el electrón en un átomo de hidrógeno no podía tener ninguna energía aleatoria, teniendo sólo ciertos valores fijos de energía que estaban indexados por el número n (el mismo n en la ecuación anterior y ahora llamado número cuántico). Las cantidades que tienen ciertos valores específicos son valores cuantificados. Bohr sugirió que la energía del electrón en hidrógeno se cuantificó porque se encontraba en una órbita específica. Debido a que las energías del electrón solo pueden tener ciertos valores, los cambios en las energías solo pueden tener ciertos valores (algo similar a una escalera, no solo los escalones de escalera se establecen a alturas específicas, sino que la altura entre escalones es fija). Finalmente, Bohr sugirió que la energía de la luz emitida por el gas hidrógeno electrificado era igual a la diferencia de energía de los estados de energía del electrón:
\[E_{light}=h\nu =\Delta E_{electron}\nonumber \]
Esto significa que solo se emiten ciertas frecuencias (y por lo tanto, ciertas longitudes de onda) de luz. Figura\(\PageIndex{3}\) - El modelo de Bohr del átomo de hidrógeno, muestra un modelo del átomo de hidrógeno basado en las ideas de Bohr.
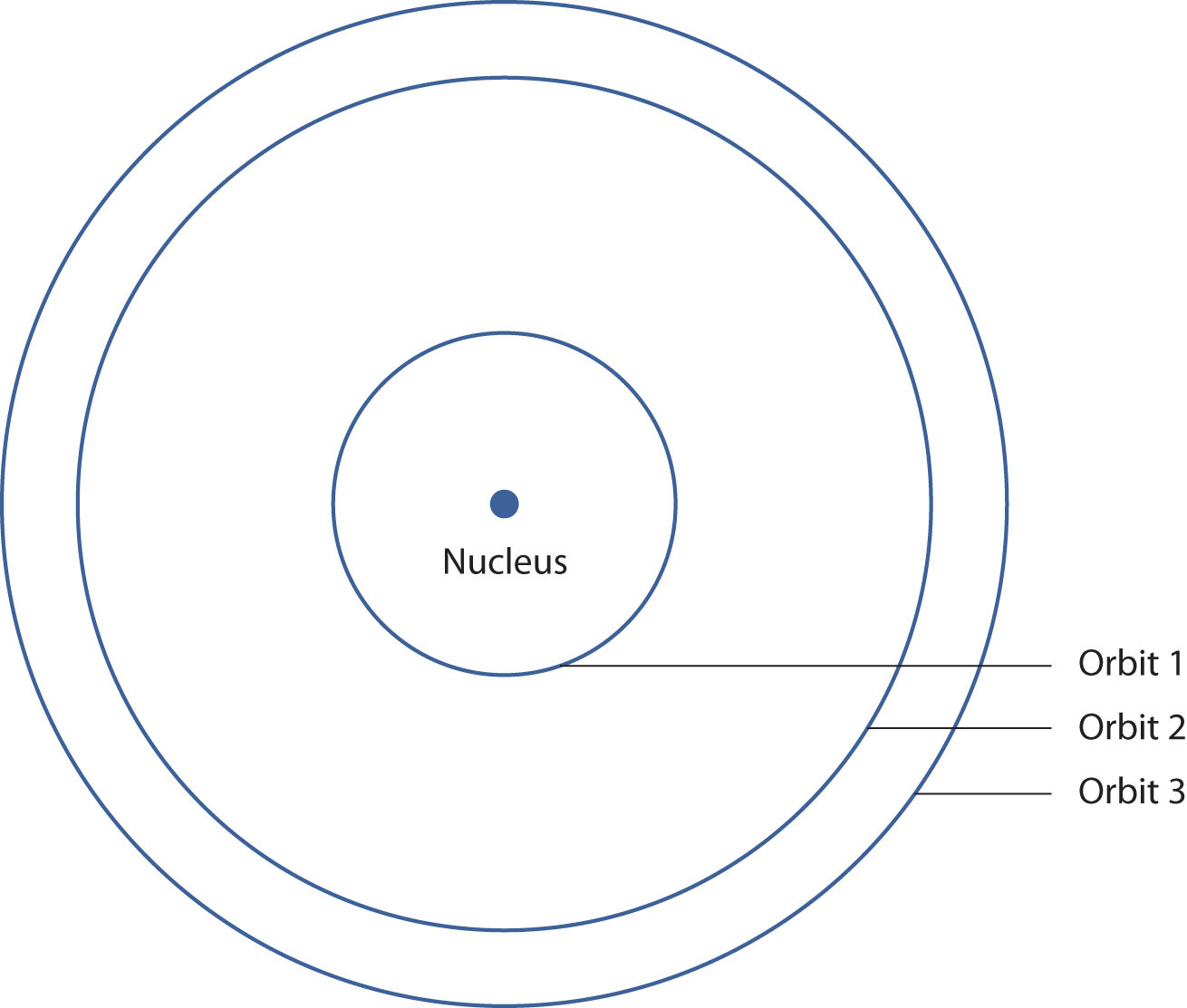
Las ideas de Bohr fueron útiles, pero solo se aplicaban al átomo de hidrógeno. Sin embargo, investigadores posteriores generalizaron las ideas de Bohr en una nueva teoría llamada mecánica cuántica, que explica el comportamiento de los electrones como si estuvieran actuando como una onda, no como partículas. La mecánica cuántica predice dos cosas principales: energías cuantificadas para electrones de todos los átomos (no solo hidrógeno) y una organización de electrones dentro de los átomos. Ya no se piensa que los electrones estén distribuidos aleatoriamente alrededor de un núcleo o restringidos a ciertas órbitas (en ese sentido, Bohr estaba equivocado). En cambio, los electrones se recogen en grupos y subgrupos que explican mucho sobre el comportamiento químico del átomo.
En el modelo cuántico-mecánico de un átomo, el estado de un electrón es descrito por cuatro números cuánticos, no solo el predicho por Bohr. El primer número cuántico se llama el número cuántico principal (n). El número cuántico principal determina en gran medida la energía de un electrón. Se dice que los electrones en el mismo átomo que tienen el mismo número cuántico principal ocupan una capa de electrones del átomo. El número cuántico principal puede ser cualquier entero positivo distinto de cero: 1, 2, 3, 4,...
Dentro de una concha, puede haber múltiples valores posibles del siguiente número cuántico, el número cuántico de momento angular (l). El número cuántico de l tiene un efecto menor sobre la energía del electrón, pero también afecta la distribución espacial del electrón en el espacio tridimensional, es decir, la forma de la distribución de un electrón en el espacio. El valor del número cuántico de l puede ser cualquier entero entre 0 y n − 1: l = 0, 1, 2,..., n − 1.
Así, para un valor dado de n, hay diferentes valores posibles de l:
| Si n es igual | l puede ser |
|---|---|
| 1 | 0 |
| 2 | 0 o 1 |
| 3 | 0, 1 o 2 |
| 4 | 0, 1, 2 o 3 |
y así sucesivamente. Se dice que los electrones dentro de una concha que tienen el mismo valor de l ocupan una subcapa en el átomo. Comúnmente, en lugar de referirse al valor numérico de l, una letra representa el valor de l (para ayudar a distinguirlo del número cuántico principal):
| Si l es igual | La letra es |
|---|---|
| 0 | s |
| 1 | p |
| 2 | d |
| 3 | f |
El siguiente número cuántico se llama el número cuántico magnético (m l). Para cualquier valor de l, hay 2l + 1 valores posibles de m l, que van de −l a l:
\[−ℓ \lt mℓ \lt ℓ\nonumber \]
o
A continuación se enumeran explícitamente los posibles valores de m l para los posibles valores de l:
| Si l es igual | Los valores de m l pueden ser |
|---|---|
| 0 | 0 |
| 1 | −1, 0 o 1 |
| 2 | −2, −1, 0, 1 o 2 |
| 3 | −3, −2, −1, 0, 1, 2 o 3 |
El valor particular de m l dicta la orientación de la distribución de un electrón en el espacio. Cuando l es cero, m l puede ser solo cero, por lo que solo hay una orientación posible. Cuando l es 1, hay tres orientaciones posibles para la distribución de un electrón. Cuando l es 2, hay cinco posibles orientaciones de distribución de electrones. Esto sigue y sigue para otros valores de l, pero no necesitamos considerar ningún valor más alto de l aquí. Cada valor de m l designa un cierto orbital. Así, sólo hay una órbita cuando l es cero, tres orbitales cuando l es 1, cinco orbitales cuando l es 2, y así sucesivamente. El número cuántico de m l no tiene ningún efecto sobre la energía de un electrón a menos que los electrones estén sujetos a un campo magnético, de ahí su nombre.
El número cuántico de l dicta la forma general de la distribución de electrones en el espacio (Figura\(\PageIndex{4}\) - Orbitales Electrónicos). Cualquier s orbital es esféricamente simétrico (Figura\(\PageIndex{4a}\) - Orbitales Electrónicos), y solo hay un orbital en cualquier subshell s. Cualquier orbital p tiene una forma de mancuerna de dos lóbulos (Figura\(\PageIndex{4b}\) - Orbitales Electrónicos); debido a que hay tres de ellos, normalmente los representamos apuntando a lo largo de los ejes x, y y z del espacio cartesiano. Los orbitales d son rosetas de cuatro lóbulos (Figura\(\PageIndex{4c}\) - Orbitales Electrónicos) y están orientados de manera diferente en el espacio (el etiquetadotiene dos lóbulos y un toro en lugar de cuatro lóbulos, pero es equivalente a los otros orbitales). Cuando hay más de un valor posible de m l, cada orbital se etiqueta con uno de los valores posibles. Cabe señalar que los diagramas de la Figura\(\PageIndex{4}\) son estimaciones de la distribución de electrones en el espacio, no las superficies en las que se fijan los electrones.
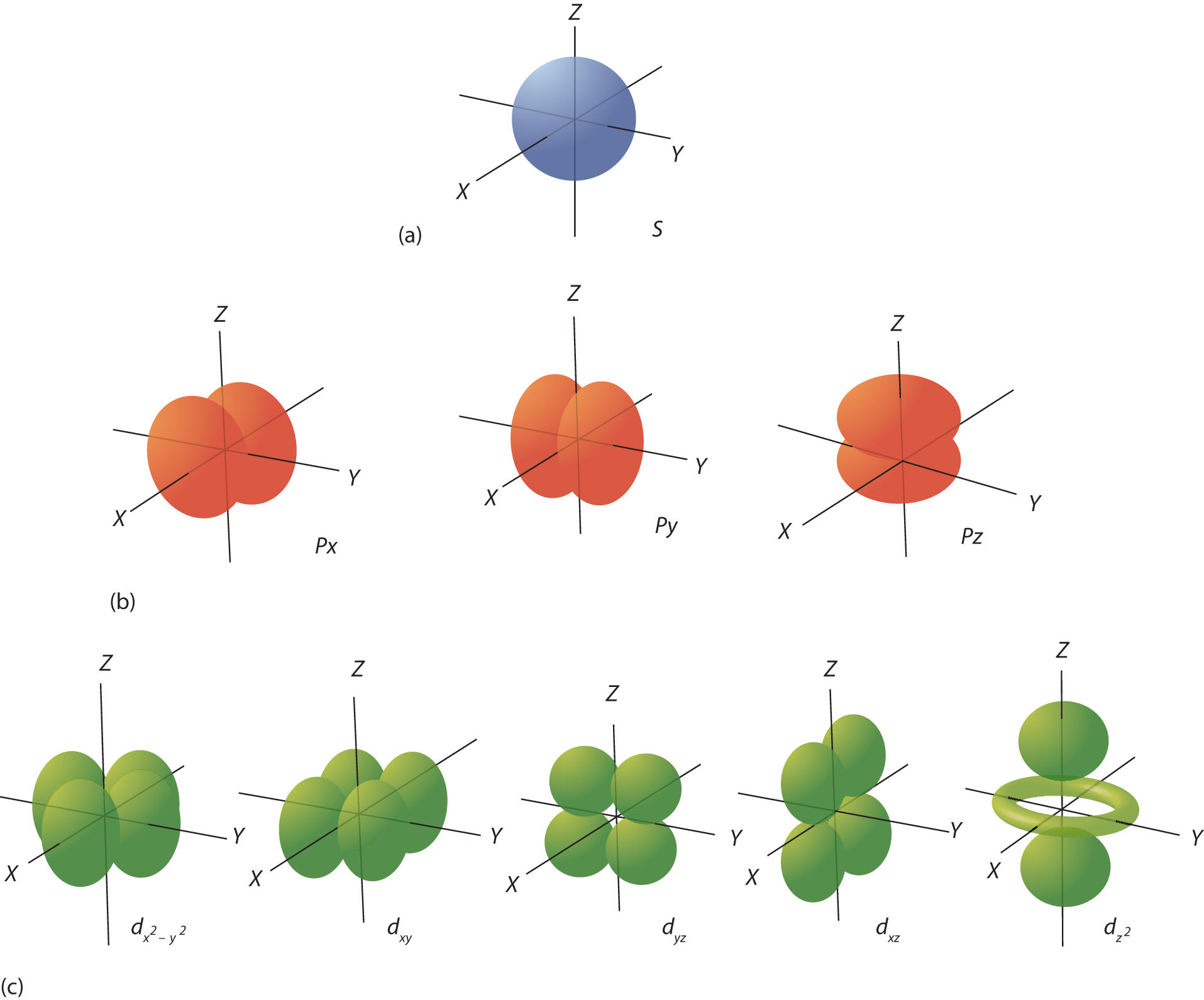
El número cuántico final es el número cuántico de espín (m s). Los electrones y otras partículas subatómicas se comportan como si estuvieran girando (no podemos decir si realmente lo son, pero se comportan como si lo fueran). Los electrones mismos tienen dos posibles estados de espín, y debido a las matemáticas, se les asignan los números cuánticos +1/2 y −1/2. Estas son las únicas dos opciones posibles para el número cuántico de espín de un electrón.
Del conjunto de números cuánticos {n, l, m l, m s}, ¿cuáles son posibles y cuáles no están permitidos?
- {3, 2, 1, +1/2}
- {2, 2, 0, −1/2}
- {3, −1, 0, +1/2}
Solución
- El número cuántico principal n debe ser un entero, ya que es aquí. El número cuántico l debe ser menor que n, que es. El número cuántico de m l debe estar entre −l y l, que es. El número cuántico de espín es +1/2, lo que está permitido. Debido a que este conjunto de números cuánticos sigue todas las restricciones, es posible.
- El número cuántico n es un entero, pero el número cuántico l debe ser menor que n, que no lo es. Por lo tanto, este no es un conjunto permitido de números cuánticos.
- El número cuántico principal n es un entero, pero no se permite que l sea negativo. Por lo tanto, este no es un conjunto permitido de números cuánticos.
Del conjunto de números cuánticos {n, l, m l, m s}, ¿cuáles son posibles y cuáles no están permitidos?
- {4, 2, −2, 1}
- {3, 1, 0, −1/2}
RESPUESTAS
- El giro debe ser +1/2 o −1/2, por lo que no se permite este conjunto de números cuánticos.
- permitido
Una luz de neón es básicamente un tubo electrificado con una pequeña cantidad de gas en él. La electricidad excita electrones en los átomos de gas, que luego emiten luz a medida que los electrones vuelven a un estado de menor energía. Sin embargo, ¡muchas de las llamadas luces de “neón” no contienen neón!
Aunque ahora sabemos que una descarga de gas desprende sólo ciertos colores de luz, sin prisma u otro componente para separar los colores de luz individuales, vemos un compuesto de todos los colores emitidos. No es inusual que predomine cierto color. Las verdaderas luces de neón, con gas neón en ellas, tienen una luz anaranjada rojiza debido a la gran cantidad de luz de color rojo, naranja y amarillo emitida. Sin embargo, si se usa kriptón en lugar de neón, se emite una luz blanquecina, mientras que el uso de argón produce una luz azul-púrpura. Una luz llena de gas nitrógeno brilla de color púrpura, al igual que una lámpara de helio. Otros gases y mezclas de gases emiten otros colores de luz. Irónicamente, a pesar de su importancia en el desarrollo de la teoría electrónica moderna, las lámparas de hidrógeno emiten poca luz visible y rara vez se utilizan con fines de iluminación.

Luces de neón. Los diferentes colores de estas luces de “neón” son causados por gases distintos al neón en los tubos de descarga. Humano/Necesidad/Deseo. Escultura de neón de Bruce Nauman (1983), quien ha sido caracterizado como un artista conceptual. (CC BY-SA 3.0; eschipul).
Claves para llevar
Los electrones en los átomos tienen energías cuantificadas. El estado de los electrones en los átomos es descrito por cuatro números cuánticos.


