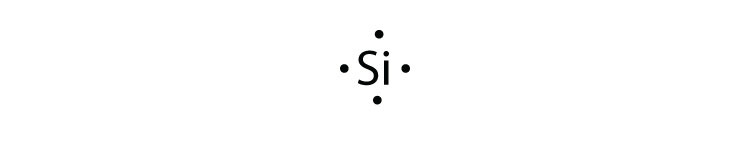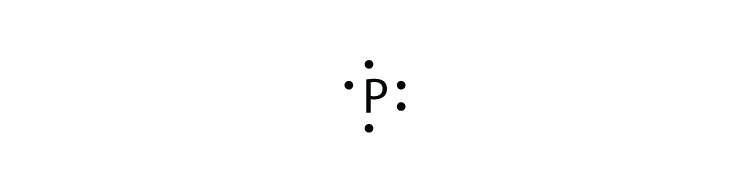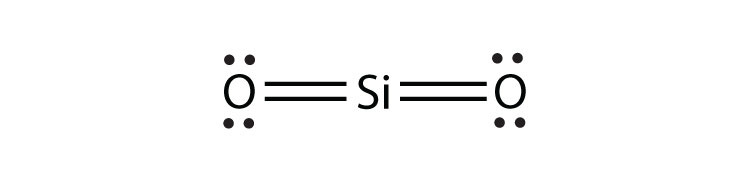9.E: Enlaces Químicos (Ejercicios)
- Page ID
- 74899
9.2: Diagramas de punto electrónico de Lewis
- Explica por qué los dos primeros puntos en un diagrama de puntos electrónicos de Lewis se dibujan en el mismo lado del símbolo atómico.
- ¿Es necesario que el primer punto alrededor de un símbolo atómico vaya a un lado particular del símbolo atómico?
- ¿Qué columna de la tabla periódica tiene diagramas de puntos electrónicos de Lewis con dos electrones?
- ¿Qué columna de la tabla periódica tiene diagramas de puntos electrónicos de Lewis que tienen seis electrones en ellos?
- Dibuja el diagrama de puntos electrónicos de Lewis para cada elemento.
- estroncio
- silicio
- Dibuja el diagrama de puntos electrónicos de Lewis para cada elemento.
- Krypton
- azufre
- Dibuja el diagrama de puntos electrónicos de Lewis para cada elemento.
- titanio
- fósforo
- Dibuja el diagrama de puntos electrónicos de Lewis para cada elemento.
- bromo
- galio
- Dibuja el diagrama de puntos electrónicos de Lewis para cada ion.
- Mg 2+
- S 2−
- Dibuja el diagrama de puntos electrónicos de Lewis para cada ion.
- En +
- Br −
- Dibuja el diagrama de puntos electrónicos de Lewis para cada ion.
- Fe 2+
- N 3−
- Dibuja el diagrama de puntos electrónicos de Lewis para cada ion.
- H +
- H −
RESPUESTAS
- Los dos primeros electrones en una capa de valencia son electrones s, que están emparejados.
- la segunda columna de la tabla periódica
-
-
-
- Mg 2+
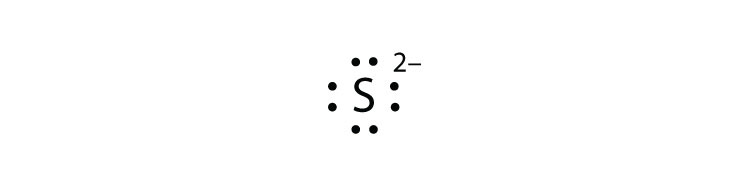
-
- Fe 2+

9.3: Transferencia de Electrones - Enlaces Iónicos
- Comentar sobre la posible formación del ion K 2+. ¿Por qué es poco probable su formación?
-
Comentar sobre la posible formación del ion Cl 2−. ¿Por qué es poco probable su formación?
-
¿Cuántos electrones tiene que perder un átomo de Ba para tener un octeto completo en su caparazón de valencia?
-
¿Cuántos electrones tiene que perder un átomo de Pb para tener un octeto completo en su caparazón de valencia?
-
¿Cuántos electrones tiene que ganar un átomo de Se para tener un octeto completo en su caparazón de valencia?
-
¿Cuántos electrones tiene que ganar un átomo de N para tener un octeto completo en su caparazón de valencia?
-
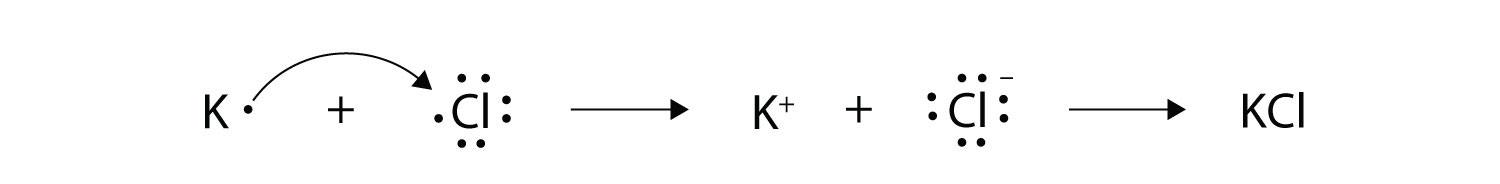
Con flechas, ilustran la transferencia de electrones para formar cloruro de potasio a partir de átomos de K y átomos de Cl.
-
Con flechas, ilustran la transferencia de electrones para formar sulfuro de magnesio a partir de átomos de Mg y átomos de S.
-
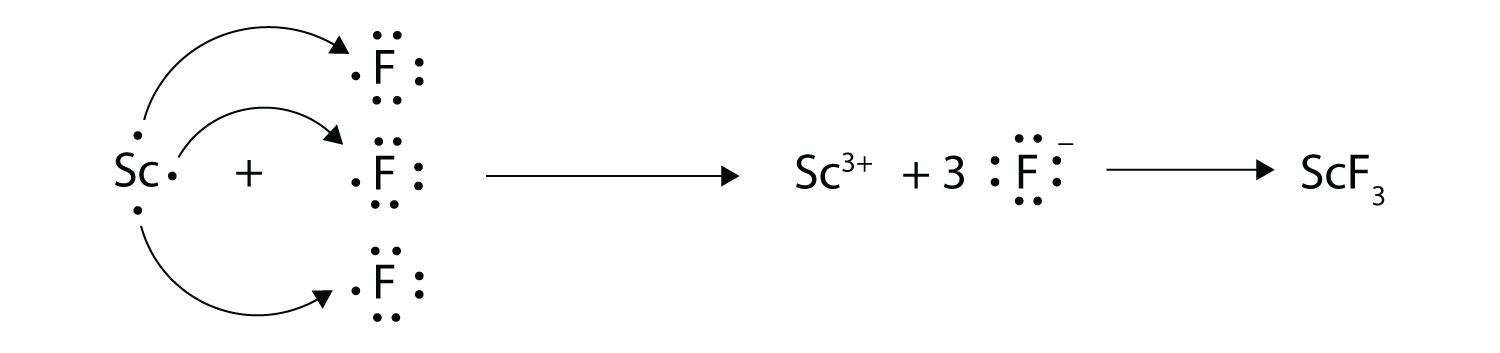
Con flechas, ilustran la transferencia de electrones para formar fluoruro de escandio a partir de átomos de Sc y átomos de F.
-
Con flechas, ilustran la transferencia de electrones para formar fosfuro de rubidio a partir de átomos de Rb y átomos de P.
-
¿Qué compuesto iónico tiene la energía de celosía más alta: Ki o MgO? ¿Por qué?
-
¿Qué compuesto iónico tiene la energía de celosía más alta, Ki o LiF? ¿Por qué?
- ¿Qué compuesto iónico tiene la energía de celosía más alta: Bas o MgO? ¿Por qué?
RESPUESTAS
- Es poco probable que se forme el ion K 2+ porque el ion K + ya satisface la regla del octeto y es bastante estable.
- dos
- dos
- MgO porque los iones tienen una carga de mayor magnitud
- MgO porque los iones son más pequeños
9.4: Enlaces covalentes
- ¿Cuántos electrones habrá en la capa de valencia de los átomos de H cuando haga un enlace covalente?
- ¿Cuántos electrones estarán en la capa de valencia de los átomos no H cuando hagan enlaces covalentes?
- ¿Cuál es el diagrama de puntos electrónicos Lewis de I 2? Circula los electrones alrededor de cada átomo para verificar que cada capa de valencia está llena.
- ¿Cuál es el diagrama de puntos electrónicos de Lewis de H 2 S? Circula los electrones alrededor de cada átomo para verificar que cada capa de valencia está llena.
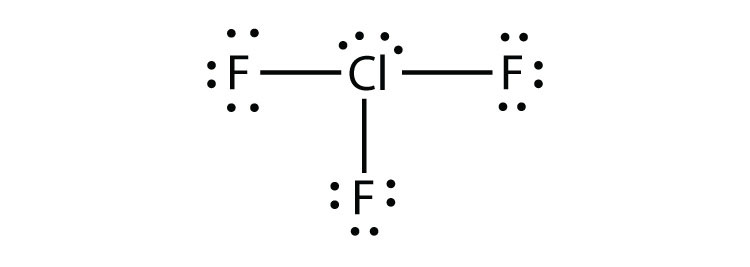
- ¿Cuál es el diagrama de puntos electrónicos de Lewis de NCl 3? Circula los electrones alrededor de cada átomo para verificar que cada capa de valencia está llena.
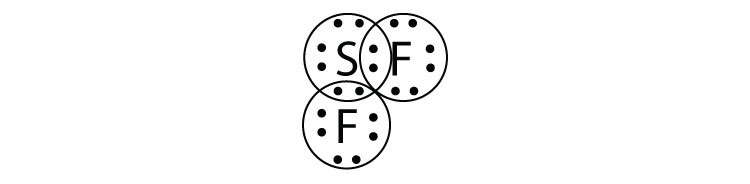
- ¿Cuál es el diagrama de puntos electrónicos de Lewis de SiF 4? Circula los electrones alrededor de cada átomo para verificar que cada capa de valencia está llena.
- Dibuja el diagrama de puntos electrónicos de Lewis para cada sustancia.
- SF 2
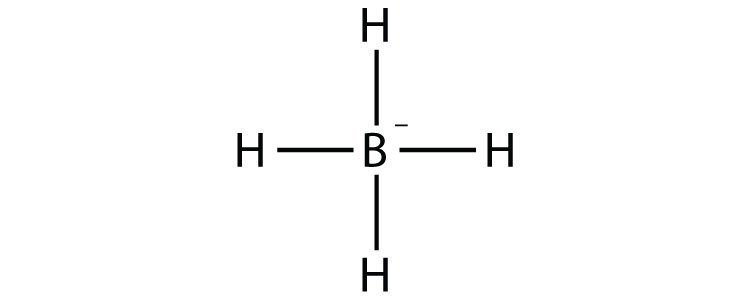
- BH 4 −
- Dibuja el diagrama de puntos electrónicos de Lewis para cada sustancia.
- PI 3
- OH −
- Dibuja el diagrama de puntos electrónicos de Lewis para cada sustancia.
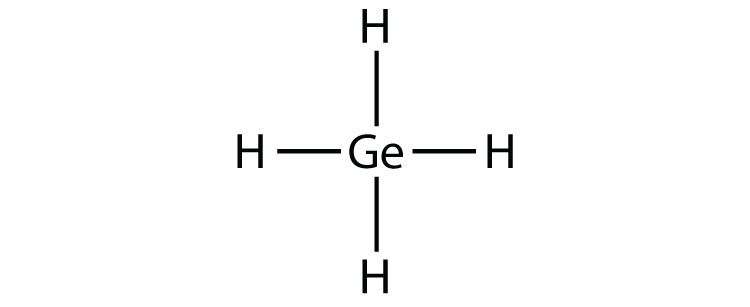
- GeH 4
- CLF
- Dibuja el diagrama de puntos electrónicos de Lewis para cada sustancia.
- ASf 3
- NH 4 +
- Dibuja el diagrama de puntos electrónicos de Lewis para cada sustancia. Es posible que se necesiten dobles o triples enlaces.
- SiO 2
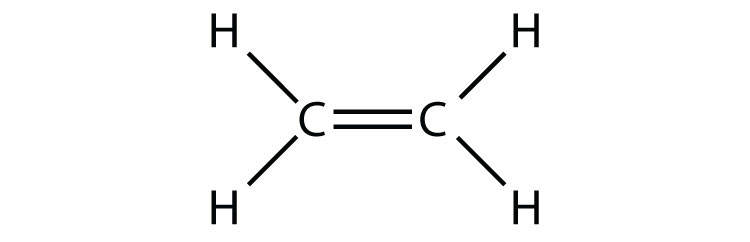
- C 2 H 4 (asumir dos átomos centrales)
- Dibuja el diagrama de puntos electrónicos de Lewis para cada sustancia. Es posible que se necesiten dobles o triples enlaces.
- CN −
- C 2 Cl 2 (asumir dos átomos centrales)
- Dibuja el diagrama de puntos electrónicos de Lewis para cada sustancia. Es posible que se necesiten dobles o triples enlaces.
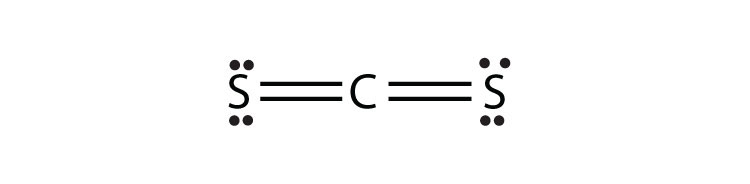
- CS 2
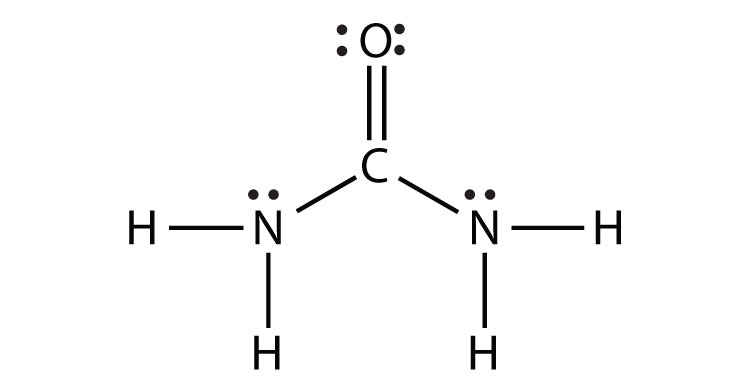
- NH 2 CONH 2 (supongamos que los átomos de N y C son los átomos centrales)
- Dibuja el diagrama de puntos electrónicos de Lewis para cada sustancia. Es posible que se necesiten dobles o triples enlaces.
- POCl
- HCOOH (supongamos que el átomo de C y un átomo de O son los átomos centrales)
RESPUESTAS
- dos
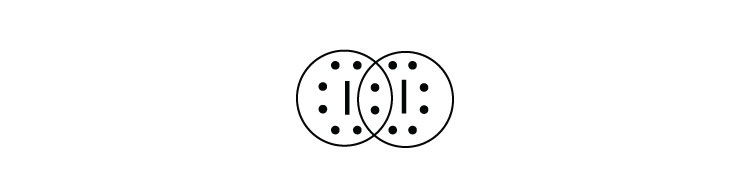
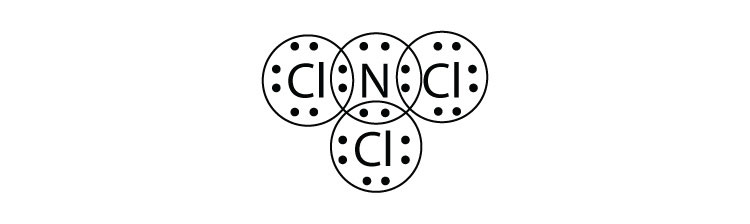
-
-
-
-
9.5: Otros aspectos de los enlaces covalentes
- Dé un ejemplo de un enlace covalente no polar. ¿Cómo sabes que es no polar?
- Dé un ejemplo de un enlace covalente polar. ¿Cómo sabes que es polar?
- ¿Cómo sabes qué lado de un enlace polar tiene la carga negativa parcial? Identificar el lado cargado negativamente de cada enlace polar.
- H—Cl
- H—S
- ¿Cómo sabes qué lado de un enlace polar tiene la carga positiva parcial? Identificar el lado cargado positivamente de cada enlace polar.
- H—Cl
- N-F
- Marcar el enlace entre los átomos dados como covalente no polar, covalente ligeramente polar, definitivamente covalente polar o probablemente iónico.
- H y C
- C y F
- K y F
- Marcar el enlace entre los átomos dados como covalente no polar, covalente ligeramente polar, definitivamente covalente polar o probablemente iónico.
- S y Cl
- P y O
- Cs y O
- ¿Qué enlace covalente es más fuerte, un enlace C-C o un enlace C-H?
- ¿Qué enlace covalente es más fuerte, un doble enlace O-O o un doble enlace N-N?
- Estimar el cambio de entalpía para esta reacción: N 2 + 3H 2 → 2NH 3 .Comience dibujando los diagramas de puntos electrónicos de Lewis para cada sustancia.
- Estimar el cambio de entalpía para esta reacción. Comienza dibujando los diagramas de puntos electrónicos de Lewis para cada sustancia: HN=NH + 2H 2 → 2NH 3
- Estimar el cambio de entalpía para esta reacción. Comienza dibujando los diagramas de puntos electrónicos de Lewis para cada sustancia: CH 4 + 2O 2 → CO 2 + 2H 2 O
- Estimar el cambio de entalpía para esta reacción. Comience dibujando los diagramas de puntos electrónicos de Lewis para cada sustancia: 4NH 3 + 3O 2 → 2N 2 + 6H 2 O
RESPUESTAS
- H—H; es no polar porque los dos átomos tienen las mismas electronegatividades (las respuestas variarán).
-
- Lado Cl
- Lado S
-
- covalente ligeramente polar
- definitivamente covalente polar
- probable iónica
- Enlace C—H
- −80 kJ
- −798 kJ
9.6: Violaciones a la Regla del Octeto
- ¿Por qué una molécula de electrones impares no puede satisfacer la regla del octeto?
- ¿Por qué un átomo de la segunda fila de la tabla periódica no puede formar moléculas de concha de valencia expandida?
- Dibuje un diagrama de puntos electrónicos de Lewis aceptable para estas moléculas que violen la regla del octeto.
- NO 2
- XeF 4
- Dibuje un diagrama de puntos electrónicos de Lewis aceptable para estas moléculas que violen la regla del octeto.
- BCl 3
- ClO 2
- Dibuje un diagrama de puntos electrónicos de Lewis aceptable para estas moléculas que violen la regla del octeto.
- POF 3
- CLF 3
- Dibuje un diagrama de puntos electrónicos de Lewis aceptable para estas moléculas que violen la regla del octeto.
- SF 4
- BeH 2
RESPUESTAS
- No hay manera de que todos los electrones puedan ser emparejados si hay un número impar de ellos.
-
-
9.7: Formas Moleculares
- ¿Cuál es la premisa básica detrás de VSEPR?
- ¿Cuál es la diferencia entre la geometría del grupo de electrones y la geometría molecular?
- Identificar la geometría del grupo electrónico y la geometría molecular de cada molécula.
- H 2 S
- POCl 3
- Identificar la geometría del grupo electrónico y la geometría molecular de cada molécula.
- CS 2
- H 2 S
- Identificar la geometría del grupo electrónico y la geometría molecular de cada molécula.
- HCN
- CCl 4
- Identificar la geometría del grupo electrónico y la geometría molecular de cada molécula.
- BI 3
- PH 3
- ¿Cuál es la geometría de cada especie?
- CN −
- PO 4 3−
- ¿Cuál es la geometría de cada especie?
- PO 3 3−
- NO 3 −
- ¿Cuál es la geometría de cada especie?
- COF 2
- C 2 Cl 2 (ambos átomos de C son átomos centrales y están unidos entre sí)
- ¿Cuál es la geometría de cada especie?
- CO 3 2−
- N 2 H 4 (ambos átomos de N son átomos centrales y están unidos entre sí)
RESPUESTAS
- Los pares de electrones se repelen entre sí.
-
- Geometría del grupo electrónico: tetraédrica; geometría molecular: doblada
- Geometría del grupo electrónico: tetraédrica; geometría molecular: tetraédrica
-
- geometría del grupo de electrones: lineal; geometría molecular: lineal
- Geometría del grupo electrónico: tetraédrica; geometría molecular: tetraédrica
-
- lineal
- tetraédrico
-
- plano trigonal
- lineal y lineal alrededor de cada átomo central
9.8 Ejercicios adicionales
- Explique por qué el hierro y el cobre tienen el mismo diagrama de puntos de electrones de Lewis cuando tienen diferentes números de electrones.
-
Nombra dos iones con el mismo diagrama de puntos de electrones de Lewis que el ion Cl −.
-
Con base en las tendencias conocidas, ¿qué compuesto iónico de la primera columna de la tabla periódica y la última columna de la tabla periódica debería tener la mayor energía de celosía?
-
Con base en las tendencias conocidas, ¿qué compuesto iónico de la primera columna de la tabla periódica y la última columna de la tabla periódica debería tener la energía de celosía más baja?
-
P 2 no es una forma estable de fósforo, pero si lo fuera, ¿cuál sería su probable diagrama de puntos de electrones de Lewis?
-
Se 2 no es una forma estable de selenio, pero si lo fuera, ¿cuál sería su probable diagrama de puntos de electrones de Lewis?
-
¿Cuáles son los diagramas de puntos electrónicos de Lewis de SO 2, SO 3 y SO 4 2−?
-
¿Cuáles son los diagramas de puntos electrónicos de Lewis de PO 3 3− y PO 4 3−?
-
¿Qué bono esperas que sea más polar, un bono O-H o un bono N-H?
-
¿Qué bono esperas que sea más polar, un bono O-F o un bono S—O?
-
Utilice energías de enlace para estimar el cambio de energía de esta reacción.
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O -
Utilice energías de enlace para estimar el cambio de energía de esta reacción.
N 2 H 4 + O 2 → N 2 + 2H 2 O -
El etileno (C 2 H 4) tiene dos átomos centrales. Determinar la geometría alrededor de cada átomo central y la forma de la molécula general.
-
El peróxido de hidrógeno (H 2 O 2) tiene dos átomos centrales. Determinar la geometría alrededor de cada átomo central y la forma de la molécula general.
RESPUESTAS
- El hierro tiene d electrones que normalmente no se muestran en los diagramas de puntos electrónicos de Lewis.
-
-
LiF
-
-
Sería como N 2:
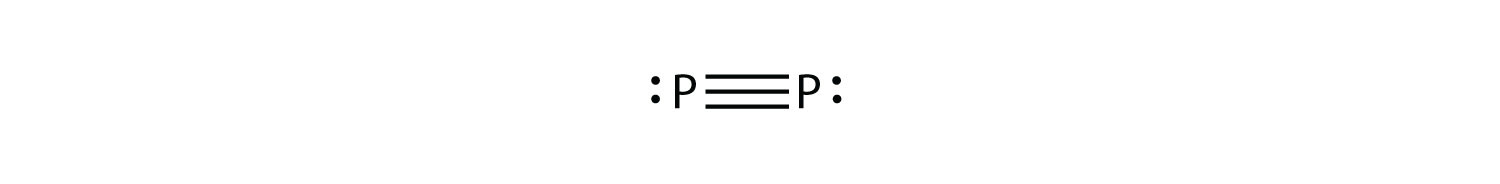
-
-
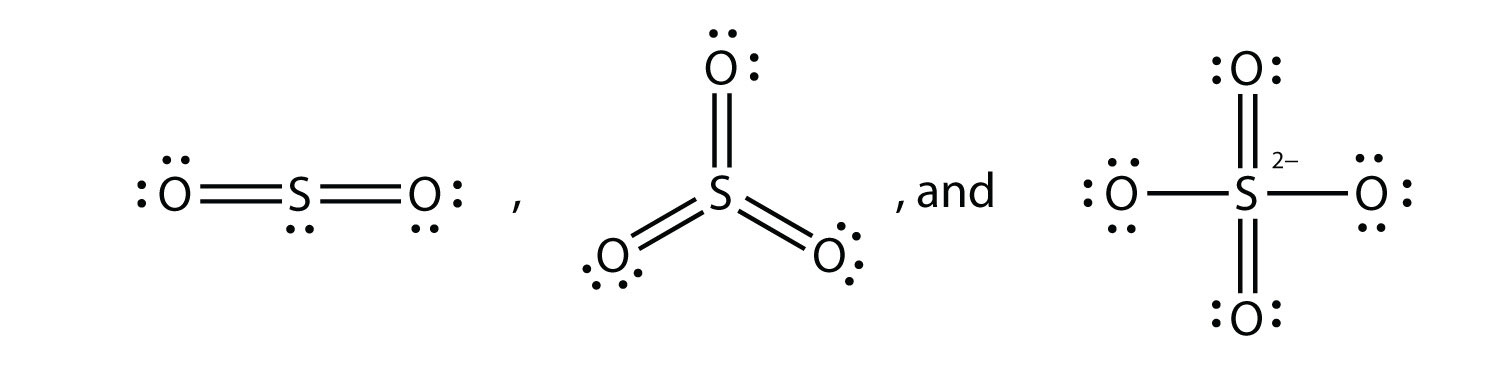
-
-
un enlace O—H
-
-
−2,000 kJ
-
-
plano trigonal alrededor de ambos átomos de C centrales