12.3: Ácidos y bases de Brønsted-Lowry
- Page ID
- 74783
- Identificar un ácido de Brønsted-Lowry y una base de Brønsted-Lowry.
- Identificar pares ácido-base conjugados en una reacción ácido-base.
La definición de Arrhenius de ácido y base se limita a soluciones acuosas (es decir, agua). Aunque esto es útil porque el agua es un disolvente común, se limita a la relación entre el ion H + y el ion OH −. Lo que sería útil es una definición general más aplicable a otras reacciones químicas y, lo que es más importante, independiente de H 2 O.
En 1923, el químico danés Johannes Brønsted y el químico inglés Thomas Lowry propusieron de forma independiente nuevas definiciones para ácidos y bases, unas que se centran en la transferencia de protones. Un ácido de Brønsted-Lowry es cualquier especie que puede donar un protón (H +) a otra molécula. Una base de Brønsted-Lowry es cualquier especie que puede aceptar un protón de otra molécula. En resumen, un ácido de Brønsted-Lowry es un donante de protones (PD), mientras que una base de Brønsted-Lowry es un aceptor de protones (PA).
Es fácil ver que la definición de Brønsted-Lowry abarca la definición Arrhenius de ácidos y bases. Considere la reacción ácido-base prototípica de Arrhenius:
\[\underset{acid}{H^{+}(aq)}+\underset{base}{OH^{-}(aq)}\rightarrow H_{2}O\, (l)\nonumber \]
Se marcan las especies ácidas y las especies base. El protón, sin embargo, es (por definición) un donante de protones (DP marcado), mientras que el ion OH − actúa como el aceptor de protones (marcado PA):
\[\underset{PD}{H^{+}(aq)}+\underset{PA}{OH^{-}(aq)}\rightarrow H_{2}O\, (l)\nonumber \]
El donante de protones es un ácido de Brønsted-Lowry, y el aceptor de protones es la base de Brønsted-Lowry:
\[\underset{BL\, acid}{H^{+}(aq)}+\underset{BL\, base}{OH^{-}(aq)}\rightarrow H_{2}O\, (l)\nonumber \]
Así, H + es un ácido por ambas definiciones, y OH − es una base por ambas definiciones.
El amoníaco (NH 3) es una base aunque no contenga iones OH − en su fórmula. En cambio, genera iones OH − como producto de una reacción de transferencia de protones con moléculas H 2 O; NH 3 actúa como una base de Brønsted-Lowry, y H 2 O actúa como un ácido de Brønsted-Lowry:
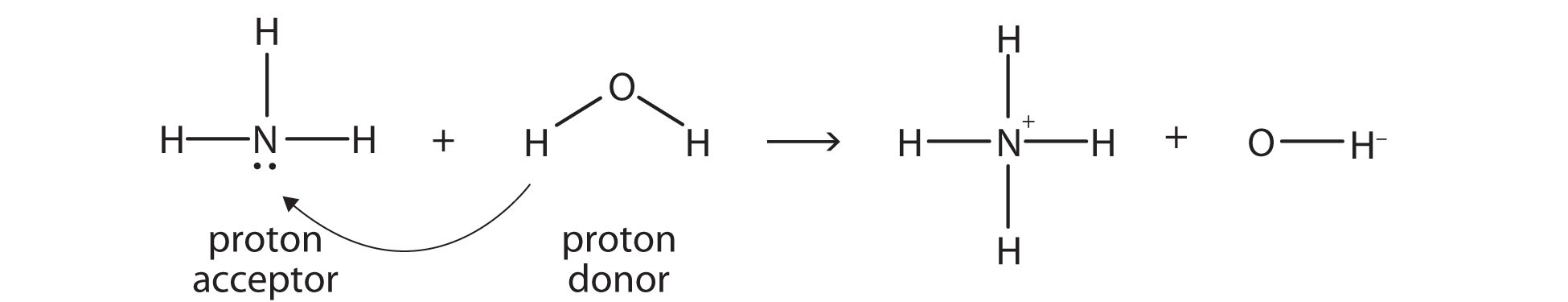
Una reacción con agua se llama hidrólisis; decimos que NH 3 se hidroliza para hacer iones NH 4 + y OH − iones.
Incluso la disolución de un ácido de Arrhenius en agua puede considerarse una reacción ácido-base de Brønsted-Lowry. Considera el proceso de disolver HCl (g) en agua para hacer una solución acuosa de ácido clorhídrico. El proceso se puede escribir de la siguiente manera:
\[\ce{HCl(g) + H2O(ℓ) → H3O+(aq) + Cl^{-}(aq)} \nonumber \nonumber \]
HCl (g) es el donante de protones y por lo tanto un ácido de Brønsted-Lowry, mientras que H 2 O es el aceptor de protones y una base de Brønsted-Lowry. Estos dos ejemplos muestran que H 2 O puede actuar tanto como donante de protones como aceptor de protones, dependiendo de qué otra sustancia se encuentre en la reacción química. Una sustancia que puede actuar como donante de protones o aceptor de protones se llama anfiprótica. El agua es probablemente la sustancia anfiprótica más común que encontraremos, pero otras sustancias también son anfipróticas.
Identificar el ácido de Brønsted-Lowry y la base de Brønsted-Lowry en esta ecuación química.
\[\ce{C6H5OH + NH2^{-} -> C6H5O^{-} + NH3} \nonumber \nonumber \]
Solución
La molécula C 6 H 5 OH está perdiendo un H +; es el donante de protones y el ácido de Brønsted-Lowry. El ion NH 2 − (llamado ion amida) está aceptando que el ion H + se convierta en NH 3, por lo que es la base Brønsted-Lowry.
Identificar el ácido de Brønsted-Lowry y la base de Brønsted-Lowry en esta ecuación química.
\[\ce{Al(H2O)6^{3+} + H2O -> Al(H2O)5(OH)^{2+} + H3O^{+}} \nonumber \nonumber \]
- Contestar
-
Ácido Brønsted-Lowry: Al (H 2 O) 6 3+; base Brønsted-Lowry: H 2 O
En la reacción entre NH 3 y H 2 O,
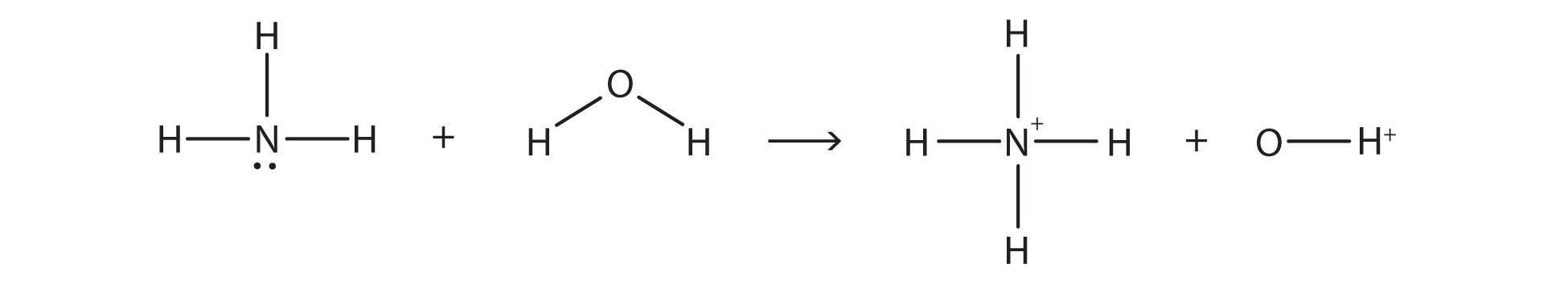
la reacción química no llega a su finalización; más bien, también ocurre el proceso inverso, y eventualmente los dos procesos cancelan cualquier cambio adicional. En este punto, decimos que la reacción química está en equilibrio. Ambos procesos aún ocurren, pero cualquier cambio neto por un proceso es contrarrestado por el mismo cambio neto del otro proceso; es un equilibrio dinámico, más que estático. Debido a que ambas reacciones están ocurriendo, tiene sentido usar una flecha doble en lugar de una sola flecha:
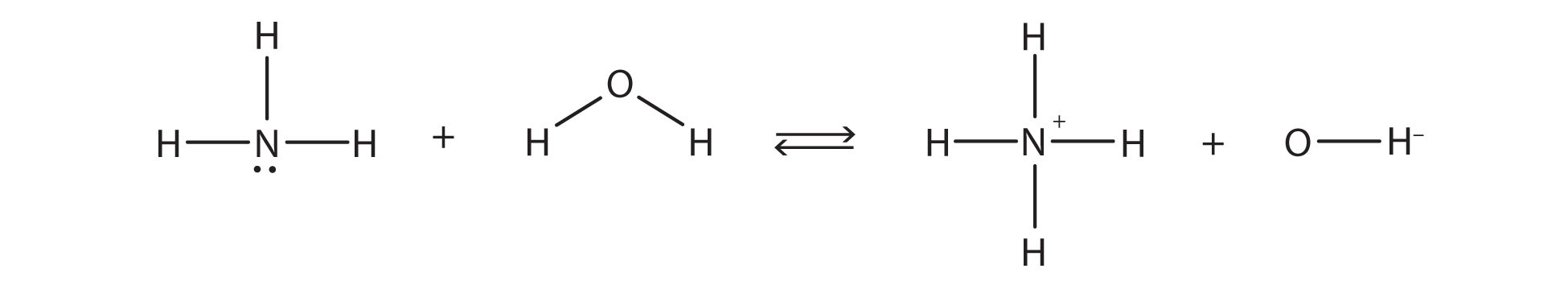
¿Qué notas sobre la reacción inversa? El ion NH 4 + está donando un protón al ion OH −, que lo está aceptando. Esto significa que el ion NH 4 + está actuando como donante de protones, o ácido de Brønsted-Lowry, mientras que el ion OH −, el aceptor de protones, actúa como una base de Brønsted-Lowry. La reacción inversa es también una reacción de base ácida de Brønsted-Lowry:
Bases BL. NH4+ y H2O son los ácidos BL. lt-chem-64081" style="width: 750px; height: 173px;” width="750px” height="173px” src=”/@api /deki/files/92035/3765cabac9591a0fb3dd5878f56075e2.jpg "data-quail-id="174">
Esto significa que ambas reacciones son reacciones ácido-base según la definición de Brønsted-Lowry. Si se considera la especie en esta reacción química, existen dos conjuntos de especies similares en ambos lados. Dentro de cada conjunto, las dos especies difieren por un protón en sus fórmulas, y un miembro del conjunto es un ácido de Brønsted-Lowry, mientras que el otro miembro es una base de Brønsted-Lowry. Estos conjuntos están marcados aquí:
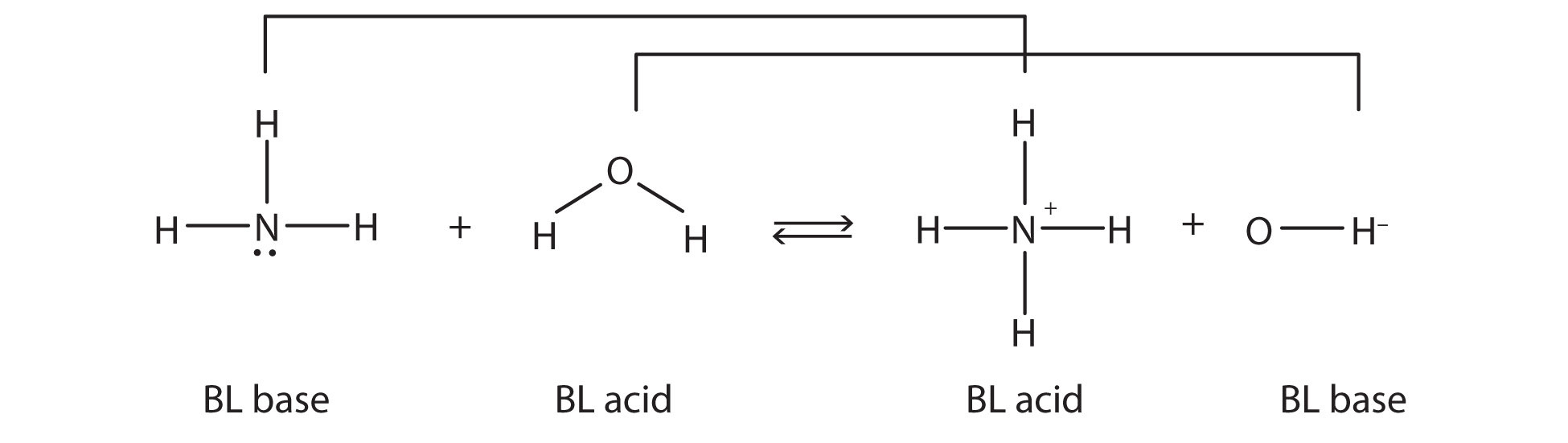
Los dos conjuntos, NH 3/NH 4 + y H 2 O/OH −, se denominan pares ácido-base conjugados. Decimos que NH 4 + es el ácido conjugado de NH 3, OH − es la base conjugada de H 2 O, y así sucesivamente. Cada reacción ácido-base de Brønsted-Lowry se puede marcar con dos pares ácido-base conjugados.
Identificar los pares ácido-base conjugados en este equilibrio.
\[(CH_{3})_{3}N+H_{2}O\rightleftharpoons (CH_{3})_{3}NH^{+}+OH^{-} \nonumber \nonumber \]
Solución
Un par es H 2 O y OH −, donde H 2 O tiene uno más H + y es el ácido conjugado, mientras que OH − tiene uno menos H + y es la base conjugada. El otro par consta de (CH 3) 3 N y (CH 3) 3 NH +, donde (CH 3) 3 NH + es el ácido conjugado (tiene un protón adicional) y (CH 3) 3 N es la base conjugada.
Identificar los pares ácido-base conjugados en este equilibrio.
\[NH_{2}^{-}+H_{2}O\rightleftharpoons NH_{3}+OH^{-} \nonumber \nonumber \]
- Contestar
-
H 2 O (ácido) y OH − (base); NH 2 − (base) y NH 3 (ácido)
Muchos productos para el hogar son ácidos o bases. Por ejemplo, el dueño de una piscina puede usar ácido muriático para limpiar la piscina. El ácido muriático es otro nombre para HCl (aq). En la Sección 4.6, se mencionó el vinagre como una solución diluida de ácido acético [HC 2 H 3 O 2 (aq)]. En un botiquín, se puede encontrar un frasco de tabletas de vitamina C; el nombre químico de la vitamina C es ácido ascórbico (HC 6 H 7 O 6).
Una de las bases domésticas más familiares es NH 3, que se encuentra en numerosos productos de limpieza. NH 3 es una base porque aumenta la concentración de iones OH − al reaccionar con H 2 O:
NH 3 (aq) + H 2 O (l) → NH 4 + (aq) + OH − (aq)Muchos jabones también son ligeramente básicos porque contienen compuestos que actúan como bases de Brønsted-Lowry, aceptando protones de H 2 O y formando exceso de iones OH −. Esta es una explicación de por qué las soluciones de jabón son resbaladizas.
Quizás el químico doméstico más peligroso es el limpiador de drenajes a base de lejía. Lye es un nombre común para NaOH, aunque también se usa como sinónimo de KOH. La lejía es una sustancia química extremadamente cáustica que puede reaccionar con la grasa, el cabello, las partículas de alimentos y otras sustancias que pueden acumularse y obstruir una tubería de agua. Desafortunadamente, la lejía también puede atacar los tejidos corporales y otras sustancias en nuestro cuerpo. Por lo tanto, cuando utilizamos limpiadores de drenaje a base de lejía, debemos tener mucho cuidado de no tocar ninguno de los limpiadores de drenaje sólidos o derramar el agua en la que se vertió. Los limpiadores de drenaje más seguros y sin lejía (como el de la figura adjunta) usan compuestos de peróxido para reaccionar sobre los materiales en la obstrucción y limpiar el desagüe.

Claves para llevar
- Un ácido de Brønsted-Lowry es un donante de protones; una base de Brønsted-Lowry es un aceptor de protones.
- Las reacciones ácido-base incluyen dos conjuntos de pares ácido-base conjugados.


