16.2: Hidrocarburos
- Page ID
- 75022
- Identificar alcanos, alquenos, alquinos y compuestos aromáticos.
- Enumere algunas propiedades de los hidrocarburos.
Los compuestos orgánicos más simples son aquellos compuestos por sólo dos elementos: carbono e hidrógeno. Estos compuestos se denominan hidrocarburos. Los hidrocarburos mismos se separan en dos tipos: hidrocarburos alifáticos e hidrocarburos aromáticos.
Los hidrocarburos alifáticos son hidrocarburos basados en cadenas de átomos de C. Existen tres tipos de hidrocarburos alifáticos. Los alcanos son hidrocarburos alifáticos con solo enlaces covalentes simples. Los alquenos son hidrocarburos que contienen al menos un doble enlace C—C, y los alquinos son hidrocarburos que contienen un triple enlace C—C. Ocasionalmente, encontramos un hidrocarburo alifático con un anillo de átomos de C; estos hidrocarburos se denominan cicloalcanos (o cicloalquenos o cicloalquinos).
Los hidrocarburos aromáticos tienen un anillo especial de seis carbonos llamado anillo de benceno. Los electrones en el anillo de benceno tienen propiedades energéticas especiales que le dan al benceno propiedades físicas y químicas que son marcadamente diferentes de los alcanos. Originalmente, se utilizó el término aromático para describir esta clase de compuestos porque eran particularmente fragantes. Sin embargo, en la química moderna el término aromático denota la presencia de un anillo de seis miembros que imparte propiedades diferentes y únicas a una molécula.
Los alcanos más simples tienen sus átomos de C unidos en una cadena lineal; estos se llaman alcanos normales. Se nombran de acuerdo al número de átomos de C en la cadena. El alcano más pequeño es el metano:
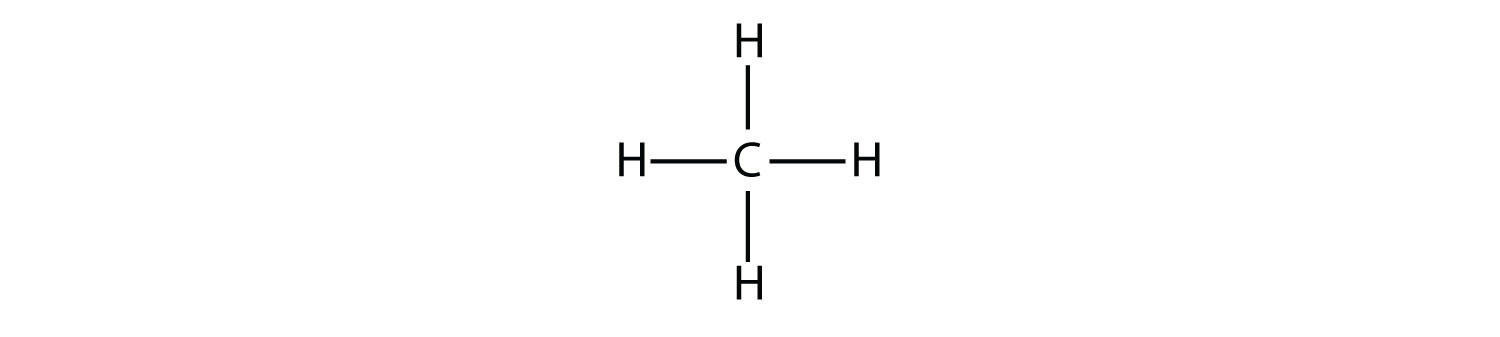
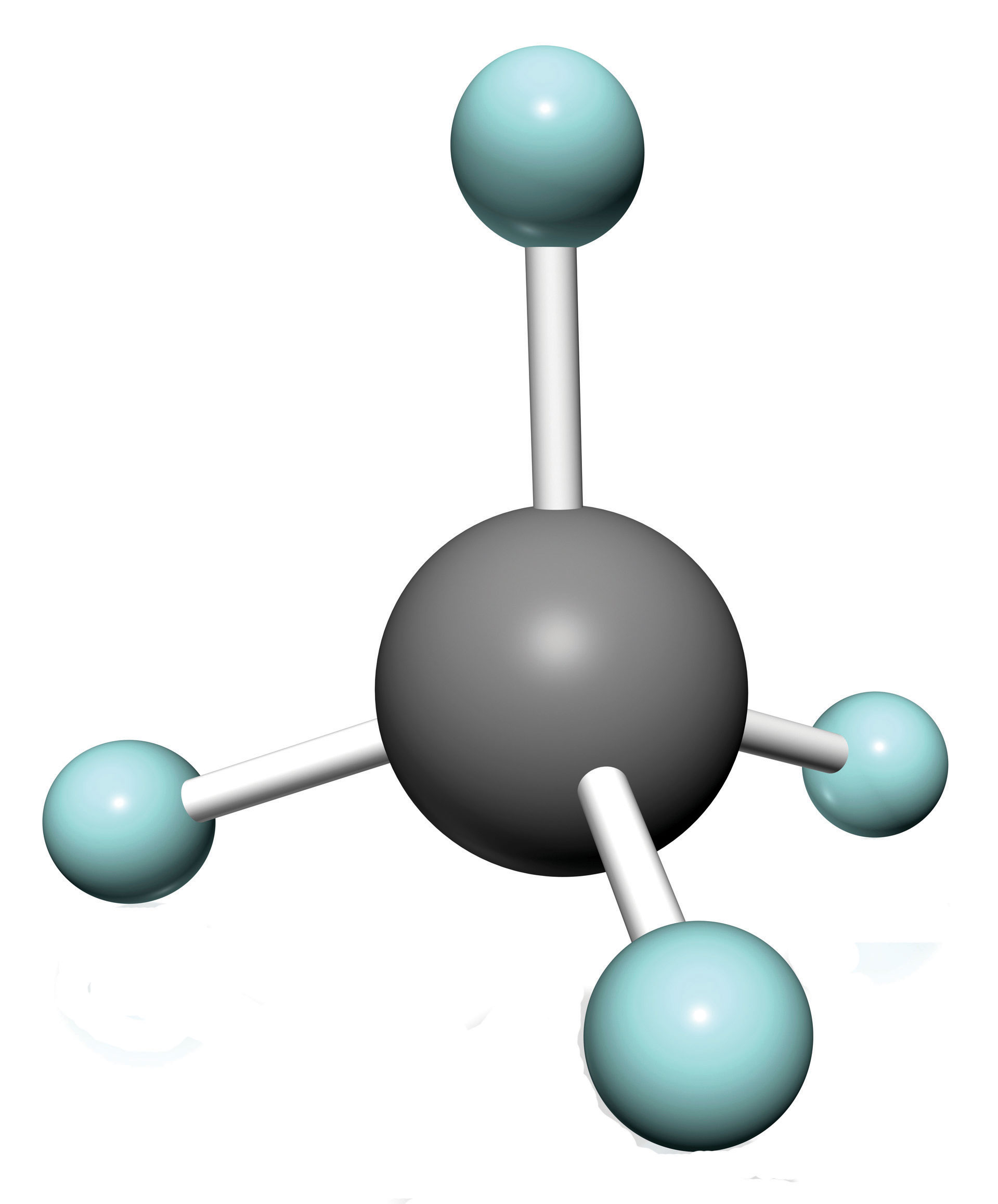
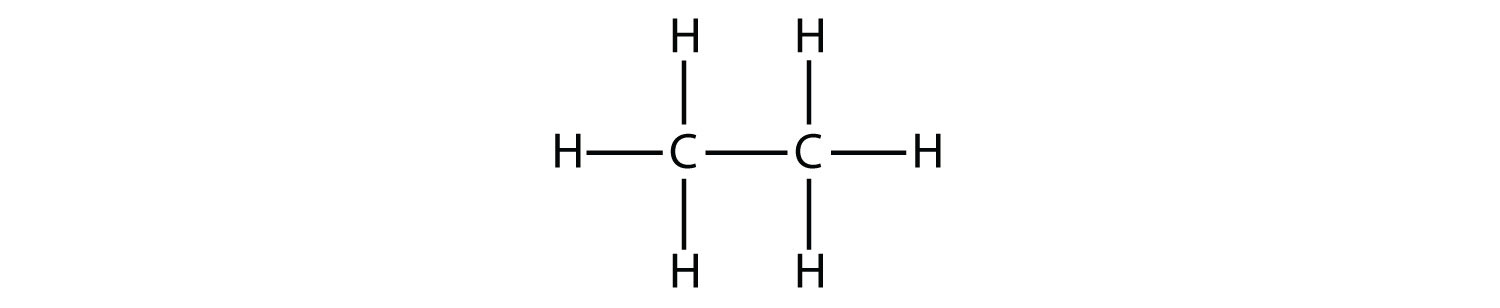
El siguiente alcano más grande tiene dos átomos de C que están unidos covalentemente entre sí. Para que cada átomo de C forme cuatro enlaces covalentes, cada átomo de C debe estar unido a tres átomos de H. La molécula resultante, cuya fórmula es C 2 H 6, es etano:
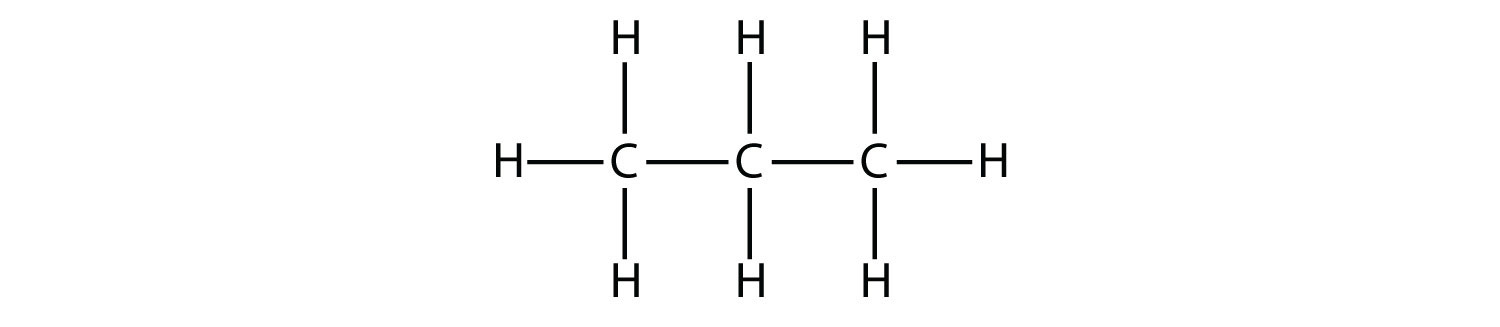
El propano tiene una cadena principal de tres átomos de C rodeados por átomos de H. Debe poder verificar que la fórmula molecular para propano es C 3 H 8:
Los diagramas que representan alcanos se denominan fórmulas estructurales porque muestran la estructura de la molécula. A medida que las moléculas crecen, las fórmulas estructurales se vuelven cada vez más complejas. Una forma de evitar esto es usar una fórmula estructural condensada, que enumera la fórmula de cada átomo de C en la cadena principal de la molécula. Por ejemplo, la fórmula estructural condensada para etano es CH 3 CH 3, mientras que para propano es CH 3 CH 2 CH 3. Cuadro\(\PageIndex{1}\) - Los primeros 10 alcanos, da las fórmulas moleculares, las fórmulas estructurales condensadas y los nombres de los primeros 10 alcanos.
| Fórmula molecular | Fórmula estructural condensada | Nombre |
|---|---|---|
| CH 4 | CH 4 | metano |
| C 2 H 6 | CH 3 CH 3 | etano |
| C 3 H 8 | CH 3 CH 2 CH 3 | propano |
| C 4 H 10 | CH 3 CH 2 CH 2 CH 3 | butano |
| C 5 H 12 | CH 3 CH 2 CH 2 CH 2 CH 3 | pentano |
| C 6 H 14 | CH 3 (CH 2) 4 CH 3 | hexano |
| C 7 H 16 | CH 3 (CH 2) 5 CH 3 | heptano |
| C 8 H 18 | CH 3 (CH 2) 6 CH 3 | octano |
| C 9 H 20 | CH 3 (CH 2) 7 CH 3 | nonano |
| C 10 H 22 | CH 3 (CH 2) 8 CH 3 | decano |
Debido a que los alcanos tienen el número máximo de átomos de H posible de acuerdo con las reglas de los enlaces covalentes, los alcanos también se denominan hidrocarburos saturados.
Los alquenos tienen un doble enlace C—C. Debido a que tienen menos del número máximo de átomos de H posible, son hidrocarburos insaturados. El alqueno más pequeño, el eteno, tiene dos átomos de C y también se le conoce con su nombre común etileno:
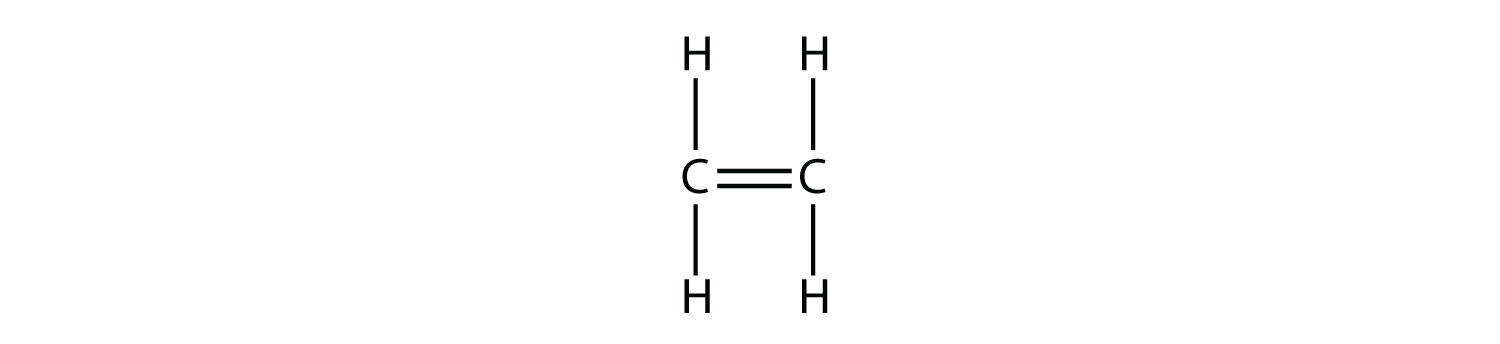
El siguiente alqueno más grande, propeno, tiene tres átomos de C con un doble enlace C-C entre dos de los átomos de C. También se le conoce como propileno:
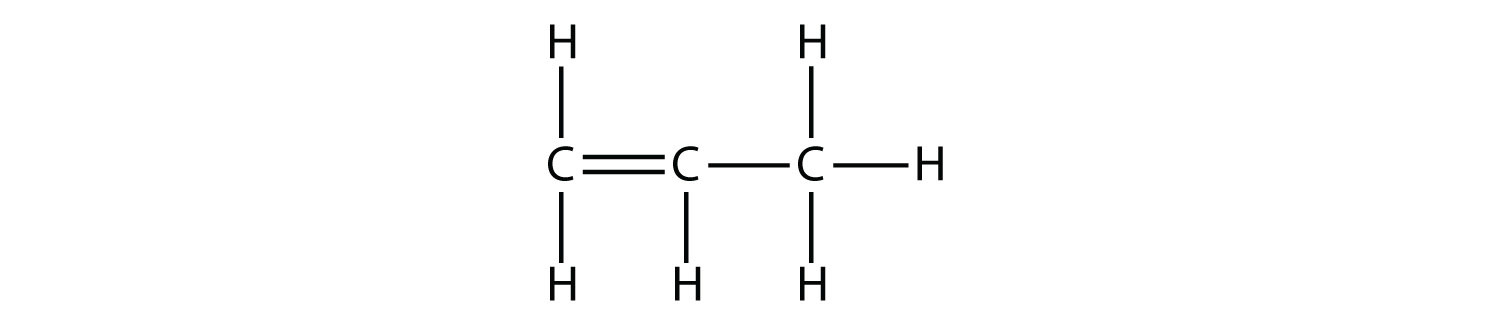
¿Qué notas sobre los nombres de alcanos y alquenos? Los nombres de los alquenos son los mismos que sus alcanos correspondientes excepto que el final es - ene, en lugar de - ane. El uso de un tallo para indicar el número de átomos de C en una molécula y una terminación para representar el tipo de compuesto orgánico es común en la química orgánica, como veremos.
Con la introducción del próximo alqueno, el buteno, comenzamos a ver un problema importante con las moléculas orgánicas: las elecciones. Con cuatro átomos de C, el doble enlace C-C puede ir entre el primer y segundo átomos de C o entre el segundo y tercer átomos de C:
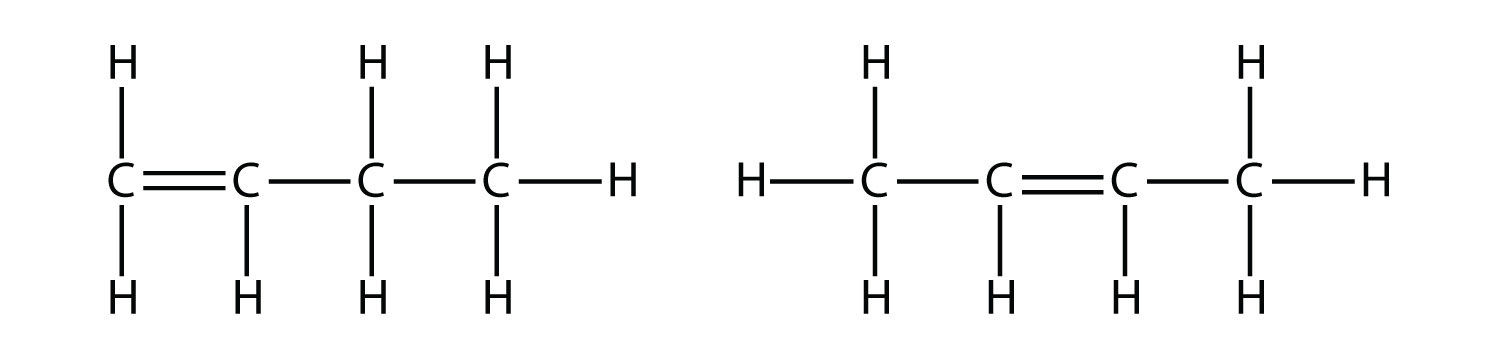
2 fórmulas estructurales para buteno, teniendo el primer buteno el doble enlace en el primer y segundo carbono desde la izquierda y este último teniendo su doble enlace en el segundo y tercer carbono desde la izquierda.
(Un doble enlace entre el tercer y cuarto átomos de C es lo mismo que tenerlo entre el primer y el segundo átomos de C, solo volteado). Las reglas de nomenclatura en química orgánica requieren que estas dos sustancias tengan nombres diferentes. La primera molécula se llama 1-buteno, mientras que la segunda molécula se denomina 2-buteno. El número al inicio del nombre indica dónde se origina el doble enlace. El número más bajo posible se usa para numerar una característica en una molécula; por lo tanto, llamar a la segunda molécula 3-buteno sería incorrecto. Los números son partes comunes de los nombres químicos orgánicos porque indican qué átomo de C en una cadena contiene una característica distintiva.
Los compuestos 1-buteno y 2-buteno tienen diferentes propiedades físicas y químicas, aunque tienen la misma fórmula molecular—C 4 H 8. Diferentes moléculas con la misma fórmula molecular se llaman isómeros. Los isómeros son comunes en la química orgánica y contribuyen a su complejidad.
Con base en los nombres de las moléculas de buteno, proponer un nombre para esta molécula.
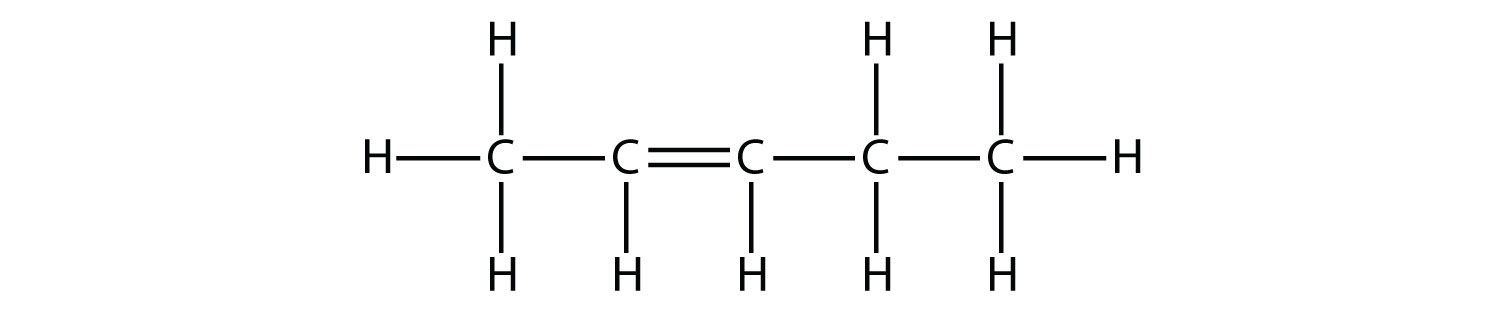
Solución
Con cinco átomos de C, usaremos el tallo reprimido, y con un doble enlace C—C, este es un alqueno, por lo que esta molécula es un penteno. En la numeración de los átomos de C, utilizamos el número 2 porque es la etiqueta más baja posible. Entonces esta molécula se llama 2-penteno.
Con base en los nombres de las moléculas de buteno, proponer un nombre para esta molécula.
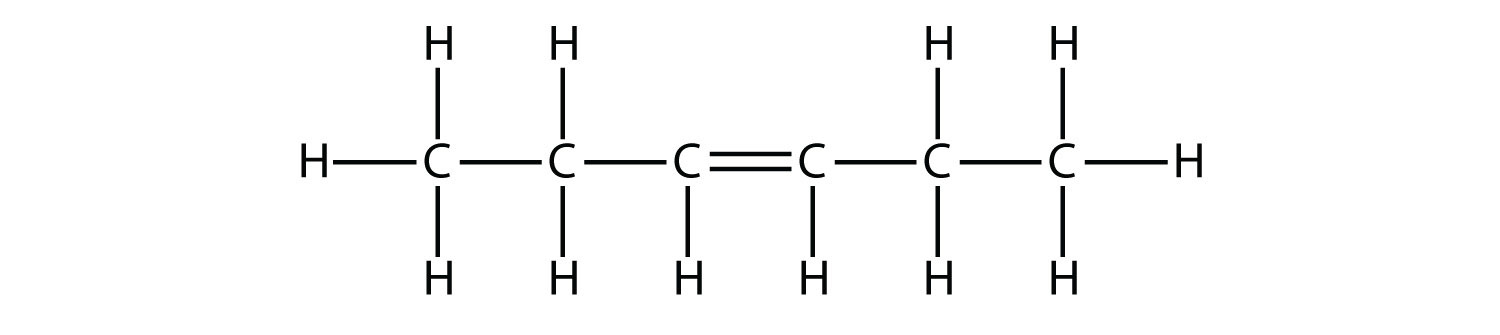
Fórmula estructural de una molécula de seis carbonos con un doble enlace en el tercer y cuarto carbono desde la izquierda. Hay doce átomos de hidrógeno en total.
- Contestar
-
3-hexeno
Los alquinos, con un triple enlace C—C, se nombran de manera similar a los alquenos excepto que sus nombres terminan en - yne. El alquino más pequeño es el etino, que también se conoce como acetileno:
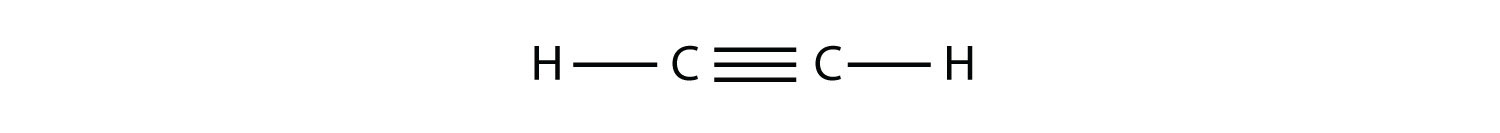
Propyne tiene la estructura
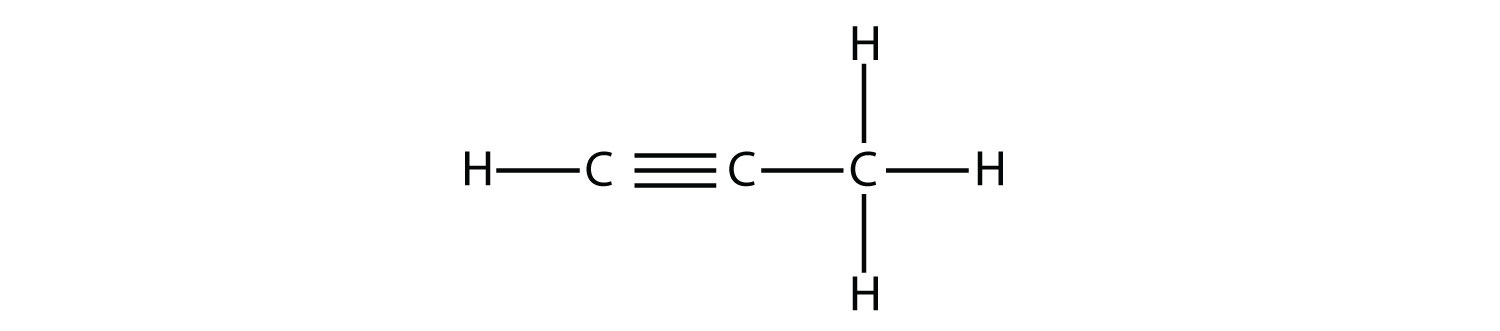
Fórmula estructural que muestra tres moléculas de carbono con un triple enlace presente entre el primer y segundo átomo de carbono. El número apropiado de átomos de hidrógeno está unido a cada átomo de carbono.
Con butino, necesitamos comenzar a numerar la posición del triple enlace, tal como hicimos con los alquenos:
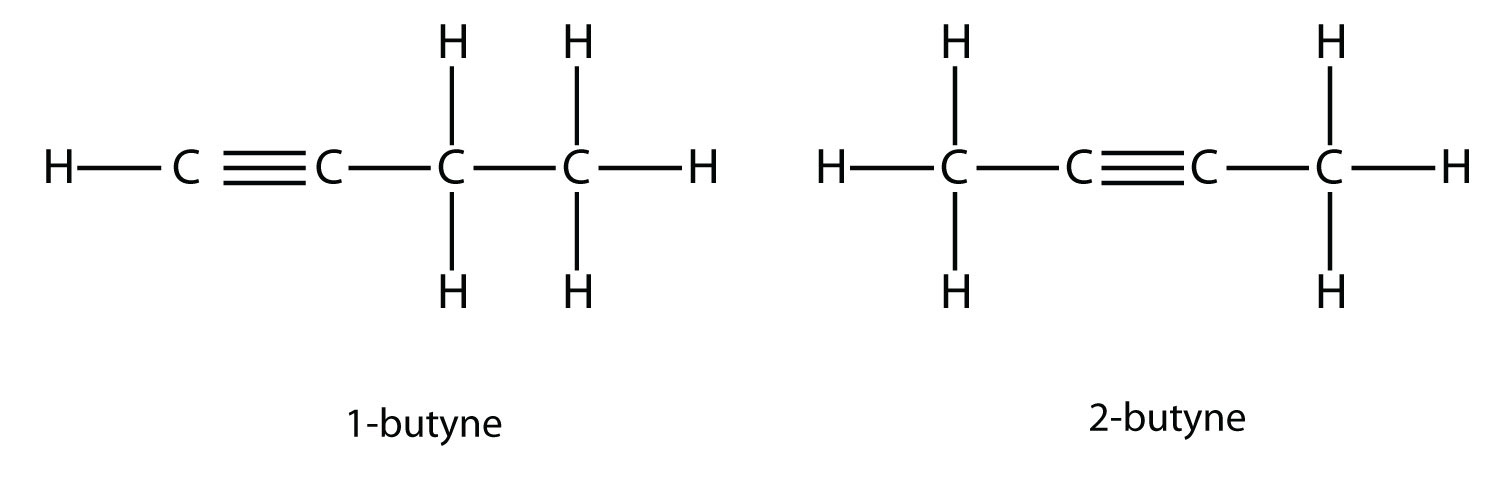
Dos fórmulas estructurales de butino. Un butino tiene un triple enlace entre el primer y el segundo átomo de carbono, mientras que dos butinos tienen el triple enlace entre el segundo y tercer átomo de carbono.
Los compuestos aromáticos contienen la unidad de benceno. El benceno mismo está compuesto por seis átomos de C en un anillo, con enlaces C—C simples y dobles alternantes:
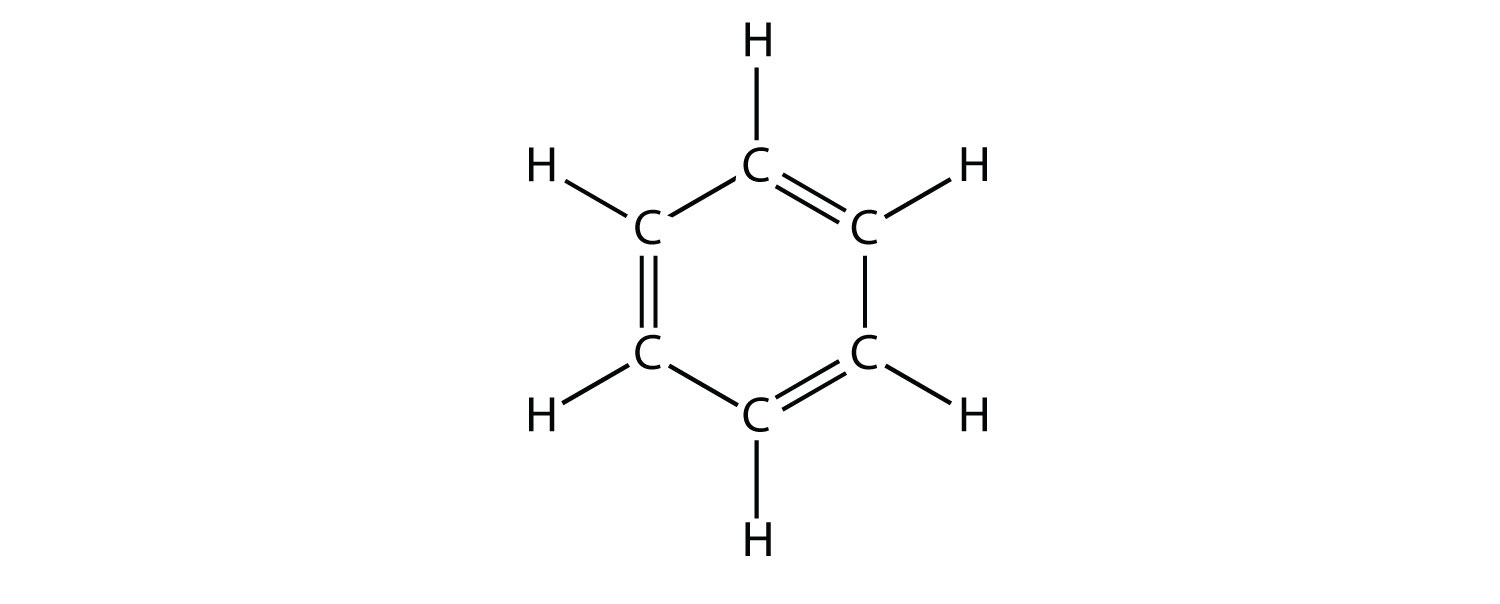
Los seis carbonos están dispuestos en un patrón hexagonal con un átomo de hidrógeno emergiendo hacia afuera de cada átomo de carbono. La presencia de un doble enlace se alterna entre cada otro átomo de carbono.
Los enlaces C—C simples y dobles alternantes le dan al anillo de benceno una estabilidad especial, y no reacciona como un alqueno como podría sospecharse. El benceno tiene la fórmula molecular C 6 H 6; en compuestos aromáticos más grandes, un átomo diferente reemplaza uno o más de los átomos de H.
Tan fundamentales como los hidrocarburos son para la química orgánica, sus propiedades y reacciones químicas son bastante mundanas. La mayoría de los hidrocarburos son no polares debido a las electronegatividades cercanas de los átomos de C y H. Como tal, se disuelven solo escasamente en H 2 O y otros solventes polares. Los hidrocarburos pequeños, como el metano y el etano, son gases a temperatura ambiente, mientras que los hidrocarburos más grandes, como el hexano y el octano, son líquidos. Los hidrocarburos aún más grandes son sólidos a temperatura ambiente y tienen una consistencia suave y cerosa.
Los hidrocarburos son bastante poco reactivos, pero sí participan en algunas reacciones químicas clásicas. Una reacción común es la sustitución con un átomo de halógeno combinando un hidrocarburo con un halógeno elemental. A veces se utiliza la luz para promover la reacción, como esta entre metano y cloro:
\[CH_{4}+Cl_{2}\overset{light}{\rightarrow} CH_{3}Cl+HCl\nonumber \]
Los halógenos también pueden reaccionar con alquenos y alquinos, pero la reacción es diferente. En estos casos, el halógeno reacciona con el doble o triple enlace C-C y se inserta en cada átomo de C involucrado en los múltiples enlaces. Esta reacción se denomina reacción de adición. Un ejemplo es
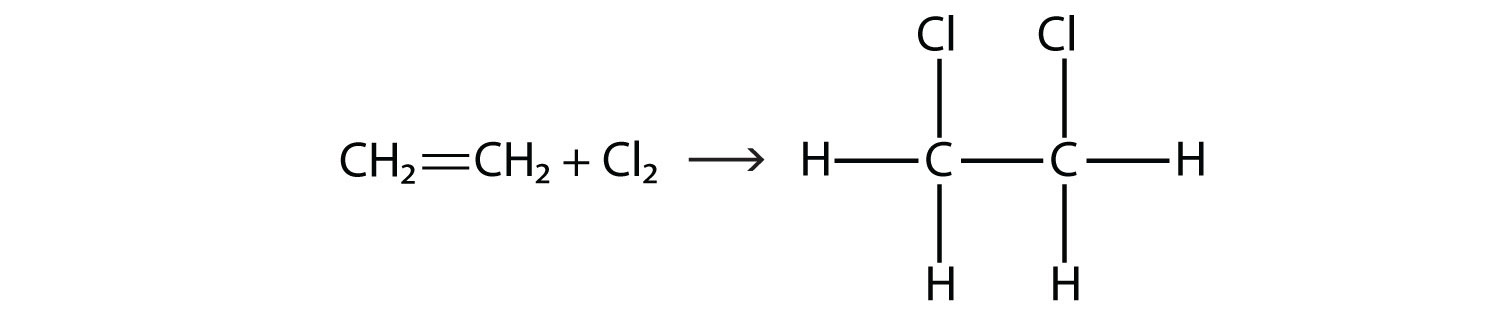
Las condiciones de reacción suelen ser suaves; en muchos casos, el halógeno reacciona espontáneamente con un alqueno o un alquino.
El hidrógeno también se puede agregar a través de un enlace múltiple; esta reacción se llama reacción de hidrogenación. En este caso, sin embargo, las condiciones de reacción pueden no ser suaves; pueden ser necesarias altas presiones de gas H2. Normalmente se emplea un catalizador de platino o paladio para conseguir que la reacción proceda a un ritmo razonable:
\[CH_{2}=CH_{2}+H_{2}\overset{metal\: catalyst}{\rightarrow} CH_{3}CH_{3}\nonumber \]
Con mucho, la reacción más común de los hidrocarburos es la combustión, que es la combinación de un hidrocarburo con O 2 para hacer CO 2 y H 2 O. La combustión de hidrocarburos va acompañada de una liberación de energía y es una fuente primaria de producción de energía en nuestra sociedad (Figura\(\PageIndex{2}\) - Combustión). La reacción de combustión para gasolina, por ejemplo, que puede representarse por C 8 H 18, es la siguiente:
\[2C^{8}H_{18}+25O_{2}\rightarrow 16CO_{2}+18H_{2}O+\sim 5060kJ\nonumber \]

Claves para llevar
- Los compuestos orgánicos más simples son los hidrocarburos y están compuestos por carbono e hidrógeno.
- Los hidrocarburos pueden ser alifáticos o aromáticos; los hidrocarburos alifáticos se dividen en alcanos, alquenos y alquinos.
- La combustión de hidrocarburos es una fuente primaria de energía para nuestra sociedad.
- Definir hidrocarburo. ¿Cuáles son los dos tipos generales de hidrocarburos?
- ¿Cuáles son los tres tipos diferentes de hidrocarburos alifáticos? ¿Cómo se definen?
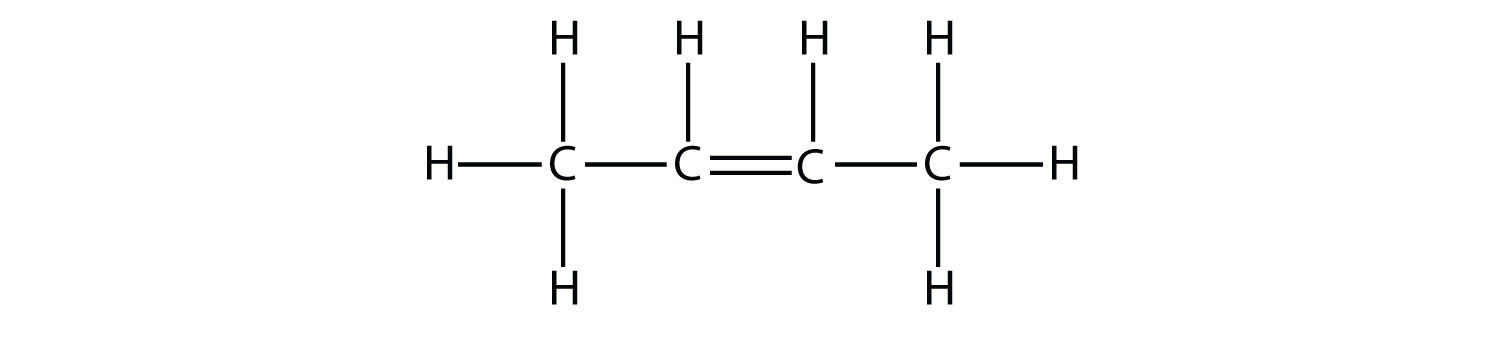
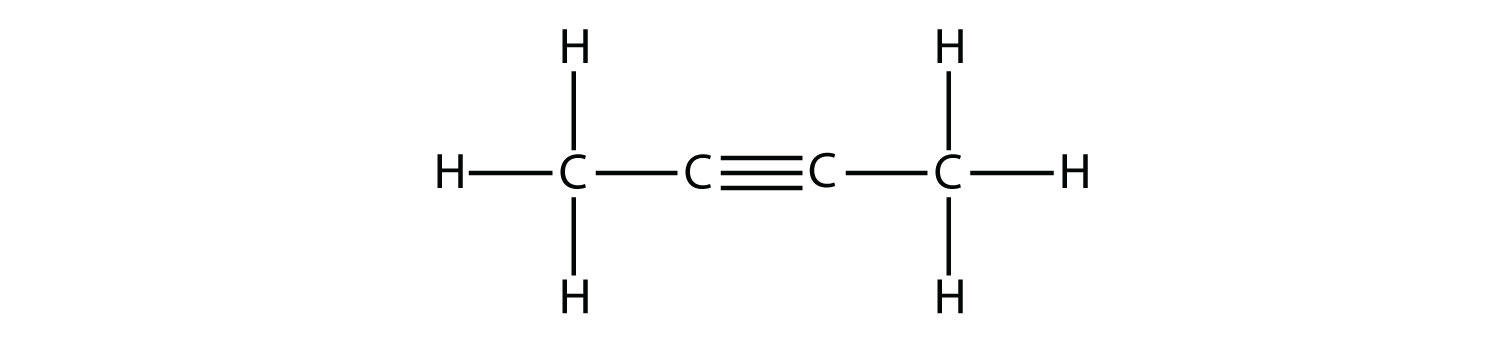
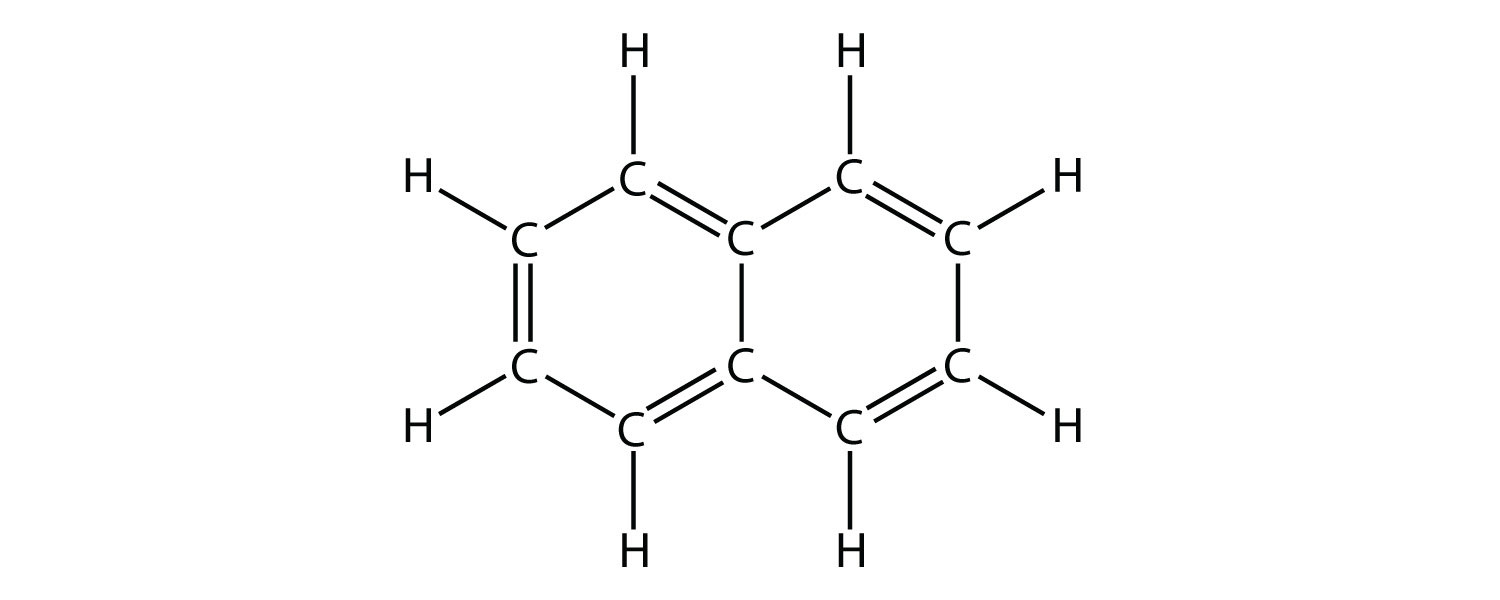
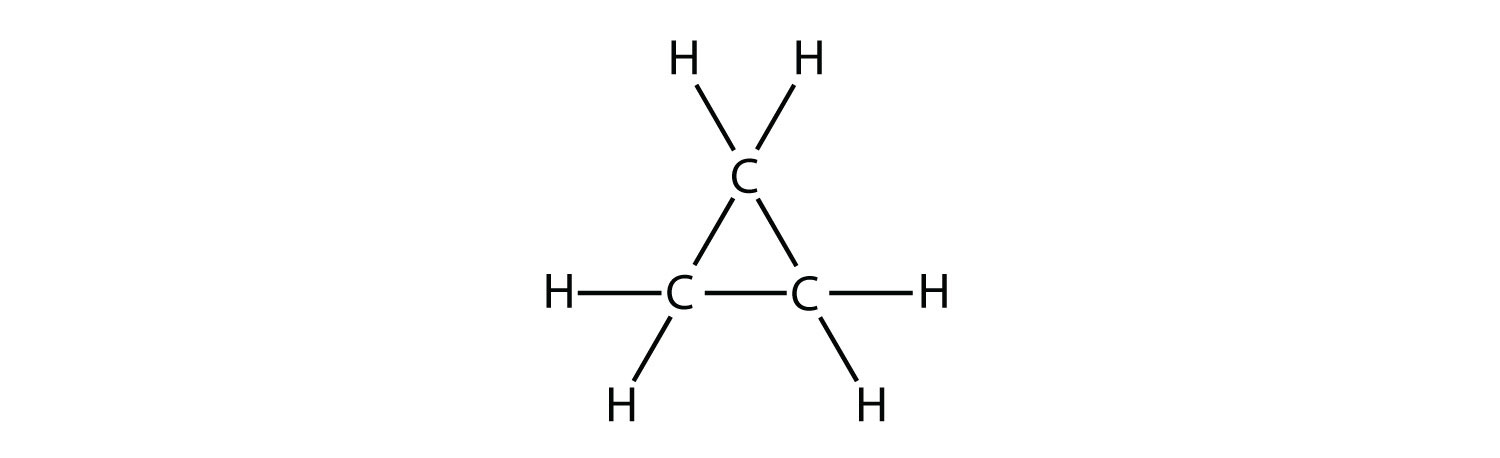
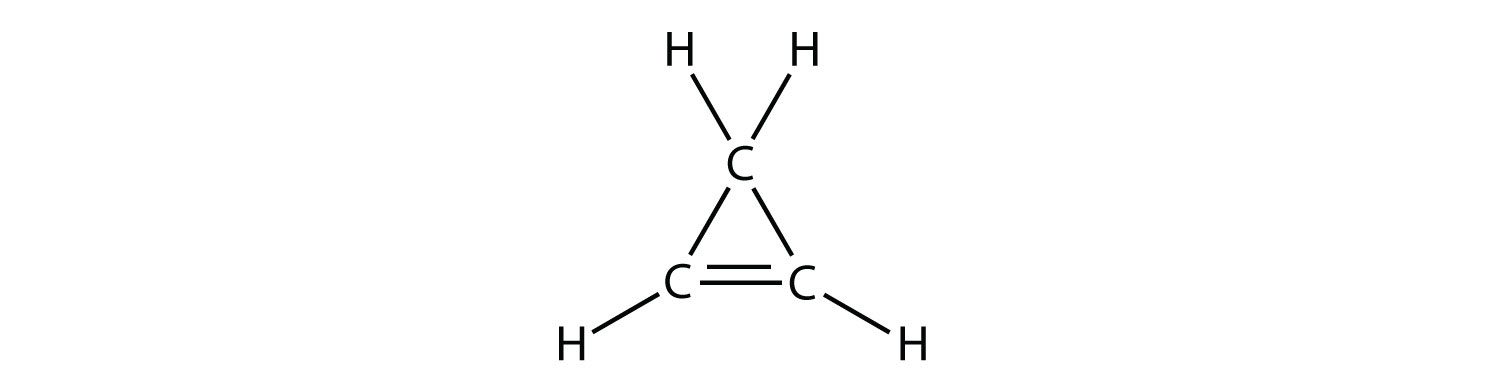
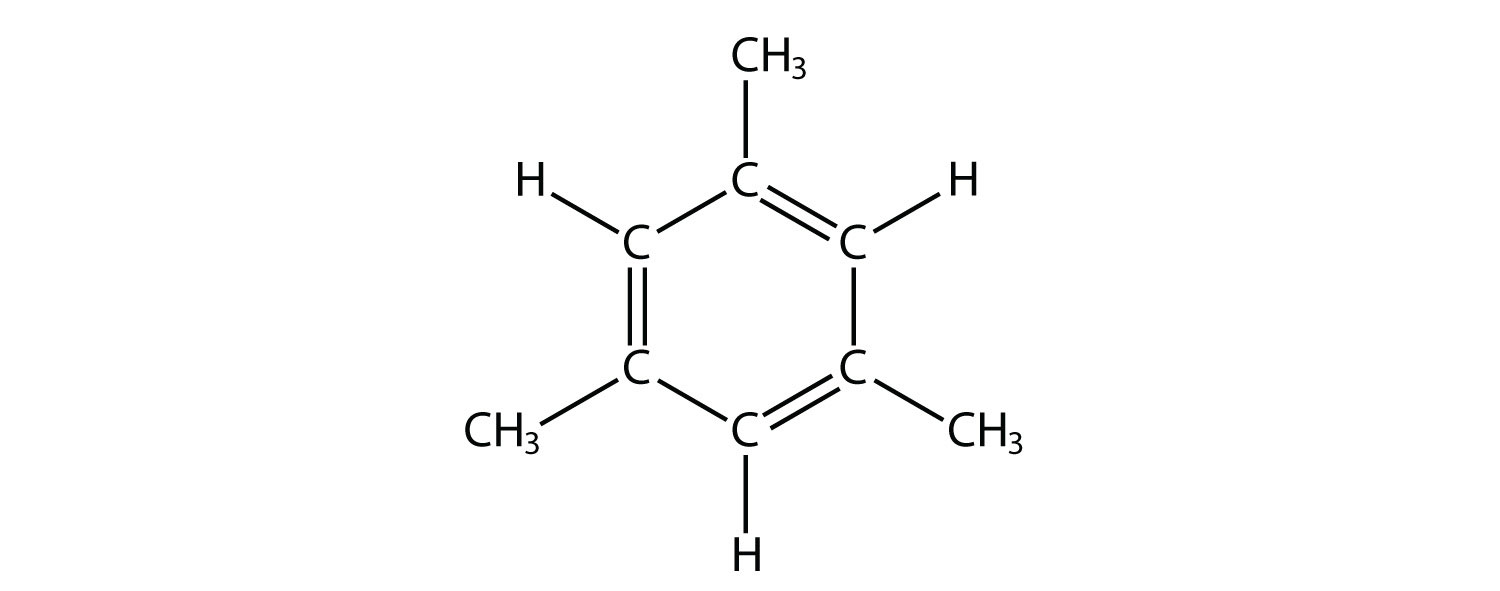
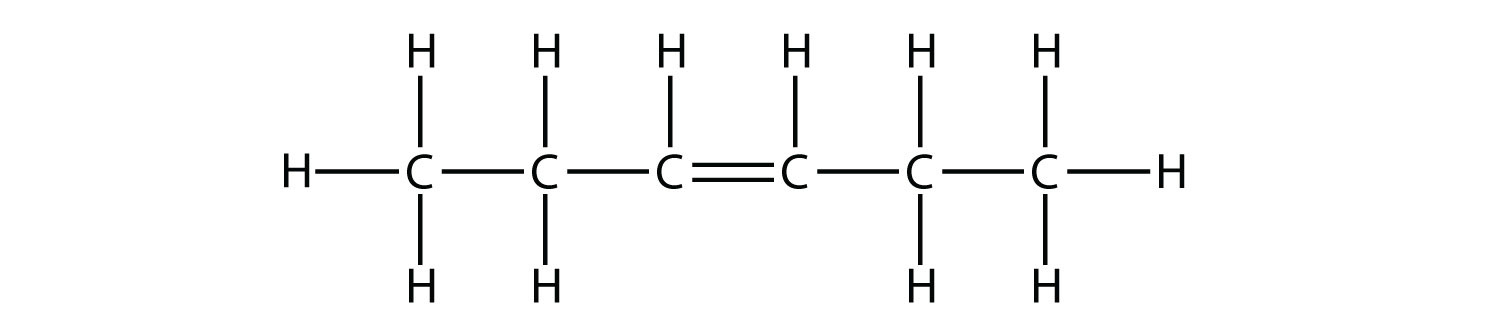
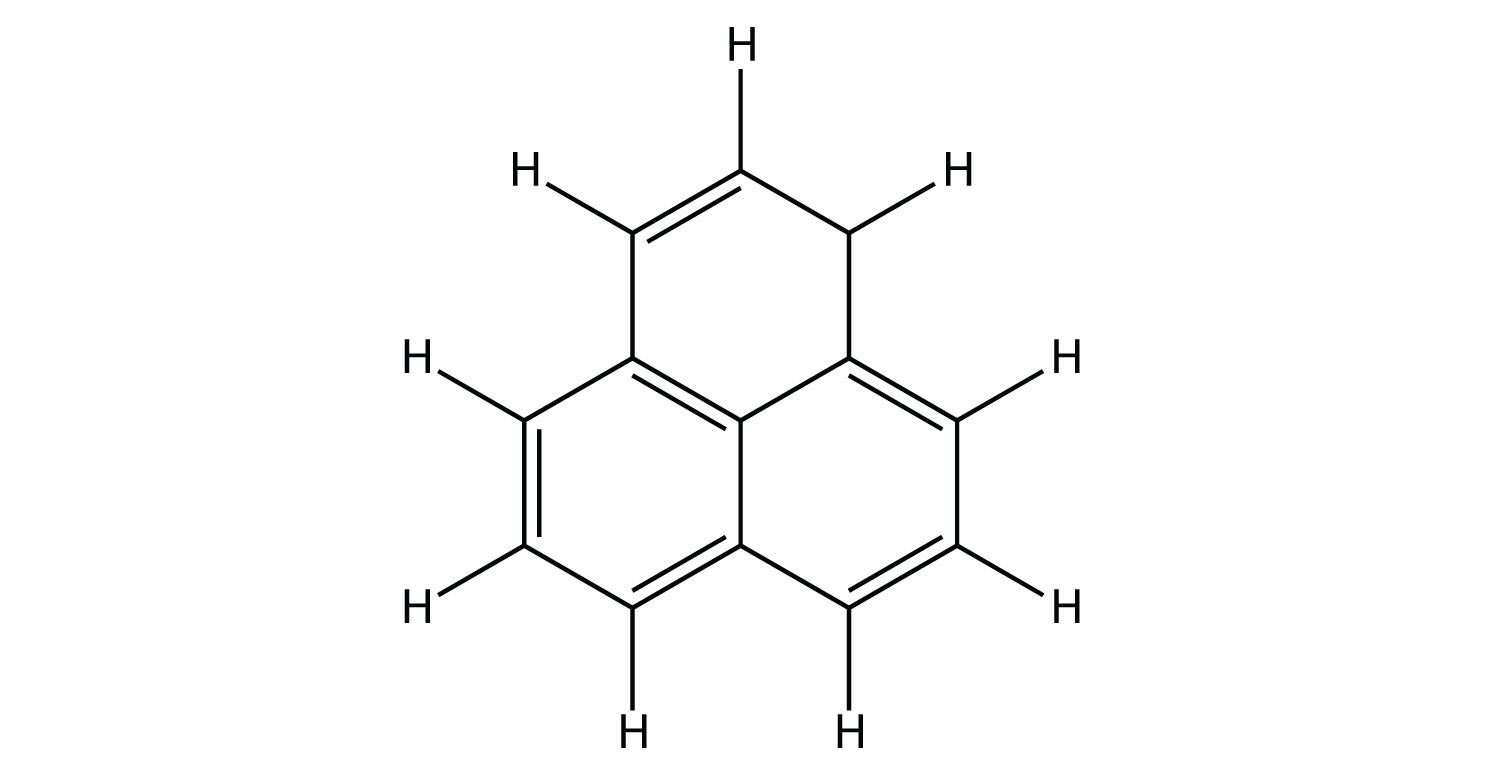
- Indicar si cada molécula es un hidrocarburo alifático o aromático; si es alifático, identificar la molécula como un alcano, un alqueno o un alquino.
- Indicar si cada molécula es un hidrocarburo alifático o aromático; si es alifático, identificar la molécula como un alcano, un alqueno o un alquino.
- Indicar si cada molécula es un hidrocarburo alifático o aromático; si es alifático, identificar la molécula como un alcano, un alqueno o un alquino.
- Indicar si cada molécula es un hidrocarburo alifático o aromático; si es alifático, identificar la molécula como un alcano, un alqueno o un alquino.
- Nombra y dibuja las fórmulas estructurales para los cuatro alcanos más pequeños.
- Nombra y dibuja las fórmulas estructurales para los cuatro alquenos más pequeños.
- ¿Qué implica el término aromático sobre una molécula orgánica?
- ¿Qué implica el término normal cuando se usa para alcanos?
- Explique por qué el nombre 1-propeno es incorrecto. ¿Cuál es el nombre propio de esta molécula?
- Explique por qué el nombre 3-buteno es incorrecto. ¿Cuál es el nombre propio de esta molécula?
- Nombra y dibuja la fórmula estructural de cada isómero de penteno.
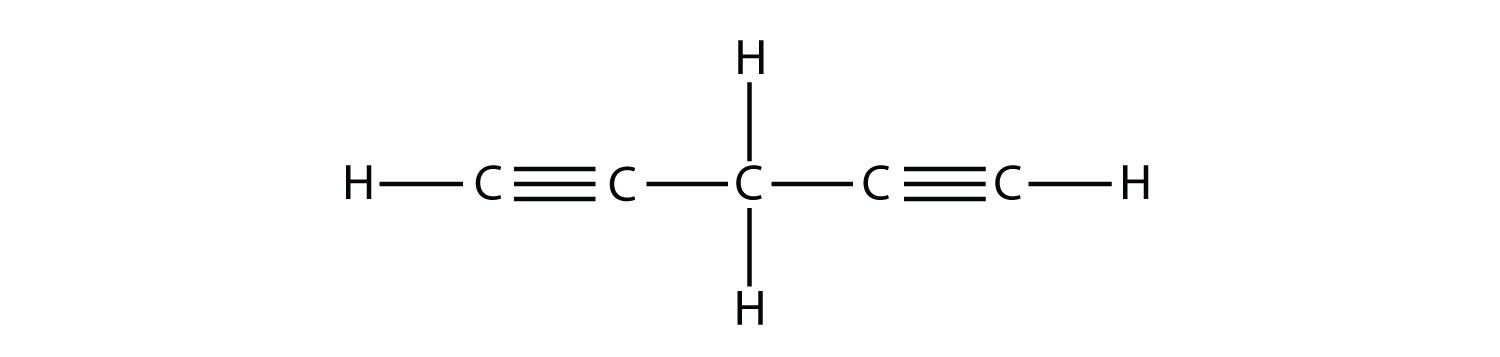
- Nombra y dibuja la fórmula estructural de cada isómero del hexino.
- Escribir una ecuación química para la reacción entre metano y bromo.
- Escribir una ecuación química para la reacción entre etano y cloro.
- Dibujar la estructura del producto de la reacción del bromo con propeno.
- Dibujar la estructura del producto de la reacción de cloro con 2-buteno.
- Dibujar la estructura del producto de la reacción de hidrógeno con 1-buteno.
- Dibujar la estructura del producto de la reacción de hidrógeno con 1-buteno.
- Escribir la ecuación química balanceada para la combustión de heptano.
- Escribir la ecuación química balanceada para la combustión de nonano.



RESPUESTAS