2.2: Leyes científicas - Conservación de proporciones masivas y definidas
- Page ID
- 72623
- Explicar la ley de conservación de la masa.
- Explicar la ley de proporciones definidas.
La Ley de Conservación de la Misa
Puede parecer como si la quema destruye la materia, pero la misma cantidad, o masa, de materia todavía existe después de una fogata que antes. La figura\(\PageIndex{2}\) (abajo) muestra que cuando la madera se quema, se combina con el oxígeno y cambia no sólo a cenizas, sino también a dióxido de carbono y vapor de agua. Los gases flotan en el aire, dejando atrás solo las cenizas. Supongamos que había medido la masa de la madera antes de que se quemara y la masa de las cenizas después de que se quemara. También suponga que usted había podido medir el oxígeno utilizado por el fuego y los gases producidos por el fuego. ¿Qué encontrarías? La masa total de materia después del incendio sería la misma que la masa total de materia antes del incendio.

La ley de conservación de la masa fue creada en 1789 por el químico francés Antoine Lavoisier. La ley de conservación de la masa establece que la materia no puede ser creada o destruida en una reacción química. Por ejemplo, en la Figura,\(\PageIndex{3}\) cuando la madera se quema, la masa del hollín, las cenizas y los gases es igual a la masa original de la madera y al oxígeno cuando reaccionó por primera vez.
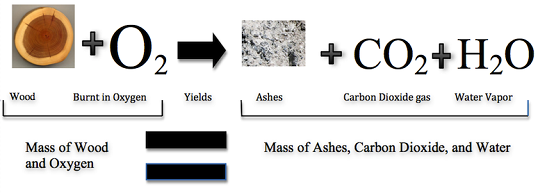
Entonces, la masa del (de los) producto (s) es igual a la masa de los reactivos. Los reactivos son dos o más elementos que interactúan químicamente para hacer una nueva sustancia; producto es la (s) sustancia (s) formada (s) como resultado de una reacción química (Video\(\PageIndex{1}\)). La materia (y masa) puede no ser capaz de ser creada o destruida, pero puede cambiar de forma a otras sustancias como líquidos, gases, sólidos, etc.
Video\(\PageIndex{1}\) Esta es una pequeña y agradable demostración que muestra la conservación de la masa en acción.
Es importante conocer bien la ley. Si un árbol de 300 kg se quema, cuando el proceso está completo, solo quedan cenizas, y todas ellas juntas pesan 10 kg. Quizás te preguntes a dónde fueron los otros 290 kg. Los 290 kg faltantes fueron liberados a la atmósfera como humo, por lo que la única materia visible que queda son los 10 kg de ceniza. Si entiendes la ley de conservación de la masa, entonces sabes que los otros 290 kg tenían que ir a algún lado, porque tenía que igualar la masa del árbol antes de que se quemara.
Si calentar 10.0 gramos de carbonato de calcio (CaCo 3) produce 4.4 g de dióxido de carbono (CO 2) y 5.6 g de óxido de calcio (CaO), muestran que estas observaciones están de acuerdo con la ley de conservación de la masa.
Solución
\[\begin{align*} \text{Mass of the reactants} &= \text{Mass of the products} \\[4pt] 10.0\, \text{g of } \ce{CaCO3} &= 4.4 \,\text{g of }\ce{CO2} + 5.6\, \text{g of } \ce{ CaO} \\[4pt] 10.0\,\text{g of reactant} &= 10.0\, \text{g of products} \end{align*} \nonumber \]
Debido a que la masa del reactivo es igual a la masa de los productos, las observaciones están de acuerdo con la ley de conservación de la masa.
El hidróxido de potasio (\(\ce{KOH}\)) reacciona fácilmente con el dióxido de carbono (\(\ce{CO2}\)) para producir carbonato de potasio (\(\ce{K2CO3}\)) y agua (\(\ce{H2O}\)). ¿Cuántos gramos de carbonato de potasio se producen si 224.4 g de\(\ce{KOH}\) reaccionan con 88.0 g de\(\ce{CO2}\)? La reacción también produce 36.0 g de agua.
- Contestar
- 276.4 g de carbonato de potasio
La Ley de Proporciones Definidas
Joseph Proust (1754-1826) formuló la ley de proporciones definidas (también llamada Ley de Composición Constante o Ley de Proust). Esta ley establece que si un compuesto se descompone en sus elementos constitutivos, las masas de los constituyentes siempre tendrán las mismas proporciones, independientemente de la cantidad o fuente de la sustancia original. Joseph Proust basó esta ley principalmente en sus experimentos con carbonato de cobre básico. La siguiente ilustración muestra esta ley en acción.
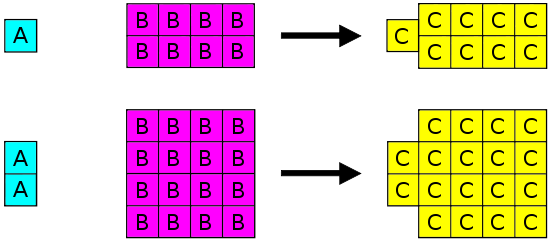
Ley de Proporciones Definidas establece que en un determinado tipo de sustancia química, los elementos siempre se combinan en las mismas proporciones por masa.
La Ley de Proporciones Definidas se aplica cuando los elementos reaccionan juntos para formar el mismo producto. Por lo tanto, mientras que la Ley de Proporciones Definidas puede utilizarse para comparar dos experimentos en los que el hidrógeno y el oxígeno reaccionan para formar agua, la Ley de Proporciones Definidas no puede utilizarse para comparar un experimento en el que el hidrógeno y el oxígeno reaccionan para formar agua, y otro experimento en el que hidrógeno y oxígeno reaccionan para formar peróxido de hidrógeno (el peróxido es otro material que puede estar hecho de hidrógeno y oxígeno).
El oxígeno constituye 88.8% de la masa de cualquier muestra de agua pura, mientras que el hidrógeno constituye el 11.2% restante de la masa. Se puede obtener agua fundiendo hielo o nieve; o condensando vapor de un río, mar, estanque, etc. Puede ser de diferentes lugares: Estados Unidos, Reino Unido, Australia o cualquier lugar. El agua se puede hacer por reacciones químicas, como quemar hidrógeno en oxígeno.
Sin embargo, si el agua es pura, siempre consistirá en 88.8% de oxígeno en masa y 11.2% de hidrógeno en masa, independientemente de su fuente o método de preparación.
Video\(\PageIndex{2}\) Ley de proporciones definidas.
Resumen
- La quema y otros cambios en la materia no destruyen la materia.
- La masa de materia es siempre la misma antes y después de que ocurran los cambios.
- La ley de conservación de masas establece que la materia no puede crearse ni destruirse.
- La ley de proporciones definidas establece que un compuesto químico dado siempre contiene los mismos elementos en las mismas proporciones exactas en masa.
Referencias
- Petrucci, Ralph, William Harwood, Geoffrey Herring y Jeffry Madura. Química General. 9ª ed. Upper Saddle River, Nueva Jersey: Pearson Prentince Hall, 2007.
- Moore, John. Química para Dummies. John Wiley & Sons Inc, 2002.
- Asimov, Isaac. Una breve historia de la química., CT.: Greenwood Press, 1965.
- Patterson, Elizabeth C. John Dalton y la Teoría Atómica. Garden City, NY: Doubleday, 1970.
- Myers, Richard. Los fundamentos de la química. Greenwood, 2003.
- Demtröder, Wolfgang. Átomos, moléculas y fotones: una introducción a la física atómica molecular y cuántica. 1a ed. Springer. 2002.
Colaboradores y Atribuciones
Binod Shrestha (University of Lorraine)
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Henry Agnew (UC Davis)

