2.3: John Dalton y la teoría atómica de la materia
- Page ID
- 72601
- Resumir la teoría atómica de Dalton.
- Explicar la Ley de múltiples proporciones.
Si bien hay que suponer que muchos más científicos, filósofos y otros estudiaron la composición de la materia después de Demócrito, un gran salto adelante en nuestra comprensión de la composición de la materia tuvo lugar en el siglo XIX con la obra del científico británico John Dalton. Comenzó a dar clases en la escuela a los doce años, y se le conocía principalmente como maestro. A los veinte años, se trasladó a la creciente ciudad de Manchester, donde pudo realizar algunos estudios científicos. Su trabajo en varias áreas de la ciencia le trajo una serie de honores. Al morir, más de 40 mil personas en Manchester marcharon en su funeral.
La teoría atómica moderna de Dalton, propuesta alrededor de 1803, es un concepto fundamental que establece que todos los elementos están compuestos por átomos. Anteriormente, definimos un átomo como la parte más pequeña de un elemento que mantiene la identidad de ese elemento. Los átomos individuales son extremadamente pequeños; incluso el átomo más grande tiene un diámetro aproximado de sólo 5.4 × 10 −10 m. A ese tamaño, toma más de 18 millones de estos átomos, alineados uno al lado del otro, para igualar el ancho de un dedo meñique humano (aproximadamente 1 cm).

Dalton estudió los pesos de diversos elementos y compuestos. Se percató de que la materia siempre se combina en proporciones fijas basadas en el peso, o volumen en el caso de los gases. Los compuestos químicos siempre contienen la misma proporción de elementos en masa, independientemente de la cantidad, lo que proporcionó un mayor apoyo a la ley de Proust de proporciones definidas. Dalton también observó que podría haber más de una combinación de dos elementos.
A partir de sus experimentos y observaciones, así como del trabajo de pares de su tiempo, Dalton propuso su nueva teoría del átomo. Esto más tarde se conoció como la teoría atómica de Dalton. Los principios generales de esta teoría fueron los siguientes:
- Toda la materia está compuesta por partículas extremadamente pequeñas llamadas átomos.
- Los átomos de un elemento dado son idénticos en tamaño, masa y otras propiedades (Figura\(\PageIndex{2}\)). Los átomos de diferentes elementos difieren en tamaño, masa y otras propiedades.

- Los átomos no pueden ser subdivididos, creados o destruidos.
- Los átomos de diferentes elementos pueden combinarse en proporciones simples de números enteros para formar compuestos químicos (Figura\(\PageIndex{3}\)).
- En las reacciones químicas, los átomos se combinan, separan o reordenan.

La teoría atómica de Dalton ha sido ampliamente aceptada por la comunidad científica, con la excepción de tres cambios. La ciencia actual reconoce que:
(1) Un átomo puede subdividirse aún más.
(2) Todos los átomos de un elemento no son idénticos en masa.
(3) Utilizando técnicas de fisión y fusión nuclear, podemos crear o destruir átomos cambiándolos en otros átomos.

En el siguiente dibujo, las esferas verdes representan átomos de cierto elemento. Las esferas moradas representan átomos de otro elemento. Si las esferas se tocan, forman parte de una sola unidad de un compuesto. ¿El siguiente cambio químico representado por estos símbolos viola alguna de las ideas de la teoría atómica de Dalton? Si es así, ¿cuál?
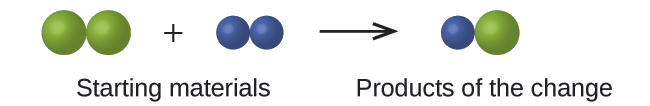
Solución
Los materiales de partida consisten en dos esferas verdes y dos esferas moradas. Los productos constan de una sola esfera verde y una esfera morada. Esto viola el postulado de Dalton de que los átomos no se crean ni se destruyen durante un cambio químico, sino que simplemente se redistribuyen. (En este caso, los átomos parecen haber sido destruidos).
En el siguiente dibujo, las esferas verdes representan átomos de cierto elemento. Las esferas moradas representan átomos de otro elemento. Si las esferas se tocan, forman parte de una sola unidad de un compuesto. ¿El siguiente cambio químico representado por estos símbolos viola alguna de las ideas de la teoría atómica de Dalton? Si es así, ¿cuál?

- Contestar
-
Los materiales de partida constan de cuatro esferas verdes y dos esferas moradas. Los productos constan de cuatro esferas verdes y dos esferas moradas. Esto no viola ninguno de los postulados de Dalton: los átomos no se crean ni destruyen, sino que se redistribuyen en pequeñas proporciones de números enteros.
Ley de Múltiples Proporciones
Muchas combinaciones de elementos pueden reaccionar para formar más de un compuesto. En tales casos, las masas de un elemento particular que se combinan con una masa fija de un segundo elemento son demostrables en proporciones de números enteros pequeños. Es fácil decir esto, pero por favor asegúrate de entender cómo funciona. El nitrógeno forma un número muy grande de óxidos, cinco de los cuales se muestran aquí.
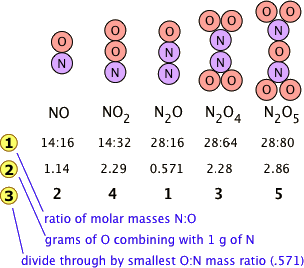
- La línea 1 muestra la relación de los pesos relativos de los dos elementos en cada compuesto. Estas relaciones se calcularon simplemente tomando la masa molar de cada elemento, y multiplicando por el número de átomos de ese elemento por mol del compuesto. Así para NO 2, tenemos (1 × 14): (2 × 16) = 14:32. (Estos números no se conocían en los primeros días de la Química porque los pesos atómicos [es decir, masas molares] de la mayoría de los elementos no se conocían de manera confiable)
- Los números en la Línea 2 son solo las relaciones de masa de O:N, que se encuentran dividiendo las proporciones correspondientes en la línea 1. Pero alguien que depende únicamente del experimento los resolvería encontrando la masa de O que se combina con la masa unitaria (1 g) de nitrógeno.
- La línea 3 se obtiene dividiendo las cifras de la Línea 2 por la relación O:N más pequeña en la Línea 2 (que es la relación para N 2 O). Tenga en cuenta que así como dice la ley de proporciones múltiples, el peso del oxígeno que se combina con el peso unitario de nitrógeno funciona a números enteros pequeños; hay un error tipográfico en la Línea 3 —donde hay un 3, debería haber un 4.
- Por supuesto, con la misma facilidad podríamos haber ilustrado la ley considerando la masa de nitrógeno que combina con un gramo de oxígeno; ¡funciona en ambos sentidos!
La ley de proporciones múltiples establece que si dos elementos forman más de un compuesto entre ellos, las masas de un elemento combinadas con una masa fija del segundo elemento se forman en proporciones de enteros pequeños.
Video \(\PageIndex{1}\)La ley de múltiples proporciones
Se analiza una muestra del compuesto A (un gas transparente e incoloro) y se encuentra que contiene 4.27 g de carbono y 5.69 g de oxígeno. Se analiza una muestra del compuesto B (también un gas transparente e incoloro) y se encuentra que contiene 5.19 g de carbono y 13.84 g de oxígeno. ¿Son estos datos un ejemplo de la ley de proporciones definidas, la ley de proporciones múltiples, o ninguna de las dos? ¿Qué le dicen estos datos sobre las sustancias A y B?
Solución
En el compuesto A, la relación másica de carbono a oxígeno es:
\[\mathrm{\dfrac{1.33\: g\: O}{1\: g\: C}} \nonumber \]
En el compuesto B, la relación másica de carbono a oxígeno es:
\[\mathrm{\dfrac{2.67\: g\: O}{1\: g\: C}} \nonumber \]
La relación de estas proporciones es:
\[\mathrm{\dfrac{\dfrac{1.33\: g\: O}{1\: g\: C}}{\dfrac{2.67\: g\: O}{1\: g\: C}}=\dfrac{1}{2}} \nonumber \]
Esto apoya la ley de múltiples proporciones. Esto significa que A y B son compuestos diferentes, teniendo A la mitad de carbono por cantidad de oxígeno (o el doble de oxígeno por cantidad de carbono) que B. Un posible par de compuestos que encajarían en esta relación sería A = CO 2 y B = CO.
Se analiza una muestra del compuesto X (un líquido combustible transparente, incoloro, con un olor notable) y se encuentra que contiene 14.13 g de carbono y 2.96 g de hidrógeno. Se analiza una muestra del compuesto Y (un líquido combustible transparente, incoloro, con un olor notable que es ligeramente diferente del olor de X) y se encuentra que contiene 19.91 g de carbono y 3.34 g de hidrógeno. ¿Son estos datos un ejemplo de la ley de proporciones definidas, la ley de proporciones múltiples, o ninguna de las dos? ¿Qué le dicen estos datos sobre las sustancias X e Y?
- Contestar
-
En el compuesto X, la relación másica de carbono a hidrógeno es\(\mathrm{\dfrac{14.13\: g\: C}{2.96\: g\: H}}\).
En el compuesto Y, la relación másica de carbono a hidrógeno es\(\mathrm{\dfrac{19.91\: g\: C}{3.34\: g\: H}}\).
La relación de estas proporciones es
\[\mathrm{\dfrac{\dfrac{14.13\: g\: C}{2.96\: g\: H}}{\dfrac{19.91\: g\: C}{3.34\: g\: H}}=\dfrac{4.77\: g\: C/g\: H}{5.96\: g\: C/g\: H}=0.800=\dfrac{4}{5}}. \nonumber \]
Esta pequeña proporción de números enteros apoya la ley de proporciones múltiples. Esto significa que X e Y son compuestos diferentes.
La evidencia de los átomos es tan grande que pocos dudan de su existencia. De hecho, los átomos individuales ahora se observan rutinariamente con tecnologías de última generación. Además, incluso se pueden utilizar para hacer imágenes bonitas o, como demuestra la investigación de IBM en Video\(\PageIndex{1}\), el control de átomos individuales se puede utilizar para crear animaciones.
Video\(\PageIndex{1}\): Un niño y su átomo: la película más pequeña del mundo
A Boy and His Atom es un cortometraje animado stop-motion del 2012 lanzado por IBM Research. La película cuenta la historia de un niño y un átomo descarriado que se encuentran y se hacen amigos. Representa a un niño jugando con un átomo que toma diversas formas. Se hizo moviendo moléculas de monóxido de carbono vistas con un microscopio de túnel de barrido, un dispositivo que las magnifica 100 millones de veces. Estas moléculas se movieron para crear imágenes, las cuales luego se guardaron como fotogramas individuales para hacer la película.
Resumen
- La Teoría Atómica de Dalton es la primera teoría científica que relaciona los cambios químicos con la estructura, las propiedades y el comportamiento del átomo. Los principios generales de esta teoría fueron los siguientes:
- Toda la materia está compuesta por partículas extremadamente pequeñas llamadas átomos.
- Los átomos de un elemento dado son idénticos en tamaño, masa y otras propiedades. Los átomos de diferentes elementos difieren en tamaño, masa y otras propiedades.
- Los átomos no pueden ser subdivididos, creados o destruidos.
- Los átomos de diferentes elementos pueden combinarse en proporciones simples de números enteros para formar compuestos químicos.
- La ley de proporciones múltiples establece que siempre que los mismos dos elementos formen más de un compuesto, las diferentes masas de un elemento que se combinan con la misma masa del otro elemento están en la proporción de números enteros pequeños.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Henry Agnew (UC Davis)
- TextMap: Chemistry - The Central Science (Brown et al.)
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).

