4.4: Uso de símbolos de Lewis para compuestos iónicos
- Page ID
- 72293
- Declarar la regla del octeto.
- Definir cationes y aniones.
- Definir enlace iónico.
- Dibuje estructuras de Lewis para compuestos iónicos.
La regla del octeto: El impulso para los ocho
La regla del octeto se refiere a la tendencia de los átomos a preferir tener ocho electrones en la capa de valencia. Cuando los átomos tienen menos de ocho electrones, tienden a reaccionar y formar compuestos más estables. Al discutir la regla del octeto, no consideramos electrones d o f. Solo los electrones s y p están involucrados en la regla del octeto, lo que la hace útil para los elementos del grupo principal (elementos que no están en los bloques de metal de transición o metales de transición internos); un octeto en estos átomos corresponde a una configuración electrónica que termina con\(s^2p^6\).
Los gases nobles rara vez forman compuestos. Tienen la configuración más estable (octeto completo, sin cargo), por lo que no tienen ninguna razón para reaccionar y cambiar su configuración. Todos los demás elementos intentan ganar, perder o compartir electrones para lograr una configuración de gas noble.
La mayoría de los átomos no tienen ocho electrones en su capa de electrones de valencia. Algunos átomos tienen sólo unos pocos electrones en su capa exterior, mientras que algunos átomos carecen sólo de uno o dos electrones para tener un octeto. En los casos en que un átomo tenga tres o menos electrones de valencia, el átomo puede perder esos electrones de valencia con bastante facilidad hasta que lo que queda es una capa inferior que contiene un octeto. Los átomos que pierden electrones adquieren una carga positiva como resultado porque quedan con menos electrones cargados negativamente para equilibrar las cargas positivas de los protones en el núcleo. Los iones cargados positivamente se llaman cationes. La mayoría de los metales se convierten en cationes cuando producen compuestos iónicos.
Cationes
Es probable que un átomo de sodio neutro logre un octeto en su caparazón más externo al perder su único electrón de valencia.
\[\ce{Na \rightarrow Na^{+} + e^{-}} \nonumber \]
El catión producido de esta manera, Na +, se denomina ion sodio para distinguirlo del elemento. La capa más externa del ion sodio es la segunda capa de electrones, que tiene ocho electrones en ella. Se ha satisfecho la regla del octeto. F
Aniones
Algunos átomos tienen casi ocho electrones en su caparazón de valencia y pueden ganar electrones de valencia adicionales hasta que tengan un octeto. Cuando estos átomos ganan electrones, adquieren una carga negativa porque ahora poseen más electrones que protones. Los iones cargados negativamente se llaman aniones. La mayoría de los no metales se convierten en aniones cuando producen compuestos iónicos.
Un átomo de cloro neutro tiene siete electrones en su caparazón más exterior. Solo se necesita un electrón más para lograr un octeto en la capa de valencia de cloro. (En la sal de mesa, este electrón proviene del átomo de sodio.)
\[\ce{e^{-} +Cl -> Cl^{-}} \nonumber \]
En este caso, el ion tiene la misma cáscara más externa que el átomo original, pero ahora esa concha tiene ocho electrones en ella. Una vez más, se ha satisfecho la regla del octeto. El anión resultante, Cl −, se llama ion cloruro; tenga en cuenta el ligero cambio en el sufijo (- ide en lugar de - ine) para crear el nombre de este anión.
Los nombres de los iones positivos y negativos son pronunciados Cat-eye-ons y Ann-eye-ons, respectivamente.
Obsérvese la utilidad de la tabla periódica para predecir la formación y carga probables de iones (Figura\(\PageIndex{1}\)). Al pasar del extremo izquierdo a la derecha en la tabla periódica, los elementos del grupo principal tienden a formar cationes con una carga igual al número de grupo. Es decir, los elementos del grupo 1 forman 1+ iones; los elementos del grupo 2 forman 2+ iones, y así sucesivamente. Al pasar del extremo derecho a la izquierda en la tabla periódica, los elementos suelen formar aniones con una carga negativa igual al número de grupos movidos a la izquierda de los gases nobles. Por ejemplo, los elementos del grupo 17 (un grupo a la izquierda de los gases nobles) forman iones 1−; los elementos del grupo 16 (dos grupos a la izquierda) forman iones 2−, y así sucesivamente. Esta tendencia puede ser utilizada como guía en muchos casos, pero su valor predictivo disminuye cuando se mueve hacia el centro de la tabla periódica. De hecho, los metales de transición y algunos otros metales a menudo presentan cargas variables que no son predecibles por su ubicación en la tabla. Por ejemplo, el cobre puede formar iones con una carga 1+ o 2+, y el hierro puede formar iones con una carga 2+ o 3+.
Símbolos de Lewis para compuestos iónicos
En la sección anterior, vimos cómo se forman los iones perdiendo electrones para hacer cationes o ganando electrones para formar aniones. El lector astuto puede haber notado algo: Muchos de los iones que se forman tienen ocho electrones en su caparazón de valencia. O bien los átomos ganan suficientes electrones para tener ocho electrones en la capa de valencia y convertirse en el anión apropiadamente cargado, o pierden los electrones en su caparazón de valencia original; la capa inferior, ahora la capa de valencia, tiene ocho electrones en ella, por lo que el átomo se carga positivamente. Por cualquier razón, tener ocho electrones en una capa de valencia es una disposición particularmente energéticamente estable de electrones. Cuando los átomos forman compuestos, la regla del octeto no siempre se satisface para todos los átomos en todo momento, pero es una muy buena regla general para comprender los tipos de arreglos de unión que los átomos pueden hacer.
No es imposible violar la regla del octeto. Considera el litio: en su forma elemental, tiene un electrón de valencia y es estable. Es bastante reactivo, sin embargo, y no requiere mucha energía para eliminar ese electrón para hacer el ion Li +. Podríamos eliminar otro electrón añadiendo aún más energía al ion, para hacer el ion Li 2 +. Sin embargo, eso requiere mucha más energía de la que normalmente está disponible en las reacciones químicas, por lo que el sodio se detiene a una carga 1+ después de perder un solo electrón. Resulta que el ion Li + tiene un octeto completo en su nueva concha de valencia, la concha n = 2, que satisface la regla del octeto. La regla del octeto es resultado de las tendencias en las energías y es útil para explicar por qué los átomos forman los iones que hacen.
Consideremos ahora un átomo de Li en presencia de un átomo de Cl. Los dos átomos tienen estos diagramas de puntos electrónicos de Lewis y configuraciones de electrones:
\[\mathbf{Li\, \cdot }\; \; \; \; \; \; \; \; \; \; \mathbf{\cdot }\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :} \nonumber \]
\[\left [ Ne \right ]3s^{1}\; \; \; \; \left [ Ne \right ]3s^{2}3p^{5} \nonumber \]
Para que el átomo de Li obtenga un octeto, debe perder un electrón; para que el átomo de Cl gane un octeto, debe ganar un electrón. Un electrón se transfiere del átomo de Na al átomo de Cl:
\[\mathbf{Li\, \cdot }\curvearrowright \mathbf{\cdot }\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :} \nonumber \]
dando como resultado dos iones, el ion Na + y el ion Cl −:
\[\mathbf{Li\, \cdot }^{+}\; \; \; \; \; \; \; \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}^{-} \nonumber \]
\[\left [ Ne \right ]\; \; \; \; \; \left [ Ne \right ]3s^{2}3p^{6} \nonumber \]
Ambas especies ahora tienen octetos completos, y las conchas de electrones son energéticamente estables. A partir de la física básica, sabemos que las cargas opuestas atraen. Esto es lo que sucede con los iones Na + y Cl −:
\[\mathbf{Li\, \cdot }^{+}\; + \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}^{-}\rightarrow Na^{+}Cl^{-}\; \; or\; \; NaCl \nonumber \]
donde hemos escrito la fórmula final (la fórmula para el cloruro de sodio) según la convención para compuestos iónicos, sin enumerar explícitamente las cargas. La atracción entre los iones con carga contraria se llama enlace iónico, y es uno de los principales tipos de enlaces químicos en la química. Los enlaces iónicos son causados por electrones que se transfieren de un átomo a otro.
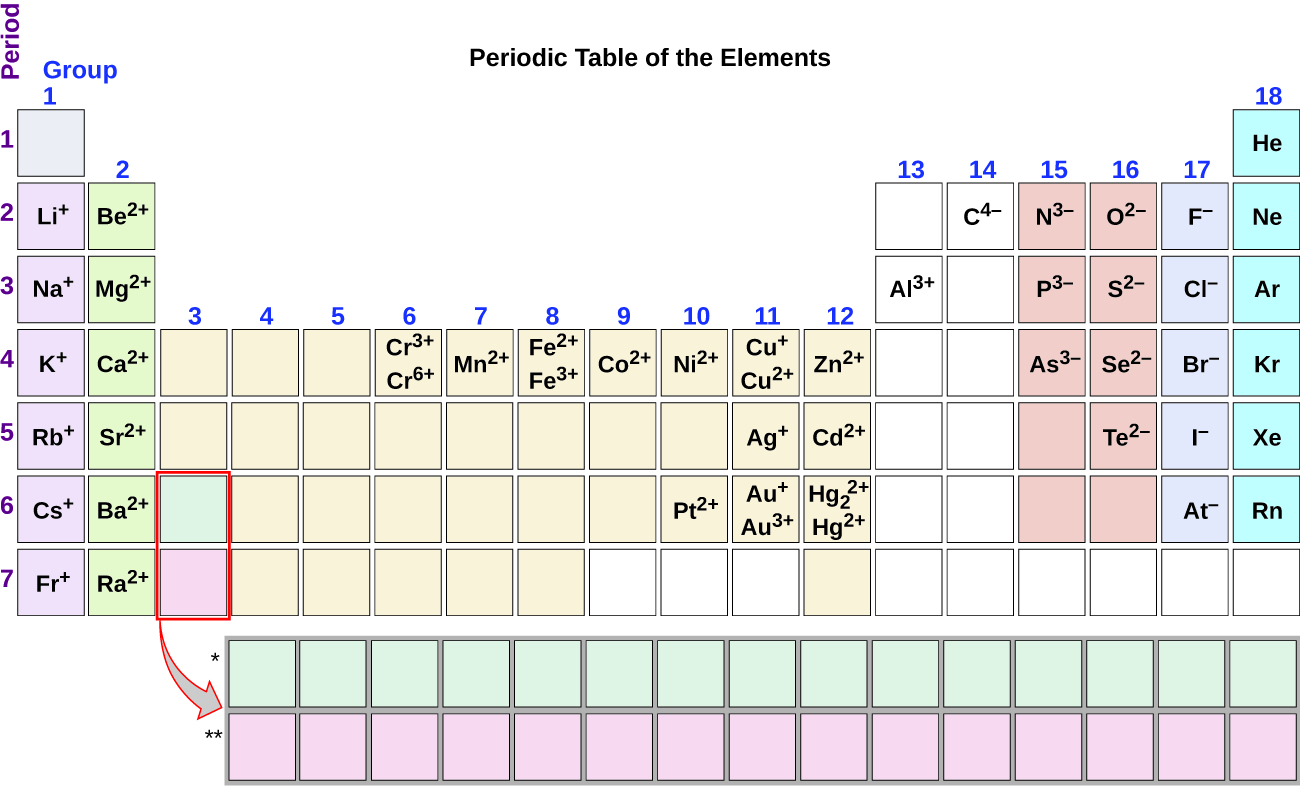
En la transferencia de electrones, el número de electrones perdidos debe ser igual al número de electrones ganados. Esto lo vimos en la formación de NaCl. Un proceso similar ocurre entre los átomos de Mg y los átomos de O, excepto en este caso se transfieren dos electrones:
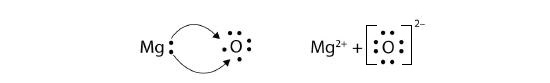
Cada uno de los dos iones tiene octetos como su capa de valencia, y las dos partículas con carga contraria se atraen, formando un enlace iónico:
\[\mathbf{Mg\,}^{2+}\; + \; \left[\mathbf{:}\mathbf{\ddot{\underset{.\: .}O}}\mathbf{\: :}\right]^{2-}\; \; \; \; \; Mg^{2+}O^{2-}\; or\; MgO \nonumber \]
Recuerda, en la fórmula final para el compuesto iónico, no escribimos las cargas sobre los iones.
¿Qué pasa cuando un átomo de Na interactúa con un átomo de O? El átomo de O necesita dos electrones para completar su octeto de valencia, pero el átomo de Na suministra solo un electrón:
\[\mathbf{Na\, \cdot }\curvearrowright \mathbf{\cdot }\mathbf{\ddot{\underset{.}O}}\mathbf{\: :} \nonumber \]
El átomo O todavía no tiene un octeto de electrones. Lo que necesitamos es un segundo átomo de Na para donar un segundo electrón al átomo de O:
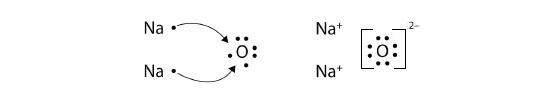
Estos tres iones se atraen entre sí para dar un compuesto iónico de carga neutra global, que escribimos como Na 2 O. La necesidad de que el número de electrones perdidos sea igual al número de electrones obtenidos explica por qué los compuestos iónicos tienen la relación de cationes a aniones que hacen. Esto también lo exige la ley de conservación de la materia.
Con flechas, ilustran la transferencia de electrones para formar cloruro de calcio a partir de\(Ca\) átomos y\(Cl\) átomos.
Solución
Un\(Ca\) átomo tiene dos electrones de valencia, mientras que un\(Cl\) átomo tiene siete electrones. Un\(Cl\) átomo solo necesita uno más para completar su octeto, mientras que los\(Ca\) átomos tienen dos electrones que perder. Así necesitamos dos átomos de Cl para aceptar los dos electrones de un\(Ca\) átomo. El proceso de transferencia se ve de la siguiente manera:
Los iones con carga contraria se atraen entre sí para hacer CaCl 2.
Encuentra la fórmula del compuesto iónico formado a partir de O y Al.
Solución: Primero escribimos diagramas de Lewis para cada átomo involucrado:
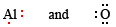
Ahora vemos que cada átomo O necesita 2 electrones para formar un octeto, mientras que cada átomo de Al tiene 3 electrones para donar. Para que se donara el mismo número de electrones como se acepta, necesitamos 2 átomos de Al (2 × 3 e — donados) y 3 átomos de O (3 × 2 e — aceptados). Todo el proceso es entonces
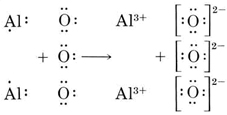
El óxido resultante consiste en iones aluminio, Al 3 +, e iones óxido, O 2—, en la proporción de 2:3. La fórmula es Al 2 O 3.
Con flechas, ilustran la transferencia de electrones para formar sulfuro de potasio a partir de\(K\) átomos y\(S\) átomos.
- Respuesta:
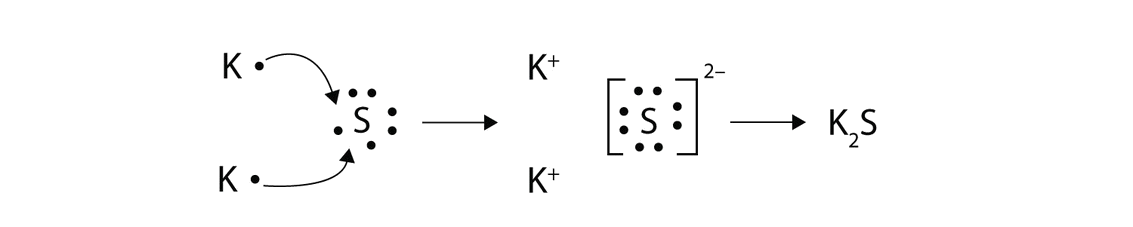
Resumen
- La tendencia a formar especies que tienen ocho electrones en la capa de valencia se llama regla del octeto.
- La atracción de iones con carga opositora causada por la transferencia de electrones se denomina enlace iónico.
- La fuerza del enlace iónico depende de la magnitud de las cargas y los tamaños de los iones.
Colaboradores y Atribuciones
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
Henry Agnew (UC Davis)
- OpenSTAX

