4.5: Fórmulas y nombres de compuestos iónicos binarios
- Page ID
- 72259
- Use las reglas para nombrar compuestos iónicos.
- Escriba la fórmula correcta para un compuesto iónico.
Nombres de compuestos iónicos binarios
Después de conocer algunos detalles más sobre los nombres de los iones individuales, estarás a un paso de saber nombrar compuestos iónicos. En esta sección se inicia el estudio formal de la nomenclatura, la nomenclatura sistemática de compuestos químicos.
Nombrar iones
El nombre de un catión monoatómico es simplemente el nombre del elemento seguido de la palabra ion. Así, Na + es el ion sodio, Al 3 + es el ion aluminio, Ca 2 + es el ion calcio, y así sucesivamente.
Hemos visto que algunos elementos pierden diferentes números de electrones, produciendo iones de diferentes cargas (Figura 4.4.1). El hierro, por ejemplo, puede formar dos cationes, cada uno de los cuales, cuando se combina con el mismo anión, hace un compuesto diferente con propiedades físicas y químicas únicas. Así, necesitamos un nombre diferente para cada ion hierro para distinguir Fe 2 + de Fe 3 +. El mismo problema surge para otros iones con más de una posible carga.
Hay dos formas de hacer esta distinción. En el enfoque más simple y moderno, llamado Sistema Stock (Tabla\(\PageIndex{1}\)), la carga positiva de un ion se indica con un número romano entre paréntesis después del nombre del elemento, seguido de la palabra ion. Así, Fe 2 + se llama el ion hierro (II), mientras que Fe 3 + se llama el ion hierro (III). Este sistema se utiliza únicamente para elementos que forman más de un ion positivo común. No llamamos al ion Na + el ion sodio (I) porque (I) es innecesario. El sodio forma solo un ion 1+, por lo que no hay ambigüedad sobre el nombre ion sodio.
| Element | Vástago | Cargar |
Nombre moderno (Sistema de Stock) |
Nombre común |
|---|---|---|---|---|
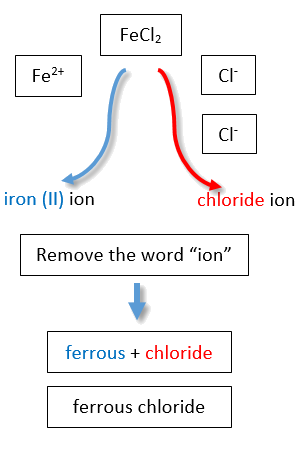
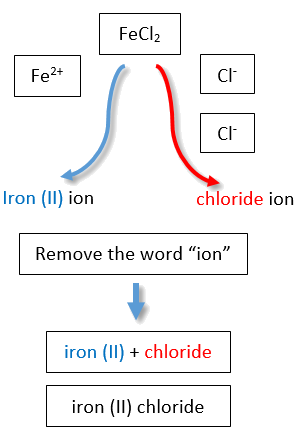
| hierro | ferr- | 2+ | ion de hierro (II) | iones ferrosos |
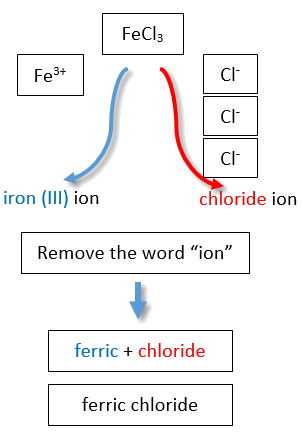
| 3+ | ion de hierro (III) | ión férrico | ||
| cobre | cupr- | 1+ | ion cobre (I) | ion cuproso |
| 2+ | ion cobre (II) | ion cúprico | ||
| hojalata | stann- | 2+ | ion de estaño (II) | ion estannoso |
| 4+ | ion de estaño (IV) | ion estánnico | ||
| plomo | plomada | 2+ | ion plomo (II) | ion plomoso |
| 4+ | ion de plomo (IV) | ion plombiano | ||
| cromo | chrom- | 2+ | ion cromo (II) | ión cromático |
| 3+ | ión de cromo (III) | ión crómico | ||
| oro | aur- | 1+ | ión de oro (I) | ion auroso |
| 3+ | ión de oro (III) | ión áurico |
El segundo sistema, llamado sistema común, no es convencional sino que sigue siendo prevalente y utilizado en las ciencias de la salud. Este sistema reconoce que muchos metales tienen dos cationes comunes. El sistema común utiliza dos sufijos (- ic y - ous) que se anexan a la raíz del nombre del elemento. El sufijo -ic representa la mayor de las dos cargas catiónicas, y el sufijo -ous representa la inferior. En muchos casos, el tallo del nombre del elemento proviene del nombre latino del elemento. Tabla\(\PageIndex{1}\) enumera los elementos que utilizan el sistema común, junto con sus respectivos nombres catiónicos.
| Ion | Nombre |
|---|---|
| F − | ion fluoruro |
| Cl − | ión cloruro |
| Br − | ión bromuro |
| I - | ión yoduro |
| O 2− | ión óxido |
| S 2− | ion sulfuro |
| P 3− | ion fosfuro |
| N 3− | ión nitruro |
El nombre de un anión monoatómico consiste en el tallo del nombre del elemento, el sufijo - ide, y luego la palabra ion. Así, como ya hemos visto, Cl − es “clor-” + “ión -ide”, o el ion cloruro. Del mismo modo, O 2− es el ion óxido, Se 2 − es el ion seleniuro, y así sucesivamente. En la\(\PageIndex{2}\) tabla se enumeran los nombres de algunos iones monoatómicos comunes.
Nombra cada ion.
- Ca 2 +
- S 2−
- Cu +
Solución
- el ion calcio
- el ion sulfuro
- el ion cobre (I) o el ion cuproso
Nombra cada ion.
- Fe 2 +
- Fe 3 +
- Ba 2 +
- Respuesta a:
- ion de hierro (II)
- Respuesta b:
- ion de hierro (III)
- Respuesta c:
- ión de bario
Escribe la fórmula para cada ion.
- el ion bromuro
- el ion cúprico
- el ion magnesio
Solución
- Br −
- Cu 2 +
- Mg 2 +
Escribe la fórmula para cada ion.
- el ion fluoruro
- el ion estañoso
- el ion potasio
- Respuesta a:
- F -
- Respuesta b:
- Sn 2+
- Respuesta c:
- K +
Nombrar compuestos iónicos binarios con un metal que forma solo un tipo de catión
Ahora que sabemos nombrar iones, estamos listos para nombrar compuestos iónicos. Un compuesto iónico binario es un compuesto compuesto por un catión metálico monoatómico y un anión monatómico no metálico. El catión metálico se nombra primero, seguido del anión no metálico como se ilustra en la Figura\(\PageIndex{1}\) para el compuesto BaCl 2. La palabra ion se cae de ambas partes.
Los subíndices en la fórmula no afectan el nombre.
Nombra cada compuesto iónico.
- CaCl 2
- AlF 3
- KCl
Solución
- Usando los nombres de los iones, este compuesto iónico se denomina cloruro de calcio.
- El nombre de este compuesto iónico es fluoruro de aluminio.
- El nombre de este compuesto iónico es cloruro de potasio
Nombra cada compuesto iónico.
- AGi
- MgO
- Ca 3 P 2
- Respuesta a:
- yoduro de plata
- Respuesta b:
- óxido de magnesio
- Respuesta c:
- fosfuro de calcio
Nombrar compuestos iónicos binarios con un metal que forma más de un tipo de catión
Si se le da una fórmula para un compuesto iónico cuyo catión puede tener más de una posible carga, primero debe determinar la carga en el catión antes de identificar su nombre correcto. Por ejemplo, considere FeCl 2 y FeCl 3. En el primer compuesto, el ion hierro tiene una carga 2+ porque hay dos iones Cl − en la fórmula (1− carga en cada ion cloruro). En el segundo compuesto, el ion hierro tiene una carga 3+, como lo indican los tres iones Cl − en la fórmula. Se trata de dos compuestos diferentes que necesitan dos nombres diferentes. Por el sistema Stock, los nombres son cloruro de hierro (II) y cloruro de hierro (III) (Figura\(\PageIndex{2}\)).
| Nombre del catión (metal) + (número romano entre paréntesis) + Nombre base del anión (no metálico) y -ide | |
|---|---|
 |
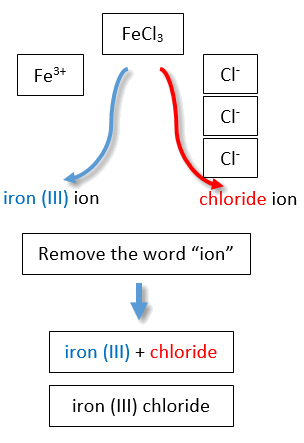 |
Si usáramos los tallos y sufijos del sistema común, los nombres serían cloruro ferroso y cloruro férrico, respectivamente (Figura\(\PageIndex{3}\)).
| Nombre base “antiguo” del catión (metal) y -ic o -ous + Nombre base del anión (no metálico) y -ide | |
|---|---|
|
-ous (para iones con menor carga)
|
-ic (para iones con mayor carga)
|
Nombra cada compuesto iónico.
- Co 2 O 3
- FeCl 2
Solución
| Compuesto iónico | Explicación | Contestar |
|---|---|---|
| Co 2 O 3 |
Sabemos que el cobalto puede tener más de una posible carga; solo necesitamos determinar qué es.
|
óxido de cobalto (III) |
| FeCl 2 |
El hierro también puede tener más de una carga posible.
|
cloruro de hierro (II) |
Nombra cada compuesto iónico.
- AUCl 3
- PbO 2
- CuO
- Respuesta a:
- cloruro de oro (III)
- Respuesta b:
- óxido de plomo (IV)
- Respuesta c:
- óxido de cobre (II)
La figura\(\PageIndex{4}\) es una sinopsis de cómo nombrar compuestos iónicos simples.

Nombra cada compuesto iónico.
- ZnBr 2
- Al 2 O 3
- AuF 3
- AgF
- Respuesta a:
- bromuro de zinc
- Respuesta b:
- óxido de aluminio
- Respuesta c:
- fluoruro de oro (III) o fluoruro áurico
- Respuesta d:
- fluoruro de plata
Escribir fórmulas de compuestos iónicos
Los compuestos iónicos no existen como moléculas. En estado sólido, los compuestos iónicos se encuentran en una red cristalina que contiene muchos iones cada uno del catión y anión. Una fórmula iónica, como\(\ce{NaCl}\), es una fórmula empírica. Esta fórmula simplemente indica que el cloruro de sodio está hecho de un número igual de iones sodio y cloruro. El sulfuro de sodio, otro compuesto iónico, tiene la fórmula\(\ce{Na_2S}\). Esta fórmula indica que este compuesto está compuesto por el doble de iones sodio que iones sulfuro. Esta sección te enseñará cómo encontrar la proporción correcta de iones, para que puedas escribir una fórmula correcta.
Si conoces el nombre de un compuesto iónico binario, puedes escribir su fórmula química. Comience escribiendo el ion metálico con su carga, seguido del ion no metálico con su carga. Debido a que el compuesto general debe ser eléctricamente neutro, decida cuántos de cada ion se necesita para que la carga positiva y negativa se cancelen entre sí.
Escriba la fórmula para nitruro de aluminio y óxido de litio.
Solución
| Pasos para la resolución de problemas | Escribe la fórmula para nitruro de aluminio | Escribe la fórmula para el óxido de litio |
|---|---|---|
| 1. Escriba primero el símbolo y la carga del catión (metal) y el anión (no metálico) en segundo lugar. | \(\ce{Al^{3+}} \: \: \: \: \: \ce{N^{3-}}\) | \(\ce{Li^+} \: \: \: \: \: \ce{O^{2-}}\) |
| 2. Usa un multiplicador para hacer que la carga total de los cationes y aniones sea igual entre sí. |
carga total de cationes = carga total de aniones 1 (3+) = 1 (3-) +3 = -3 |
carga total de cationes = carga total de aniones 2 (1+) = 1 (2-) +2 = -2 |
| 3. Utilice los multiplicadores como subíndice para cada ion. | \(\ce{Al_1N_1}\) | \(\ce{Li_2O_1}\) |
| 4. Escribe la fórmula final. Dejar fuera todos los cargos y todos los subíndices que sean 1. | \(\ce{AlN}\) | \(\ce{Li_2O}\) |
Una forma alternativa de escribir una fórmula correcta para un compuesto iónico es usar el método entrecruzado. En este método, se cruza el valor numérico de cada una de las cargas iónicas para convertirse en el subíndice del otro ión. Se retiran las señales de los cargos.
Escriba la fórmula para el óxido de plomo (IV).
Solución
| Método entrecruzado | Ejemplo: Escribir la fórmula para el óxido de plomo (IV) |
|---|---|
| 1. Escriba primero el símbolo y la carga del catión (metal) y el anión (no metálico) en segundo lugar. | \(\ce{Pb^{4+}} \: \: \: \: \: \ce{O^{2-}}\) |
| 2. Transpone solo el número de la carga positiva para convertirse en el subíndice del anión y el número solo de la carga negativa para convertirse en el subíndice del catión. | 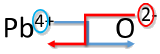 |
| 3. Reducir a la relación más baja. | \(\ce{Pb_2O_4}\) |
| 4. Escribe la fórmula final. Dejar fuera todos los subíndices que sean 1. | \(\ce{PbO_2}\) |
Escriba la fórmula química para un compuesto iónico compuesto por cada par de iones.
- el ion calcio y el ion oxígeno
- el ion cobre 2+ y el ion azufre
- el ión cobre 1+ y el ion azufre
- Respuesta a:
- CaO
- Respuesta b:
- CU
- Respuesta c:
- Cu 2 S
Tenga en cuenta que los compuestos iónicos son fórmulas empíricas y por lo tanto deben escribirse como la relación más baja de los iones.
Escribe la fórmula para el sodio combinado con azufre.
Solución
| Método entrecruzado | Escribe la fórmula para el sodio combinado con azufre |
|---|---|
| 1. Escriba primero el símbolo y la carga del catión (metal) y el anión (no metálico) en segundo lugar. | \(\ce{Na^{+}} \: \: \: \: \: \ce{S^{2-}}\) |
| 2. Transpone solo el número de la carga positiva para convertirse en el subíndice del anión y el número solo de la carga negativa para convertirse en el subíndice del catión. | 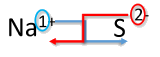 |
| 3. Reducir a la relación más baja. | Este paso no es necesario. |
| 4. Escribe la fórmula final. Dejar fuera todos los subíndices que sean 1. | \(\ce{Na_2S}\) |
Escribe la fórmula para cada compuesto iónico.
- bromuro de sodio
- cloruro de litio
- óxido de magnesio
- Respuesta a:
- NaBr
- Respuesta b:
- LiCl
- Respuesta c:
- MgO
Reconocer compuestos iónicos
Hay dos formas de reconocer compuestos iónicos. En primer lugar, los compuestos entre elementos metálicos y no metálicos suelen ser iónicos. Por ejemplo, CaBr 2 contiene un elemento metálico (calcio, un metal del grupo 2 (o 2A)) y un elemento no metálico (bromo, un grupo 17 (o 7A) no metálico). Por lo tanto, lo más probable es que sea un compuesto iónico. (De hecho, es iónico.) En contraste, el compuesto NO 2 contiene dos elementos que son ambos no metales (nitrógeno, del grupo 15 (o 5A), y oxígeno, del grupo 16 (o 6A). No es un compuesto iónico; pertenece a la categoría de compuestos covalentes discutidos en otra parte. También tenga en cuenta que esta combinación de nitrógeno y oxígeno no tiene ninguna carga eléctrica especificada, por lo que no es el ion nitrito.
Segundo, si reconoces la fórmula de un ion poliatómico en un compuesto, el compuesto es iónico. Por ejemplo, si ve la fórmula Ba (NO 3) 2, puede reconocer la parte “NO 3” como el ion nitrato, NO 3 −. (Recuerde que la convención para escribir fórmulas para compuestos iónicos es no incluir la carga iónica). Esto es una pista de que la otra parte de la fórmula, Ba, es en realidad el ion Ba 2 +, con la carga 2+ equilibrando la carga total de 2− de los dos iones nitrato. Así, este compuesto también es iónico.
Identificar cada compuesto como iónico o no iónico.
- Na 2 O
- PCl 3
- DE 2
Solución
| Explicación | Contestar |
|---|---|
| a. El sodio es un metal y el oxígeno es un no metal. Por lo tanto, se espera que Na 2 O sea iónico. | \(Na_2O\), iónico |
| b. Tanto el fósforo como el cloro son no metales. Por lo tanto, el PCl 3 no es iónico. | \(PCl_3\), no iónico |
| c. Tanto el oxígeno como el flúor son no metales. Por lo tanto, el DE 2 no es iónico. | \(OF_2\), iónico |
Identificar cada compuesto como iónico o no iónico.
- N 2 O
- FeCl 3
- Respuesta a:
- no iónico
- Respuesta b:
- iónico
Resumen
- Los compuestos iónicos se nombran indicando primero el catión, seguido del anión.
- Los cargos positivos y negativos deben balancearse.
- Algunos aniones tienen múltiples formas y se nombran en consecuencia con el uso de números romanos entre paréntesis.
- Las fórmulas para compuestos iónicos contienen los símbolos y el número de cada átomo presente en un compuesto en la relación de número entero más baja.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Henry Agnew (UC Davis)