4.6: Enlaces covalentes - Pares de electrones compartidos
- Page ID
- 72280
- Definir enlace covalente.
- Ilustrar la formación de enlaces covalentes con diagramas de puntos electrónicos de Lewis.
La unión iónica suele ocurrir cuando es fácil que un átomo pierda uno o más electrones y otro átomo gane uno o más electrones. Sin embargo, algunos átomos no se rendirán ni ganarán electrones fácilmente. Sin embargo, siguen participando en la formación de compuestos. ¿Cómo? Existe otro mecanismo para obtener un caparazón de valencia completo: compartir electrones. Cuando los electrones se comparten entre dos átomos, forman un enlace llamado enlace covalente.
Los químicos suelen utilizar diagramas de Lewis para representar enlaces covalentes en sustancias moleculares. Por ejemplo, los diagramas de Lewis de dos átomos de hidrógeno separados son los siguientes:

El diagrama de Lewis de dos átomos de hidrógeno que comparten electrones se ve así:

Podemos usar círculos para mostrar que cada átomo H tiene dos electrones alrededor del núcleo, llenando completamente la capa de valencia de cada átomo:
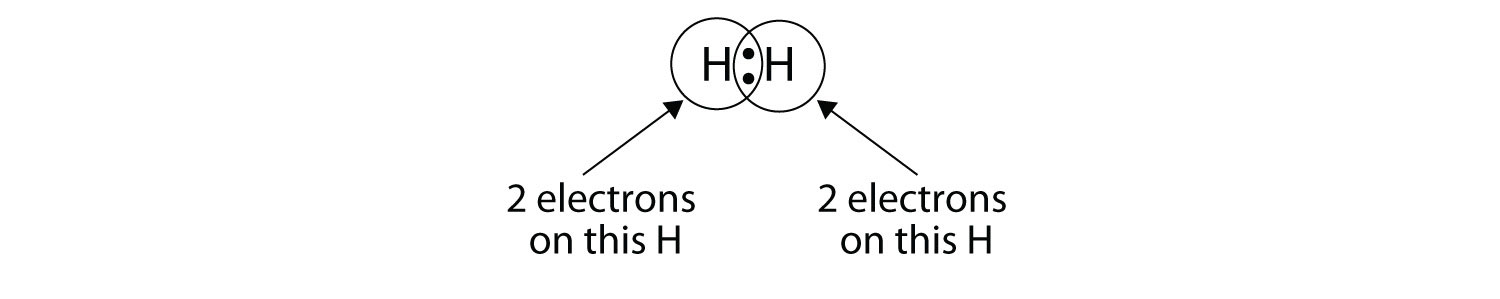
Debido a que cada átomo de H tiene una capa de valencia llena, este enlace es estable, y hemos hecho una molécula de hidrógeno diatómico. (Esto explica por qué el hidrógeno es uno de los elementos diatómicos). Por simplicidad, no es raro representar el enlace covalente con un guión, en lugar de con dos puntos:
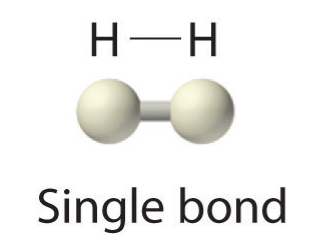
Debido a que dos átomos comparten un par de electrones, este enlace covalente se denomina enlace sencillo. Como otro ejemplo, considere el flúor. Los átomos F tienen siete electrones en su caparazón de valencia:
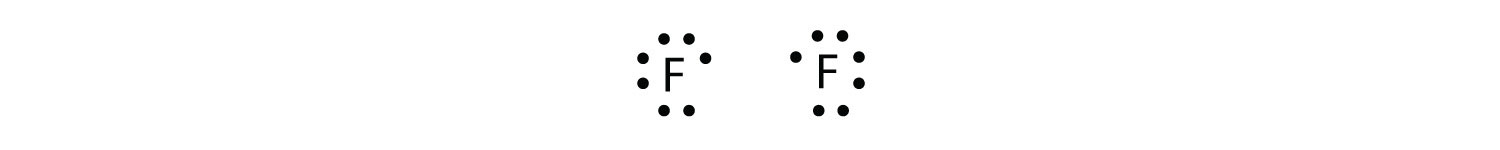
Estos dos átomos pueden hacer lo mismo que hicieron los átomos de H; comparten sus electrones desapareados para hacer un enlace covalente.

Tenga en cuenta que cada átomo F tiene un octeto completo a su alrededor ahora:
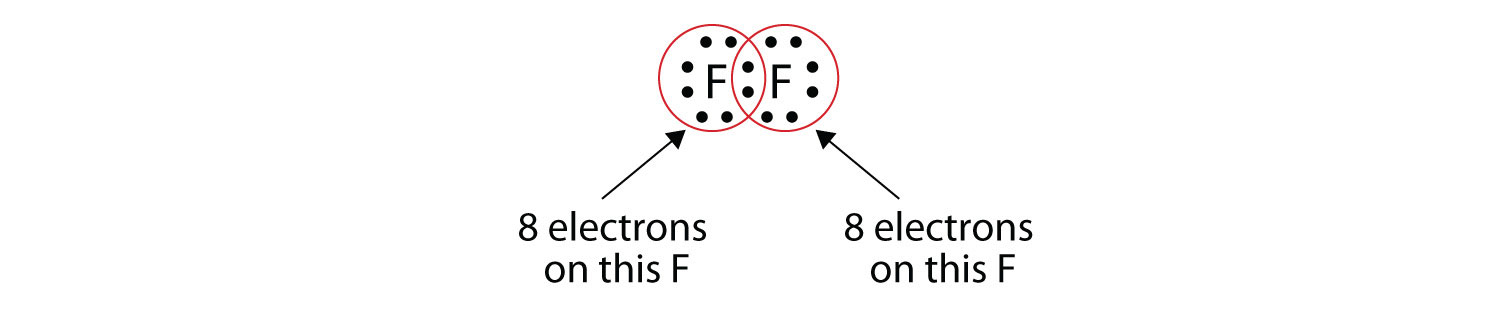
También podemos escribir esto usando un guión para representar el par de electrones compartido:
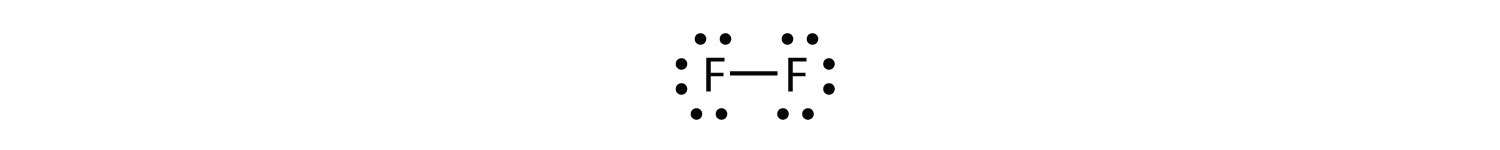
Hay dos tipos diferentes de electrones en la molécula diatómica de flúor. El par de electrones de enlace hace el enlace covalente. Cada átomo F tiene otros tres pares de electrones que no participan en el enlace; se les llama electrones de par solitario. Cada átomo F tiene un par de enlace y tres pares solitarios de electrones.
También se pueden hacer enlaces covalentes entre diferentes elementos. Un ejemplo es HF. Cada átomo comienza con un número impar de electrones en su caparazón de valencia:

Los dos átomos pueden compartir sus electrones desapareados para formar un enlace covalente:

En esta molécula, el átomo de hidrógeno no tiene electrones no enlazantes, mientras que el átomo de flúor tiene seis electrones no enlazantes (tres pares de electrones solitarios). Los círculos muestran cómo se llenan las conchas de electrones de valencia para ambos átomos.
Utilice diagramas de puntos electrónicos de Lewis para ilustrar la formación de enlaces covalentes en HBr.
Solución
HBr es muy similar al HF, excepto que tiene Br en lugar de F. Los átomos son los siguientes:

Los dos átomos pueden compartir su electrón desapareado:

Utilice diagramas de puntos electrónicos de Lewis para ilustrar la formación de enlaces covalentes en Cl 2.
- Respuesta:
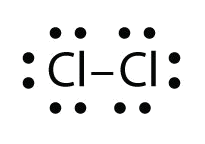
Cuando se trabaja con estructuras covalentes, a veces parece que tienes electrones sobrantes. Aplicas las reglas que aprendiste hasta ahora y todavía hay algunos electrones colgando por ahí desapegados. No puedes simplemente dejarlos ahí. Entonces, ¿dónde los pones?
Múltiples enlaces covalentes
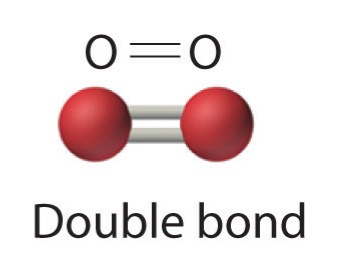
La compartición de un par de electrones representa un solo enlace covalente, generalmente denominado solo enlace sencillo. Sin embargo, en muchas moléculas los átomos alcanzan octetos completos al compartir más de un par de electrones entre ellos:
- Dos pares de electrones comparten un doble enlace
- Tres pares de electrones comparten un triple enlace
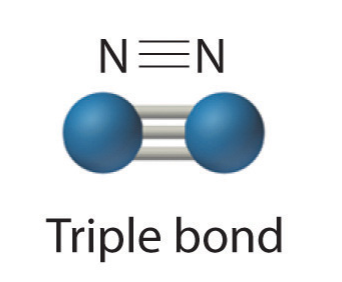
Debido a que cada nitrógeno contiene 5 electrones de valencia, necesitan compartir 3 pares para lograr cada uno un octeto de valencia. El N 2 es bastante inerte, debido al fuerte triple enlace entre los dos átomos de nitrógeno.
Resumen
- Los enlaces covalentes se forman cuando los átomos comparten electrones.
- Se pueden dibujar diagramas de puntos electrónicos de Lewis para ilustrar la formación de enlaces covalentes.
- Pueden ser necesarios dobles enlaces o triples enlaces entre átomos para ilustrar adecuadamente el enlace en algunas moléculas.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- Anonymous
Henry Agnew (UC Davis)

