4.8: Moléculas Poliatómicas- Agua, Amoniaco y Metano
- Page ID
- 72296
- Determinar el número de enlaces formados por elementos no metálicos comunes.
- Ilustrar la formación de enlaces covalentes con diagramas de puntos electrónicos de Lewis.
Más de dos átomos pueden participar en enlaces covalentes, aunque cualquier enlace covalente dado será entre dos átomos solamente. El agua, el amoníaco y el metano son ejemplos comunes que se discutirán en detalle a continuación. El carbono es único en la medida en que forma enlaces simples, dobles y triples a sí mismo y a otros elementos. El número de enlaces formados por un átomo en sus compuestos covalentes no es arbitrario. El hidrógeno, el oxígeno, el nitrógeno y el carbono tienen tendencias muy fuertes a formar sustancias en las que tienen uno, dos, tres y cuatro enlaces con otros átomos, respectivamente (Tabla\(\PageIndex{1}\)).
| Atom | Número de bonos |
|---|---|
| H (grupo 1) | 1 |
| O (grupo 16) | 2 |
| N (grupo 15) | 3 |
| C (grupo 14) | 4 |
Agua
Considere los átomos de H y O:

Los átomos de H y O pueden compartir un electrón para formar un enlace covalente:

El átomo H tiene una capa de valencia completa. Sin embargo, el átomo O solo tiene siete electrones a su alrededor, lo que no es un octeto completo. Arreglamos esto incluyendo un segundo átomo de H, cuyo único electrón hará un segundo enlace covalente con el átomo de O:

(No importa de qué lado se posicione el segundo átomo de H). Ahora el átomo O tiene un octeto completo a su alrededor, y cada átomo H tiene dos electrones, llenando su caparazón de valencia. Es así como se elabora una molécula de agua, H 2 O.
Amoníaco
El átomo de N tiene el siguiente diagrama de puntos de electrones de Lewis:
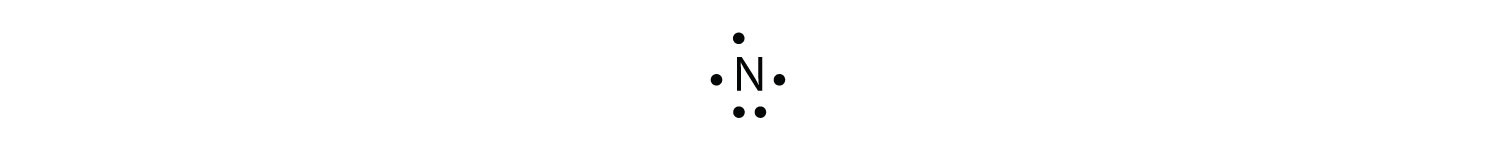
Tiene tres electrones desapareados, cada uno de los cuales puede formar un enlace covalente al compartir electrones con un átomo de H. El diagrama de puntos electrónicos de NH 3 es el siguiente:

Metano
El átomo de C tiene el siguiente diagrama de puntos de electrones de Lewis:

Tiene cuatro electrones desapareados, cada uno de los cuales puede formar un enlace covalente al compartir electrones con un átomo de H. El diagrama de puntos electrónicos de CH 4 es el siguiente:

Resumen
En las moléculas poliatómicas, existe un patrón de enlaces covalentes que pueden formar diferentes átomos.
Colaboradores y Atribuciones
- TextMap: Beginning Chemistry (Ball et al.)

