5.2: Relaciones de volumen en ecuaciones químicas
- Page ID
- 72413
- Identificar el volumen relativo de gas consumido o producido en base a una ecuación química equilibrada para una reacción.
El comportamiento de los gases puede ser representado por leyes de gas como se discutirá con más detalle en el Capítulo 6. La ley de Avogadro establece que todos los gases (que muestran un comportamiento ideal) contienen el mismo número de moléculas en un mismo volumen (a la misma temperatura y presión). Así, las relaciones de volúmenes de gases involucrados en una reacción química vienen dadas por los coeficientes en la ecuación para la reacción, siempre que los volúmenes de gas se midan a la misma temperatura y presión.
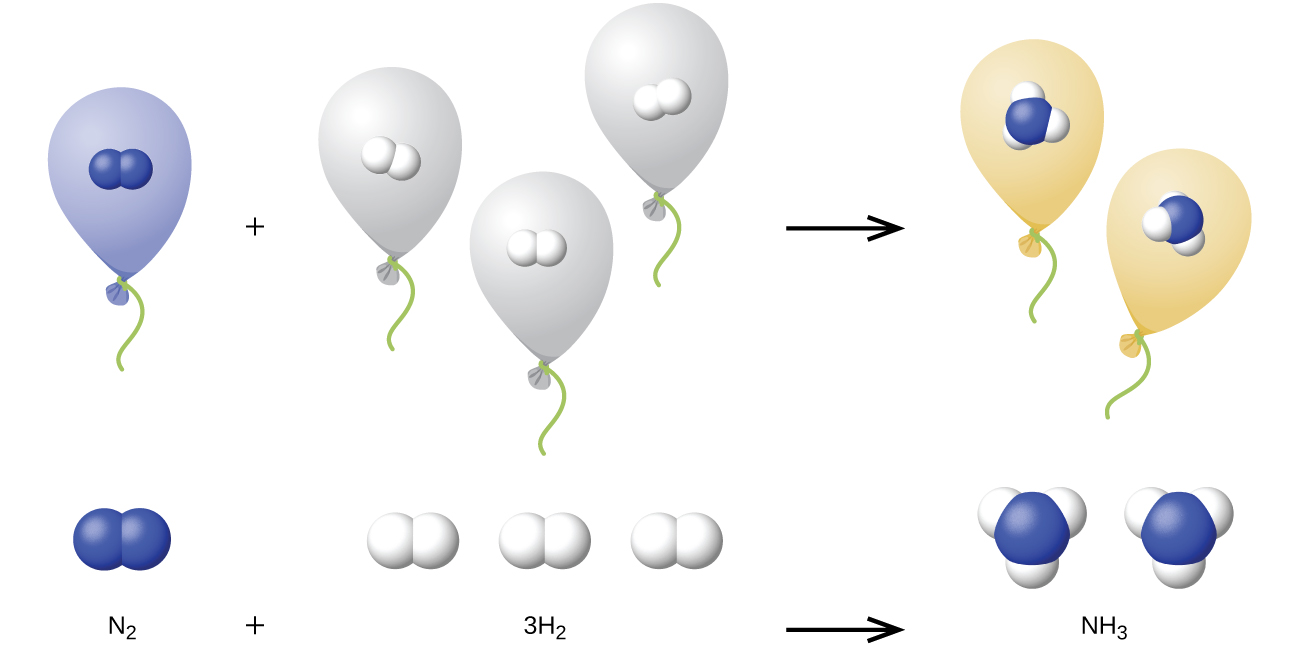
Podemos extender la ley de Avogadro (que el volumen de un gas es directamente proporcional al número de moles del gas) a reacciones químicas con gases: Los gases se combinan, o reaccionan, en proporciones definidas y simples por volumen, siempre que todos los volúmenes de gas se midan a la misma temperatura y presión. Por ejemplo, dado que los gases nitrógeno e hidrógeno reaccionan para producir gas amoníaco de acuerdo con la ecuación balanceada a continuación
\[\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g) \nonumber \]
un volumen dado de gas nitrógeno reacciona con tres veces ese volumen de gas hidrógeno para producir dos veces ese volumen de gas amoníaco, si la presión y la temperatura permanecen constantes.
La explicación de esto se ilustra en la Figura\(\PageIndex{1}\). Según la ley de Avogadro, volúmenes iguales de N 2, H 2 y NH 3 gaseosos, a la misma temperatura y presión, contienen el mismo número de moléculas. Debido a que una molécula de N 2 reacciona con tres moléculas de H 2 para producir dos moléculas de NH 3, el volumen de H 2 requerido es tres veces el volumen de N 2, y el volumen de NH 3 producido es dos veces el volumen de N 2.
El propano, C 3 H 8 (g), se utiliza en parrillas de gas para proporcionar el calor para cocinar. ¿Qué volumen de O 2 (g) medido a 25 °C y 760 torr se requiere para reaccionar con 2.7 L de propano medido en las mismas condiciones de temperatura y presión? Supongamos que el propano se somete a combustión completa.
Solución
La relación de los volúmenes de C 3 H 8 y O 2 será igual a la relación de sus coeficientes en la ecuación equilibrada para la reacción:
&\ ce {C3H8} (g) +\ ce {5O2} (g) ⟶ &&\ ce {3CO2} (g) +\ ce {4H2O} (l)\\
\ ce {&1\: volumen + 5\: volúmenes &&3\: volúmenes + 4\: volúmenes}
\ end {align}\ nonumber\]
De la ecuación, vemos que un volumen de C 3 H 8 reaccionará con cinco volúmenes de O 2:
Se requerirá un volumen de 13.5 L de O 2 para reaccionar con 2.7 L de C 3 H 8.
Un tanque de acetileno para un soplete de oxiacetileno proporciona 9340 L de gas acetileno, C 2 H 2, a 0 °C y 1 atm. ¿Cuántos tanques de oxígeno, cada uno proporcionando 7.00 × 10 3 L de O 2 a 0 °C y 1 atm, se requerirán para quemar el acetileno?
\[\ce{2C2H2 + 5O2⟶4CO2 + 2H2O} \nonumber \]
- Contestar
-
Tanques 3.34 (2.34 × 10 4 L)
El amoníaco es un importante fertilizante y químico industrial. Supongamos que se fabricó un volumen de 683 mil millones de pies cúbicos de amoníaco gaseoso, medido a 25 °C y 1 atm. ¿Qué volumen de H 2 (g), medido en las mismas condiciones, se requirió para preparar esta cantidad de amoníaco por reacción con N 2?
Solución
Debido a que volúmenes iguales de H 2 y NH 3 contienen igual número de moléculas y cada tres moléculas de H 2 que reaccionan producen dos moléculas de NH 3, la relación de los volúmenes de H 2 y NH 3 será igual a 3:2. Dos volúmenes de NH 3, en este caso en unidades de mil millones de pies 3, se formarán a partir de tres volúmenes de H 2:
La fabricación de 683 mil millones de pies 3 de NH 3 requirió 1020 mil millones de pies 3 de H 2. (A 25 °C y 1 atm, este es el volumen de un cubo con una longitud de borde de aproximadamente 1.9 millas).
¿Qué volumen de O 2 (g) medido a 25 °C y 760 torr se requiere para reaccionar con 17.0 L de etileno, C 2 H 4 (g), medido en las mismas condiciones de temperatura y presión? Los productos son CO 2 y vapor de agua.
- Contestar
-
51.0 L
Resumen
La ley de Avogadro puede ser utilizada para determinar el volumen de reactivo (s) gaseoso (s) o producto (s) basado en una ecuación química equilibrada.
Colaboradores y Atribuciones
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).

