5.1: Oraciones Químicas- Ecuaciones
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Identificar los reactivos y productos en cualquier reacción química.
- Convertir ecuaciones de palabras en ecuaciones químicas.
- Use los símbolos comunes,(s),(l),(g)(aq), y→ apropiadamente al escribir una reacción química.
- Explicar los roles de los subíndices y coeficientes en las ecuaciones químicas.
- Equilibrar una ecuación química cuando se le da la ecuación desequilibrada.
- Explicar el papel de la Ley de Conservación de la Masa en una reacción química.
En un cambio químico, se forman nuevas sustancias. Para que esto ocurra, los enlaces químicos de las sustancias se rompen, y los átomos que las componen se separan y se reorganizan en nuevas sustancias con nuevos enlaces químicos. Cuando ocurre este proceso, lo llamamos reacción química. Una reacción química es el proceso en el que una o más sustancias se transforman en una o más sustancias nuevas.
Reactivos y Productos
Para describir una reacción química, necesitamos indicar qué sustancias están presentes al principio y qué sustancias están presentes al final. Las sustancias que están presentes al principio se llaman reactivos y las sustancias presentes al final se llaman productos.
A veces, cuando los reactivos se ponen en un recipiente de reacción, se produce una reacción para producir productos. Los reactivos son los materiales de partida, es decir, lo que sea que tengamos como ingredientes iniciales. Los productos son justamente eso, se produce trigo o el resultado de lo que sucede con los reactivos cuando los juntamos en el recipiente de reacción. Si pensamos en hornear galletas con chispas de chocolate, nuestros reactivos serían harina, mantequilla, azúcar, vainilla, algo de bicarbonato de sodio, sal, huevo y chispas de chocolate. ¿Cuáles serían los productos? ¡Galletas! El recipiente de reacción sería nuestro tazón de mezcla.
Flour+Butter+Sugar+Vanilla+Baking Soda+Eggs+Chocolate Chips⏟Ingredients = Reactants→Cookies⏟Product
Redacción de Ecuaciones Químicas
Cuando se agrega dióxido de azufre al oxígeno, se produce trióxido de azufre. El dióxido de azufre y el oxígenoSO2+O2,, son reactivos y el trióxido de azufreSO3,, es el producto.
2SO2(g)+O2(g)⏟Reactants→2SO3(g)⏟Products
En las reacciones químicas, los reactivos se encuentran antes del símbolo "→" y los productos se encuentran después del símbolo "→”. La ecuación general para una reacción es:
Reactants →Products
Hay algunos símbolos especiales que necesitamos conocer para “hablar” en taquigrafía química. En la siguiente tabla se encuentra el resumen de los símbolos principales utilizados en las ecuaciones químicas. Encontrarás que hay otros pero estos son los principales que necesitamos conocer. 5.1.1La tabla muestra una lista de símbolos utilizados en las ecuaciones químicas.
| Símbolo | Descripción |
|---|---|
| + | utilizado para separar múltiples reactivos o productos |
| → | signo de rendimiento; separa los reactivos de los productos |
| ⇌ | reemplaza el signo de rendimiento para reacciones reversibles que alcanzan el equilibrio |
| Pt→ | fórmula escrita encima de la flecha se utiliza como catalizador en la reacción |
| Δ→ | triángulo indica que la reacción se está calentando |
| (s) | reactivo o producto en estado sólido |
| (l) | reactivo o producto en estado líquido |
| (g) | reactivo o producto en estado gaseoso |
| (aq) | reactivo o producto en una solución acuosa (disuelto en agua) |
Los químicos tienen una opción de métodos para describir una reacción química.
1. Podrían dibujar una imagen de la reacción química.
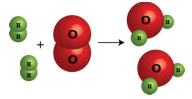
2. Podrían escribir una ecuación de palabras para la reacción química:
“Dos moléculas de gas hidrógeno reaccionan con una molécula de gas oxígeno para producir dos moléculas de vapor de agua”.
3. Podrían escribir la ecuación en taquigrafía química.
2H2(g)+O2(g)→2H2O(g)
En la ecuación simbólica, se utilizan fórmulas químicas en lugar de nombres químicos para los reactivos y se utilizan productos y símbolos para indicar la fase de cada sustancia. Debe ser evidente que el método de taquigrafía química es el método más rápido y claro para escribir ecuaciones químicas.
Podríamos escribir que se agrega una solución acuosa de nitrato de calcio a una solución acuosa de hidróxido de sodio para producir hidróxido de calcio sólido y una solución acuosa de nitrato de sodio. O en taquigrafía podríamos escribir:
Ca(NO3)2(aq)+2NaOH(aq)→Ca(OH)2(s)+2NaNO3(aq)
¿Cuánto más fácil es eso de leer? ¿Vamos a probarlo a la inversa? Mire la siguiente reacción en taquigrafía y escriba la ecuación de la palabra para la reacción:
Cu(s)+AgNO3(aq)→Cu(NO3)2(aq)+Ag(s)
La ecuación de la palabra para esta reacción podría decir algo así como “el cobre sólido reacciona con una solución acuosa de nitrato de plata para producir una solución de nitrato de cobre (II) con plata sólida”.
Para convertir las ecuaciones de palabras en ecuaciones simbólicas, necesitamos seguir los pasos dados:
- Identificar los reactivos y productos. Esto te ayudará a saber qué símbolos van a cada lado de la flecha y a dónde van los+ letreros.
- Escribe las fórmulas correctas para todos los compuestos. Necesitarás usar las reglas que aprendiste en el Capítulo 5 (incluyendo hacer que todos los compuestos iónicos carguen equilibradas).
- Escribe las fórmulas correctas para todos los elementos. Por lo general, esto se da directamente de la tabla periódica. Sin embargo, hay siete elementos que se consideran diatómicos, lo que significa que siempre se encuentran en parejas en la naturaleza. Incluyen aquellos elementos enumerados en la tabla.
| Nombre del elemento | Hidrógeno | Nitrógeno | Oxígeno | Flúor | Cloro | Bromo | Yodo |
|---|---|---|---|---|---|---|---|
| Fórmula | H2 | N2 | O2 | F2 | Cl2 | Br2 | I2 |
Transfiere las siguientes ecuaciones simbólicas a ecuaciones de palabras o ecuaciones de palabras a ecuaciones simbólicas.
- HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)
- Propano gaseoso,C3H8, se quema en gas oxígeno para producir dióxido de carbono gaseoso y agua líquida.
- El gas fluoruro de hidrógeno reacciona con una solución acuosa de carbonato de potasio para producir una solución acuosa de fluoruro de potasio, agua líquida y dióxido de carbono gaseoso.
Solución
a. Una solución acuosa de ácido clorhídrico reacciona con una solución acuosa de hidróxido de sodio para producir una solución acuosa de cloruro de sodio y agua líquida.
b. Reactivos: propano (C3H8) y oxígeno (O2)
Producto: dióxido de carbono (CO2) y agua (H2O)
C3H8(g)+O2(g)→CO2(g)+H2O(l)
c. Reactivos: fluoruro de hidrógeno y carbonato de potasio
Productos: fluoruro de potasio, agua y dióxido de carbono
HF(g)+K2CO3(aq)→KF(aq)+H2O(l)+CO2(g)
Transfiere las siguientes ecuaciones simbólicas a ecuaciones de palabras o ecuaciones de palabras a ecuaciones simbólicas.
- el gas hidrógeno reacciona con el gas nitrógeno para producir amoníaco gaseoso
- HCl(aq)+LiOH(aq)→NaCl(aq)+H2O(l)
- el metal de cobre se calienta con gas oxígeno para producir óxido sólido de cobre (II).
- Contestar a
- H2(g)+N2(g)→NH3(g)
- Respuesta b
- Una solución acuosa de ácido clorhídrico reacciona con una solución acuosa de hidróxido de litio para producir una solución acuosa de cloruro de litio y agua líquida.
- Respuesta c
- Cu(s)+O2(g)→CuO(s)
A pesar de que los compuestos químicos se descomponen y se forman nuevos compuestos durante una reacción química, los átomos en los reactivos no desaparecen ni aparecen nuevos átomos para formar los productos. En las reacciones químicas, los átomos nunca se crean ni destruyen. Los mismos átomos que estaban presentes en los reactivos están presentes en los productos, simplemente se reorganizan en diferentes arreglos. En una ecuación química completa, los dos lados de la ecuación deben estar presentes en el lado reactivo y el lado del producto de la ecuación.
Coeficientes y subíndices
Hay dos tipos de números que aparecen en las ecuaciones químicas. Hay subíndices, que forman parte de las fórmulas químicas de los reactivos y productos y hay coeficientes que se colocan frente a las fórmulas para indicar cuántas moléculas de esa sustancia se utilizan o producen.
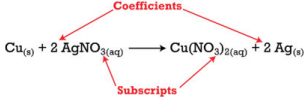
Los subíndices forman parte de las fórmulas y una vez determinadas las fórmulas para los reactivos y productos, no se pueden cambiar los subíndices. Los coeficientes indican el número de cada sustancia involucrada en la reacción y pueden ser cambiados para equilibrar la ecuación. La ecuación anterior indica que un mol de cobre sólido está reaccionando con dos moles de nitrato de plata acuoso para producir un mol de nitrato de cobre acuoso (II) y dos átomos de plata sólida.
Equilibrar una ecuación química
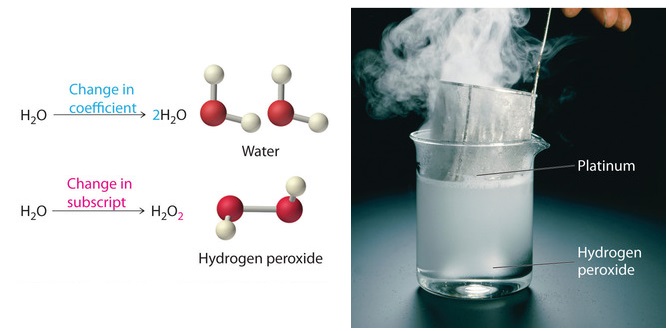
Debido a que las identidades de los reactivos y productos son fijas, la ecuación no se puede equilibrar cambiando los subíndices de los reactivos o los productos. Para ello cambiaría la identidad química de las especies que se describen, como se ilustra en la Figura5.1.2.
El método más simple y generalmente útil para equilibrar ecuaciones químicas es la “inspección”, mejor conocida como ensayo y error. El siguiente es un enfoque eficiente para equilibrar una ecuación química usando este método.
- Identificar la sustancia más compleja.
- Comenzando con esa sustancia, elija uno o más elementos que aparezcan en un solo reactivo y en un producto, si es posible. Ajustar los coeficientes para obtener el mismo número de átomos de este (los) elemento (s) en ambos lados.
- Equilibrar iones poliatómicos (si están presentes en ambos lados de la ecuación química) como una unidad.
- Equilibrar los átomos restantes, generalmente terminando con la sustancia menos compleja y usando coeficientes fraccionarios si es necesario. Si se ha utilizado un coeficiente fraccionario, multiplique ambos lados de la ecuación por el denominador para obtener números enteros para los coeficientes.
- Contar los números de átomos de cada tipo en ambos lados de la ecuación para asegurarse de que la ecuación química está equilibrada.
Equilibrar la ecuación química para la combustión de heptano (C7H16)
C7H16(l)+O2(g)→CO2(g)+H2O(g)
Solución
| Pasos | Explicación | |||||||||||||||
| 1. Identificar la sustancia más compleja. | La sustancia más compleja es la que tiene el mayor número de átomos diferentes, que esC7H16. Supondremos inicialmente que la ecuación química equilibrada final contiene 1 molécula o unidad de fórmula de esta sustancia. | |||||||||||||||
| 2. Ajustar los coeficientes. |
a. Debido a que una molécula de n-heptano contiene 7 átomos de carbono, necesitamos 7 moléculas de CO 2, cada una de las cuales contiene 1 átomo de carbono, en el lado derecho: C7H16(l)+O2(g)→7_CO2(g)+H2O(g)
b. Debido a que una molécula de n-heptano contiene 16 átomos de hidrógeno, necesitamos 8 moléculas de H 2 O, cada una de las cuales contiene 2 átomos de hidrógeno, en el lado derecho: C7H16(l)+O2(g)→7CO2(g)+8_H2O(g)
|
|||||||||||||||
| 3. Equilibrar iones poliatómicos como unidad. | No hay iones poliatómicos a considerar en esta reacción. | |||||||||||||||
| 4. Equilibrar los átomos restantes. |
Los átomos de carbono e hidrógeno están ahora equilibrados, pero tenemos 22 átomos de oxígeno en el lado derecho y solo 2 átomos de oxígeno en el izquierdo. Podemos equilibrar los átomos de oxígeno ajustando el coeficiente frente a la sustancia menos compleja, O 2, en el lado reactivo: C7H16(l)+11_O2(g)→7CO2(g)+8H2O(g)
|
|||||||||||||||
| 5. Revisa tu trabajo. | La ecuación ahora está equilibrada, y no hay coeficientes fraccionarios: hay 7 átomos de carbono, 16 átomos de hidrógeno y 22 átomos de oxígeno en cada lado. Siempre verifique para asegurarse de que una ecuación química esté equilibrada. |
Combustión de Isooctano (C8H18)
C8H18(l)+O2(g)⟶CO2(g)+H2O(g)
Solución
La suposición de que la ecuación química equilibrada final contiene solo una molécula o unidad de fórmula de la sustancia más compleja no siempre es válida, pero es un buen lugar para comenzar. La combustión de cualquier hidrocarburo con oxígeno produce dióxido de carbono y agua.
| pasos | ejemplos | |||||||||||||||
| 1. Identificar la sustancia más compleja. | La sustancia más compleja es la que tiene el mayor número de átomos diferentes, que esC8H18. Supondremos inicialmente que la ecuación química equilibrada final contiene 1 molécula o unidad de fórmula de esta sustancia. | |||||||||||||||
| 2. Ajustar los coeficientes. |
a. El primer elemento que aparece sólo una vez en los reactivos es el carbono: 8 átomos de carbono en isooctano significa que debe haber 8 moléculas de CO 2 en los productos: C8H18(l)+O2(g)⟶8_CO2(g)+H2O(g)
b. Dieciocho átomos de hidrógeno en isooctano significa que debe haber 9 moléculas de H 2 O en los productos: C8H18(l)+O2(g)⟶8CO2(g)+9_H2O(g)
|
|||||||||||||||
| 3. Equilibrar iones poliatómicos como unidad. | No hay iones poliatómicos a considerar en esta reacción. | |||||||||||||||
| 4. Equilibrar los átomos restantes. |
Los átomos de carbono e hidrógeno están ahora equilibrados, pero tenemos 25 átomos de oxígeno en el lado derecho y solo 2 átomos de oxígeno en el izquierdo. Podemos equilibrar la sustancia menos compleja, O 2, pero debido a que hay 2 átomos de oxígeno por molécula de O 2, debemos usar un coeficiente fraccional (252) para equilibrar los átomos de oxígeno: C8H18(l)+252_O2(g)→8CO2(g)+9H2O(g)
La ecuación ahora está equilibrada, pero usualmente escribimos ecuaciones con coeficientes de número entero. Podemos eliminar el coeficiente fraccional multiplicando todos los coeficientes en ambos lados de la ecuación química por 2:
2_C8H18(l)+25_O2(g)⟶16_CO2(g)+18_H2O(g) |
|||||||||||||||
| 5. Revisa tu trabajo. |
La ecuación química equilibrada tiene 16 átomos de carbono, 36 átomos de hidrógeno y 50 átomos de oxígeno en cada lado.
Equilibrar ecuaciones requiere algo de práctica de tu parte así como algo de sentido común. Si te encuentras usando coeficientes muy grandes o si has pasado varios minutos sin éxito, regresa y asegúrate de haber escrito correctamente las fórmulas de los reactivos y productos. |
Se mezclan soluciones acuosas de nitrato de plomo (II) y cloruro de sodio. Los productos de la reacción son una solución acuosa de nitrato de sodio y un precipitado sólido de cloruro de plomo (II). Escribe la ecuación química balanceada para esta reacción.
Solución
| Pasos para la resolución de problemas | Ejemplo5.1.4 | |||||||||||||||
| 1. Identificar la sustancia más compleja. |
La sustancia más compleja es el cloruro de plomo (II). Pb(NO3)2(aq)+NaCl(aq)→NaNO3(aq)+PbCl2(s) |
|||||||||||||||
| 2. Ajustar los coeficientes. |
Hay el doble de iones cloruro en los reactivos que en los productos. Colocar un 2 delante del NaCl para equilibrar los iones cloruro. Pb(NO3)2(aq)+2_NaCl(aq)→NaNO3(aq)+PbCl2(s)
|
|||||||||||||||
| 3. Equilibrar iones poliatómicos como unidad. |
Los iones nitrato aún están desequilibrados. Coloca un 2 frente al NaNO 3. El resultado es: Pb(NO3)2(aq)+2NaCl(aq)→2_NaNO3(aq)+PbCl2(s)
|
|||||||||||||||
| 4. Equilibrar los átomos restantes. | No hay necesidad de equilibrar los átomos restantes porque ya están equilibrados. | |||||||||||||||
| 5. Revisa tu trabajo. |
Pb(NO3)2(aq)+2NaCl(aq)→2NaNO3(aq)+PbCl2(s)
|
¿Cada ecuación química está equilibrada?
- 2Hg(ℓ)+O2(g)→Hg2O2(s)
- C2H4(g)+2O2(g)→2CO2(g)+2H2O(g)
- Mg(NO3)2(s)+2Li(s)→Mg(s)+2LiNO3(s)
- Contestar a
- si
- Respuesta b
- no
- Respuesta c
- si
Equilibrar las siguientes ecuaciones químicas.
- N2(g)+O2(g)→NO2(g)
- Pb(NO3)2(aq)+FeCl3(aq)→Fe(NO3)3(aq)+PbCl2(s)
- C6H14(l)+O2(g)→CO2(g)+H2O(g)
- Contestar a
- N 2 (g) + 2O 2 (g) → 2NO 2 (g)
- Respuesta b
- 3Pb (NO 3) 2 (aq) + 2FeCl 3 (aq) → 2Fe (NO 3) 3 (aq) + 3PbCl 2 (s)
- Respuesta c
- 2C 6 H 14 (l) + 19O 2 (g) → 12CO 2 (g) + 14H 2 O (g)
Resumen
- Una reacción química es el proceso en el que una o más sustancias se transforman en una o más sustancias nuevas.
- Las reacciones químicas están representadas por ecuaciones químicas.
- Las ecuaciones químicas tienen reactivos a la izquierda, una flecha que se lee como “rendimientos” y los productos a la derecha.
- Para ser útiles, las ecuaciones químicas deben estar siempre equilibradas. Las ecuaciones químicas balanceadas tienen el mismo número y tipo de cada átomo en ambos lados de la ecuación.
- Los coeficientes en una ecuación equilibrada deben ser la relación numérica entera más simple. La masa siempre se conserva en las reacciones químicas.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Henry Agnew (UC Davis)

