5.3: El número de Avogadro y el Topo
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Usa el número de Avogadro para convertir a moles y viceversa dado el número de partículas de un elemento.
- Conoce la definición del topo.
- Determinar la masa de fórmula de un compuesto iónico o molecular.
- Determinar la composición porcentual de cada elemento en un compuesto a partir de la fórmula química.
Cuando los objetos son muy pequeños, a menudo resulta inconveniente o ineficiente, o incluso imposible tratar con los objetos uno a la vez. Por estas razones, a menudo tratamos con objetos muy pequeños en grupos, e incluso hemos inventado nombres para varios números de objetos. El más común de estos es “docena” que se refiere a 12 objetos. Frecuentemente compramos objetos en grupos de 12, como donas o lápices. Los objetos aún más pequeños, como pasadores rectos o grapas, generalmente se venden en cajas de 144, o una docena de docenas. A un grupo de 144 se le llama “bruto”.
Este problema de lidiar con cosas que son demasiado pequeñas para operar como artículos individuales también ocurre en la química. Los átomos y las moléculas son demasiado pequeños para ver, y mucho menos para contar o medir. Los químicos necesitaban seleccionar un grupo de átomos o moléculas con los que sería conveniente operar.
Número de Avogadro: Contar átomos
Debido a su pequeño tamaño, los átomos y moléculas no pueden ser contados por observación directa. Pero tanto como lo hacemos al “contar” los frijoles en un frasco, podemos estimar el número de partículas en una muestra de un elemento o compuesto si tenemos alguna idea del volumen que ocupa cada partícula y el volumen del recipiente. Una vez hecho esto, conocemos el número de unidades de fórmula (para usar el término más general para cualquier combinación de átomos que deseamos definir) en cualquier peso arbitrario de la sustancia. El número, por supuesto, dependerá tanto de la fórmula de la sustancia como del peso de la muestra. No obstante, si consideramos un peso de sustancia que es el mismo que su fórmula peso (molecular) expresado en gramos, solo tenemos un número para conocer: el número de Avogadro.
El número de Avogadro es conocido por diez dígitos significativos:
NA=6.022141527×1023.
Sin embargo, solo necesitas conocerlo a tres cifras significativas:
NA≈6.02×1023.
Entonces, ¿6.02×1023de qué? Bueno, de lo que quieras: manzanas, estrellas en el cielo, burritos. No obstante, el único uso práctico para elloNA es tener una forma más conveniente de expresar el enorme número de partículas diminutas como átomos o moléculas que tratamos en química. El número de Avogadro es un número colectivo, igual que una docena. Los estudiantes pueden pensar en la “docena de químicos”.6.02×1023
Antes de entrar en el uso del número de Avogadro en problemas, tómate un momento para convencerte del razonamiento plasmado en los siguientes ejemplos.
- Es un número, así como lo es “docena”, y así es adimensional.
- Es un número enorme, mucho mayor en magnitud de lo que podemos visualizar
- Su uso práctico se limita a contar pequeñas cosas como átomos, moléculas, “unidades de fórmula”, electrones o fotones.
- El valor de N A solo puede conocerse con la precisión de que se pueda estimar el número de átomos en un peso medible de una sustancia. Debido a que grandes números de átomos no se pueden contar directamente, se han realizado una variedad de ingeniosas mediciones indirectas que involucran cosas como el movimiento browniano y la dispersión de rayos X.
El Topo: “Una Docena de Huevos y un Mole de Azúcar, Por Favor”
El mol (símbolo: mol) es la unidad base de cantidad de sustancia (“número de sustancia”) en el Sistema Internacional de Unidades o Sistema Internacional (SI), definida como exactamente 6.02214076×10 23 partículas, e.g., átomos, moléculas, iones o electrones. La definición actual fue adoptada en noviembre de 2018, revisando su antigua definición basada en el número de átomos en 12 gramos de carbono-12 (12 C) (el isótopo de carbono con masa atómica relativa 12 Daltons por definición).
No es obvio por qué los huevos vienen en docenas en lugar de 10s o 14s, o por qué una resma de papel contiene 500 hojas en lugar de 400 o 600. La definición de un topo, es decir, la decisión de basarlo en 12 g de carbono-12, también es arbitraria. El punto importante es que 1 mol de carbono —o de cualquier otra cosa, ya sean átomos, discos compactos o casas— siempre tiene el mismo número de objetos: 6.02 × 10 23.
Video 5.3.1¿Qué tan grande es un topo?
Conversión entre el número de átomos a moles y viceversa
Podemos usar el número de Avogadro como factor de conversión, o ratio, en problemas de análisis dimensional. Si se nos da el número de átomos de un elemento X, podemos convertirlo en moles de usando la relación
1 mol X=6.022×1023 X atoms.
A continuación se da un ejemplo sobre el uso del número de Avogadro como factor de conversión para el carbono.
El elemento carbono existe en dos formas primarias: grafito y diamante. ¿Cuántos moles de átomos de carbono son los4.72×1024 átomos de carbono?
Solución
| Pasos para la resolución de problemas | Ejemplo |
|---|---|
| Identifica la información “dada” y cuál es el problema que te pide “encontrar”. | Dado: átomos de4.72×1024 C Encuentra: mol C |
| Enumerar otras cantidades conocidas | 1mol=6.022×1023Atomos C |
| Preparar un mapa conceptual y utilizar el factor de conversión adecuado. | |
| Cancelar unidades y calcular. | 4.72×1024Catoms×1molC6.02×1023Catoms=7.84molC |
| Piensa en tu resultado. | El número dado de átomos de carbono fue mayor que el número de Avogadro, por lo que el número de moles deC átomos es mayor a 1 mol. Dado que el número de Avogadro es una cantidad medida con tres cifras significativas, el resultado del cálculo se redondea a tres cifras significativas |
Masa de Fórmula
Una habilidad necesaria en futuros capítulos es la capacidad de determinar la masa de la fórmula de diversas sustancias químicas. Esta cantidad se denomina masa de fórmula. La masa de fórmula se obtiene añadiendo las masas de cada átomo individual en la fórmula de la sustancia. Debido a que una fórmula apropiada es eléctricamente neutra (sin electrones netos ganados o perdidos), los iones pueden considerarse átomos con el propósito de calcular la masa de la fórmula.
Comencemos calculando la fórmula masa de cloruro de sodio (NaCl). Esta fórmula masa es la suma de las masas atómicas de un átomo de sodio y un átomo de cloro, que encontramos en la tabla periódica; aquí, usamos las masas a dos decimales:
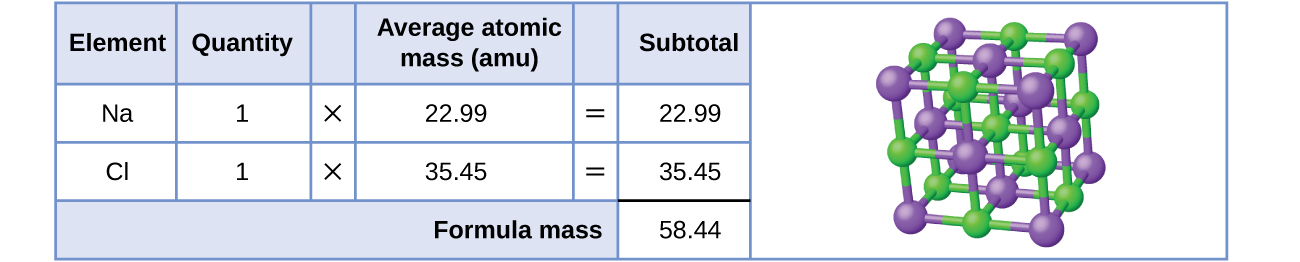
A dos decimales, la masa de fórmula de NaCl es 58.44 amu.
Para las sustancias covalentes, la fórmula representa los números y tipos de átomos que componen una sola molécula de la sustancia; por lo tanto, la masa de fórmula puede denominarse correctamente masa molecular. Considere el cloroformo (CHCl 3), un compuesto covalente que alguna vez se usó como anestésico quirúrgico y que ahora se usó principalmente en la producción de tetrafluoroetileno, el bloque de construcción del polímero “antiadherente”, el teflón. La fórmula molecular del cloroformo indica que una sola molécula contiene un átomo de carbono, un átomo de hidrógeno y tres átomos de cloro. La masa molecular promedio de una molécula de cloroformo es, por lo tanto, igual a la suma de las masas atómicas promedio de estos átomos.
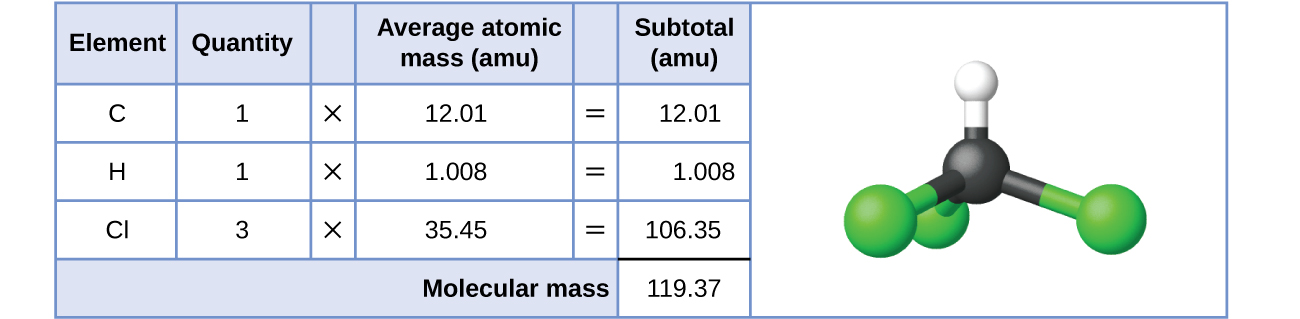
A dos decimales, la masa de fórmula de CHCl 3 es 119.37 amu.
Para los compuestos iónicos con iones poliatómicos, la suma debe incluir el número y masa de cada átomo en la fórmula para el ion poliatómico. como se muestra en el siguiente ejemplo para sulfato de aluminio, Al 2 (SO 4) 3.
El sulfato de aluminio, Al 2 (SO 4) 3, es un compuesto iónico que se utiliza en la fabricación de papel y en diversos procesos de purificación de agua. ¿Cuál es la fórmula masa (amu) de este compuesto?
Solución
La fórmula para este compuesto indica que contiene iones Al 3 + y SO 4 2 − combinados en una proporción 2:3. Para fines de computar una masa de fórmula, es útil reescribir la fórmula en el formato más simple, Al 2 S 3 O 12. Siguiendo el enfoque descrito anteriormente, la masa de fórmula para este compuesto se calcula de la siguiente manera:

La masa de fórmula para Al 2 (SO 4) 3, es 342.14 amu.
Utilice las masas atómicas (redondeadas a dos decimales) para determinar la masa de fórmula para cada compuesto iónico.
- TiO 2
- AgBr
- Au (NO 3) 3
- Fe 3 (PO 4) 2
Responder
a. 79.87 amu
b. 187.77 amu
c. 383.0 amu
Composición porcentual de un compuesto de una fórmula química
La composición porcentual de un compuesto también se puede determinar a partir de la fórmula del compuesto. Los subíndices en la fórmula se utilizan primero para calcular la masa de cada elemento en un mol del compuesto. Eso se divide por la masa molar del compuesto y se multiplica por100%.
%by mass=mass of element in1molmolar mass of compound×100%
La composición porcentual de un compuesto dado es siempre la misma siempre y cuando el compuesto sea puro.
El heptoxido de diclorina(Cl2O7) es un compuesto altamente reactivo utilizado en algunas reacciones de síntesis orgánica. Calcular la composición porcentual del heptoxido de diclorina.
Solución
| Pasos para la resolución de problemas | Ejemplo |
|---|---|
| Identifica la información “dada” y cuál es el problema que te pide “encontrar”. |
Dado: Cl 2 O 7 Encuentra:% Composición (% Cl y %O) |
| Enumerar otras cantidades conocidas |
Masa de Cl en 1 mol Cl 2 O 7, 2 Cl: 2 x 35.45 g = 70.90 g Masa de O en 1 mol Cl 2 O 7, 7 O: 7 x 16.00 g = 112.00 g Masa molar de Cl 2 O 7 = 182.90 g/mol |
| Cancelar unidades y calcular. |
%Cl=70.90gCl182.90g×100%=38.76%Cl %O=112.00gO182.90g×100%=61.24%O Calcular el porcentaje en masa de cada elemento dividiendo la masa de ese elemento en 1 mol del compuesto por la masa molar del compuesto y multiplicando por100%. |
| Piensa en tu resultado. | Los porcentajes suman100%. |
La composición porcentual también se puede utilizar para determinar la masa de un determinado elemento que está contenido en cualquier masa de un compuesto. En el problema anterior de la muestra, se encontró que la composición porcentual del heptoxido de diclorina es38.76%Cl y61.24%O. Supongamos que necesitabas conocer las masas de cloro y oxígeno presentes en una12.50g muestra de heptoxido de diclorina. Se puede configurar un factor de conversión basado en el porcentaje en masa de cada elemento.
12.50gCl2O7×38.76gCl100gCl2O7=4.845gCl
12.50gCl2O7×61.24gO100gCl2O7=7.655gO
La suma de las dos masas es12.50g, la masa del tamaño de la muestra.
El fluoruro de bario es un cristal transparente que se puede encontrar en la naturaleza como el mineral frankdicksonita. Determinar la composición porcentual del fluoruro de bario.
- Respuesta a:
- 78.32% Ba y 21.67% F
Resumen
- El mol (símbolo: mol) es la unidad base de cantidad de sustancia (“número de sustancia”) en el Sistema Internacional de Unidades o Sistema Internacional (SI), definida como exactamente 6.02214076×10 23 partículas, e.g., átomos, moléculas, iones o electrones.
- El número de Avogadro está relacionado con moles de cualquier sustancia X de la siguiente manera:
1 mol X=6.022×1023 X atoms.
- Las masas de fórmula de compuestos iónicos y moleculares se pueden determinar a partir de las masas de los átomos en sus fórmulas.
- Se describen procesos para calcular la composición porcentual de un compuesto basado en la fórmula química.
Colaboradores y Atribuciones
Anonymous
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
Stephen Lower, Professor Emeritus (Simon Fraser U.) Chem1 Virtual Textbook
Henry Agnew (UC Davis)
- Wikipedia