8.3: Electroquímica- Celdas y Baterías
- Page ID
- 72325
- Definir electroquímica.
- Describir los componentes básicos de las celdas electroquímicas.
- Enumere algunas de las características, aplicaciones y limitaciones de celdas y baterías.
- Conocer la diferencia entre celdas galvánicas y electrolíticas.
- Definir electrólisis y enumerar varias de sus aplicaciones.
El metal expuesto a los elementos exteriores generalmente se corroerá si no está protegido. El proceso de corrosión es una serie de reacciones redox que involucran el metal de la escultura. En algunas situaciones, los metales se dejan deliberadamente desprotegidos para que la superficie sufra cambios que puedan potenciar el valor estético de la obra.
Reacciones Electroquímicas
Las reacciones químicas absorben o liberan energía, que puede ser en forma de electricidad. La electroquímica es una rama de la química que se ocupa de la interconversión de energía química y energía eléctrica. La electroquímica tiene muchas aplicaciones comunes en la vida cotidiana. Todo tipo de baterías, desde las que se utilizan para alimentar una linterna hasta una calculadora y un automóvil, dependen de reacciones químicas para generar electricidad. La electricidad se utiliza para platear objetos con metales decorativos como el oro o el cromo. La electroquímica es importante en la transmisión de impulsos nerviosos en sistemas biológicos. La química redox, la transferencia de electrones, está detrás de todos los procesos electroquímicos.
Una celda electroquímica es cualquier dispositivo que convierte la energía química en energía eléctrica o la energía eléctrica en energía química. Hay tres componentes que conforman una reacción electroquímica. Debe haber una solución donde puedan ocurrir reacciones redox. Estas reacciones generalmente tienen lugar en el agua para facilitar el movimiento de electrones e iones. Debe existir un conductor para que los electrones sean transferidos. Este conductor suele ser algún tipo de cable para que los electrones puedan moverse de un sitio a otro. Los iones también deben poder moverse a través de alguna forma de puente salino que facilite la migración de iones.
Luigi Galvani (1737 - 1798) fue un médico y científico italiano que realizó investigaciones sobre la conducción nerviosa en animales. Su observación accidental de las contracciones de las patas de rana cuando estaban en contacto con un bisturí de hierro mientras las patas colgaban de ganchos de cobre condujo a estudios sobre la conductividad eléctrica en músculos y nervios. Creía que los tejidos animales contenían una “electricidad animal” similar a la electricidad natural que provocaba que se formara un rayo.

Alessandro Volta desarrolló la primera “célula voltaica” en 1800. Esta batería consistió en alternar discos de zinc y plata con trozos de cartón empapados en salmuera separando los discos. Como no había voltímetros en ese momento (y ni idea de que la corriente eléctrica se debía al flujo de electrones), Volta tuvo que confiar en otra medida de la intensidad de la batería: la cantidad de choque producido (nunca es buena idea probar las cosas por ti mismo). Encontró que la intensidad del choque aumentó con el número de placas metálicas en el sistema. Aparatos con veinte placas produjeron un choque que resultó bastante doloroso. Es bueno que hoy tengamos voltímetros para medir la corriente eléctrica en lugar del método de “meter el dedo en esto y dime lo que sientes”.
Celdas Galvánicas (Voltáicas)
Las celdas galvánicas, también conocidas como celdas voltaicas, son celdas electroquímicas en las que las reacciones espontáneas de oxidación-reducción producen energía eléctrica. Al escribir las ecuaciones, a menudo es conveniente separar las reacciones de oxidación-reducción en medias reacciones para facilitar el equilibrio de la ecuación general y enfatizar las transformaciones químicas reales.
Considera lo que sucede cuando se coloca una pieza limpia de cobre metálico en una solución de nitrato de plata (Figura\(\PageIndex{1}\)). Tan pronto como se agrega el metal cobre, el metal plateado comienza a formarse y los iones de cobre pasan a la solución. El color azul de la solución en el extremo derecho indica la presencia de iones cobre. La reacción puede dividirse en sus dos medias reacciones. Las medias reacciones separan la oxidación de la reducción, por lo que cada una puede considerarse individualmente.
&\ textrm {oxidación:}\ ce {Cu} (s) ⟶\ ce {Cu^2+} (aq) +\ ce {2e-}\\
&\ subrayado {\ textrm {reducción:} 2× (\ ce {Ag+} (aq) +\ ce {e-} ⟶\ ce {Ag} (s))\ hspace {40px}\ ce {o}\ hspace {40px}\ ce {2Ag+} (aq) +\ ce {2e-} ⟶\ ce {2Ag} (s)}\\
&\ textrm {general:}\ ce {2Ag+} (aq) +\ ce {Cu} (s) ⟶ \ ce {2Ag} (s) +\ ce {Cu^2+} (aq)
\ end {align*}\ nonumber\]
La ecuación para la media reacción de reducción tuvo que duplicarse por lo que el número de electrones “ganados” en la media reacción de reducción igualó el número de electrones “perdidos” en la semirreacción de oxidación.

Las celdas galvánicas o voltáicas implican reacciones electroquímicas espontáneas en las que las medias reacciones se separan (Figura\(\PageIndex{2}\)) para que la corriente pueda fluir a través de un cable externo. El vaso de precipitados del lado izquierdo de la figura se llama media celda, y contiene una solución 1 M de nitrato de cobre (II) [Cu (NO 3) 2] con un trozo de cobre metálico parcialmente sumergido en la solución. El metal de cobre es un electrodo. El cobre está en proceso de oxidación; por lo tanto, el electrodo de cobre es el ánodo. El ánodo está conectado a un voltímetro con un cable y el otro terminal del voltímetro está conectado a un electrodo de plata por un cable. La plata está en proceso de reducción; por lo tanto, el electrodo de plata es el cátodo. La media celda del lado derecho de la figura consiste en el electrodo de plata en una solución 1 M de nitrato de plata (AgnO 3). En este punto, no hay flujos de corriente, es decir, no se produce ningún movimiento significativo de electrones a través del cable porque el circuito está abierto. El circuito se cierra mediante un puente salino, que transmite la corriente con iones en movimiento.
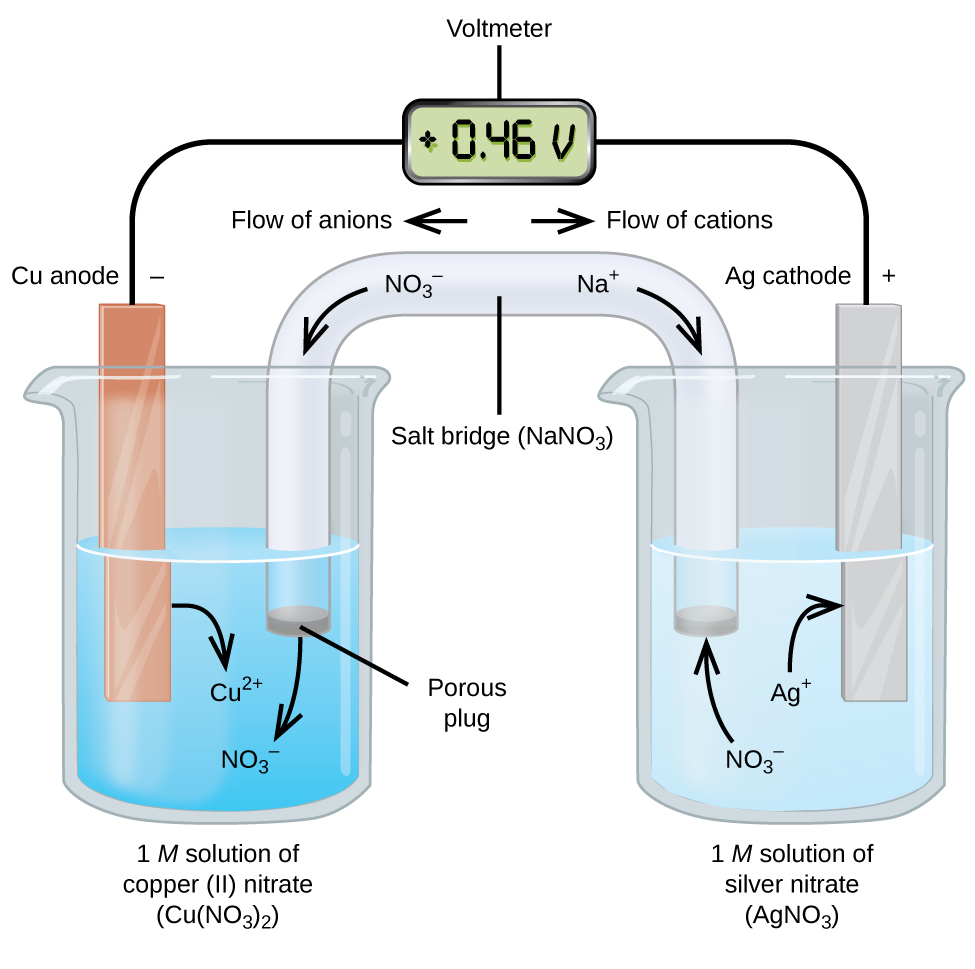
El puente salino consiste en una solución concentrada, no reactiva, electrolítica como la solución de nitrato de sodio (NaNO 3) utilizada en este ejemplo. A medida que los electrones fluyen de izquierda a derecha a través del electrodo y el cable, los iones nitrato (aniones) pasan a través del tapón poroso de la izquierda hacia la solución de nitrato de cobre (II). Esto mantiene el vaso de precipitados de la izquierda eléctricamente neutro al neutralizar la carga en los iones de cobre (II) que se producen en la solución a medida que el metal de cobre se oxida. Al mismo tiempo, los iones nitrato se mueven hacia la izquierda, los iones de sodio (cationes) se mueven hacia la derecha, a través del tapón poroso, y hacia la solución de nitrato de plata a la derecha. Estos cationes añadidos “reemplazan” los iones de plata que se eliminan de la solución ya que se redujeron a metal plateado, manteniendo el vaso de precipitados a la derecha eléctricamente neutro.
Cuando la celda electroquímica se construye de esta manera, un potencial celular positivo (0.46 V) indica una reacción espontánea y que los electrones fluyen de izquierda a derecha.
- Los electrones fluyen del ánodo al cátodo: de izquierda a derecha en la celda galvánica estándar.
- El electrodo en la semicelda izquierda es el ánodo porque aquí se produce la oxidación. El nombre hace referencia al flujo de aniones en el puente salino hacia él.
- El electrodo en la semicelda derecha es el cátodo porque aquí se produce la reducción. El nombre hace referencia al flujo de cationes en el puente salino hacia él.
- La oxidación ocurre en el ánodo (la semicelda izquierda en la figura).
- La reducción ocurre en el cátodo (la semicelda derecha en la figura).
- El puente salino debe estar presente para cerrar (completar) el circuito y se debe producir tanto una oxidación como una reducción para que la corriente fluya.
Considere una celda galvánica que consiste en
\(\ce{2Cr}(s)+\ce{3Cu^2+}(aq)⟶\ce{2Cr^3+}(aq)+\ce{3Cu}(s)\)
Escribe las medias reacciones de oxidación y reducción. ¿Qué reacción ocurre en el ánodo? ¿El cátodo?
Solución
Por inspección, el Cr se oxida cuando se pierden tres electrones para formar Cr 3 +, y Cu 2 + se reduce a medida que gana dos electrones para formar Cu. Equilibrar la carga da
\ (\ begin {align*}
&\ textrm {oxidación:}\ ce {2Cr} (s) ⟶\ ce {2Cr^3+} (aq) +\ ce {6e-}\\
&\ textrm {reducción:}\ ce {3Cu^2+} (aq) +\ ce {6e-} ⟶\ ce {3Cu} (s)\\
&\ overline {textrm {general:}\ ce {2Cr} (s) +\ ce {3Cu^2+} (aq) ⟶\ ce {2Cr^3+} (aq) +\ ce {3Cu} (s)}
\ end {alinear*}\)
La notación celular utiliza la forma más simple de cada una de las ecuaciones, y comienza con la reacción en el ánodo. No se especificaron concentraciones de modo que:
\(\ce{Cr}(s)│\ce{Cr^3+}(aq)║\ce{Cu^2+}(aq)│\ce{Cu}(s).\)
La oxidación ocurre en el ánodo y la reducción en el cátodo.
Considere una celda galvánica que consiste en
\(\ce{Zn}(s)+\ce{Cu^2+}(aq)⟶\ce{Zn^2+}(aq)+\ce{Cu}(s)\)
Escribe las medias reacciones de oxidación y reducción. ¿Qué reacción ocurre en el ánodo? ¿El cátodo?
- Contestar
-
De la información dada en el problema:
\ (\ begin {alinear*}
&\ textrm {ánodo (oxidación):}\ ce {Zn} (s) ⟶\ ce {Zn^2+} (aq) +\ ce {2e-}\\
&\ textrm {cátodo (reducción):}\ ce {Cu^2+} (aq) +\ ce {2e-} ⟶\ ce {Cu} (s)\\
&\ overline {textrm {general:}\ ce {Zn} (s) +\ ce {Cu^2+} (aq) ⟶\ ce {Zn^2+} (aq) +\ ce {Cu} (s)}
\ end {alinear*}\)
Baterías
Una batería es una celda electroquímica o serie de celdas que produce una corriente eléctrica. En principio, cualquier celda galvánica podría ser utilizada como batería. Una batería ideal nunca se agotaría, produciría un voltaje invariable y sería capaz de soportar temperaturas extremas ambientales de calor y humedad. Las baterías reales logran un equilibrio entre las características ideales y las limitaciones prácticas. Por ejemplo, la masa de la batería de un automóvil es de aproximadamente 18 kg o aproximadamente 1% de la masa de un automóvil promedio o camión ligero. Este tipo de batería suministraría energía casi ilimitada si se usara en un teléfono inteligente, pero sería rechazada para esta aplicación por su masa. Por lo tanto, ninguna batería es “la mejor” y las baterías se seleccionan para una aplicación en particular, teniendo en cuenta cosas como la masa de la batería, su costo, confiabilidad y capacidad de corriente. Existen dos tipos básicos de baterías: primaria y secundaria. A continuación se describen algunas baterías de cada tipo.
Visita este sitio para conocer más acerca de las baterías.
Celdas Secas (Baterías Primarias)
Las baterías primarias son baterías de un solo uso porque no se pueden recargar. Una batería primaria común es la celda seca (Figura\(\PageIndex{1}\)). La celda seca es una batería de zinc-carbono. La lata de zinc sirve tanto como recipiente como electrodo negativo. El electrodo positivo es una varilla hecha de carbono que está rodeada por una pasta de óxido de manganeso (IV), cloruro de zinc, cloruro de amonio, polvo de carbono y una pequeña cantidad de agua. La reacción en el ánodo se puede representar como la oxidación ordinaria del zinc:
\[\ce{Zn}(s)⟶\ce{Zn^2+}(aq)+\ce{2e-} \nonumber \]

La reacción en el cátodo es más complicada, en parte porque se produce más de una reacción. La serie de reacciones que se producen en el cátodo es aproximadamente
\[\ce{2MnO2}(s)+\ce{2NH4Cl}(aq)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2NH3}(aq)+\ce{H2O}(l)+\ce{2Cl-} \nonumber \]
La reacción general de la batería de zinc-carbono se puede representar como
\[\ce{2MnO2}(s) + \ce{2NH4Cl}(aq) + \ce{Zn}(s) ⟶ \ce{Zn^2+}(aq) + \ce{Mn2O3}(s) + \ce{2NH3}(aq) + \ce{H2O}(l) + \ce{2Cl-} \nonumber \]
con un potencial celular global que inicialmente es de aproximadamente 1.5 V, pero disminuye a medida que se usa la batería. Es importante recordar que el voltaje que entrega una batería es el mismo independientemente del tamaño de una batería. Por esta razón, las baterías D, C, A, AA y AAA tienen la misma clasificación de voltaje. Sin embargo, las baterías más grandes pueden entregar más moles de electrones.
La celda seca no es muy eficiente en la producción de energía eléctrica porque solo la fracción relativamente pequeña de la\(MnO_2\) que está cerca del cátodo se reduce realmente y solo una pequeña fracción del cátodo de zinc se consume realmente a medida que la celda se descarga. Además, las celdas secas tienen una vida útil limitada debido a que el\(Zn\) ánodo reacciona espontáneamente con\(NH_4Cl\) el electrolito, provocando que la carcasa se corroa y permitiendo que el contenido se escape (Figura\(\PageIndex{2}\)).

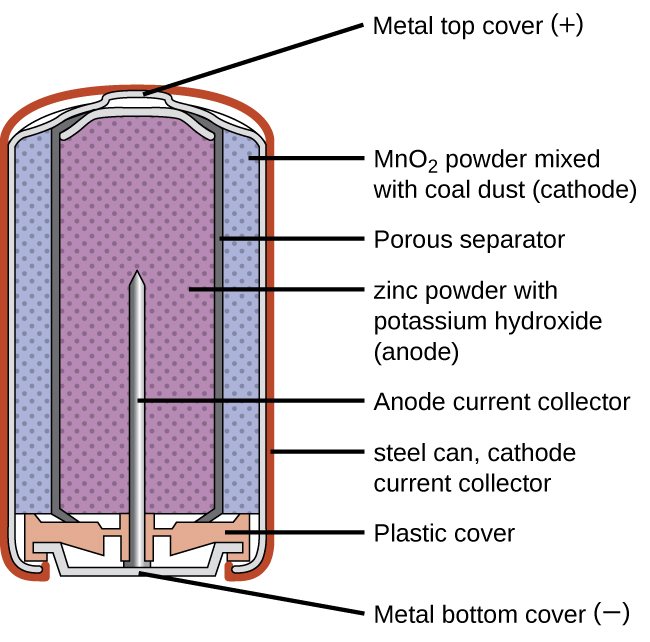
Las baterías alcalinas (Figura\(\PageIndex{4}\)) se desarrollaron en la década de 1950 en parte para abordar algunos de los problemas de rendimiento con las celdas secas de zinc-carbono. Se fabrican para ser reemplazos exactos para celdas secas de zinc-carbono. Como su nombre lo indica, este tipo de baterías utilizan electrolitos alcalinos, a menudo hidróxido de potasio e.
Una batería alcalina puede entregar aproximadamente de tres a cinco veces la energía de una celda seca de zinc-carbono de tamaño similar. Las baterías alcalinas son propensas a fugas de hidróxido de potasio, por lo que estas también deben retirarse de los dispositivos para su almacenamiento a largo plazo. Si bien algunas pilas alcalinas son recargables, la mayoría no lo son.
Los intentos de recargar una batería alcalina que no es recargable a menudo conducen a la ruptura de la batería y la fuga del electrolito de hidróxido de potasio.
Baterías de Plomo para Almacenamiento (Baterías Secundarias)
La batería de plomo-ácido (Figura\(\PageIndex{5}\)) es el tipo de batería secundaria utilizada en su automóvil. Las baterías secundarias son recargables. La batería de plomo-ácido es económica y capaz de producir la alta corriente requerida por los motores de arranque de automóviles. Las reacciones para una batería de plomo-ácido son
\[\begin{align*} &\textrm{anode: }\ce{Pb}(s)+\ce{HSO4-}(aq)⟶\ce{PbSO4}(s)+\ce{H+}(aq)+\ce{2e-}\\ &\underline{\textrm{cathode: } \ce{PbO2}(s)+\ce{HSO4-}(aq)+\ce{3H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)}\\ &\textrm{overall: }\ce{Pb}(s)+\ce{PbO2}(s)+\ce{2H2SO4}(aq)⟶\ce{2PbSO4}(s)+\ce{2H2O}(l) \end{align*} \nonumber \]
Cada celda produce 2 V, por lo que seis celdas están conectadas en serie para producir una batería de automóvil de 12 V. Las baterías de plomo-ácido son pesadas y contienen un electrolito líquido cáustico, pero a menudo siguen siendo la batería de elección debido a su alta densidad de corriente. La batería de plomo-ácido de su automóvil consta de seis celdas conectadas en serie para dar 12 V. Su bajo costo y alta salida de corriente hace que estos excelentes candidatos para proporcionar energía para motores de arranque de automóviles.
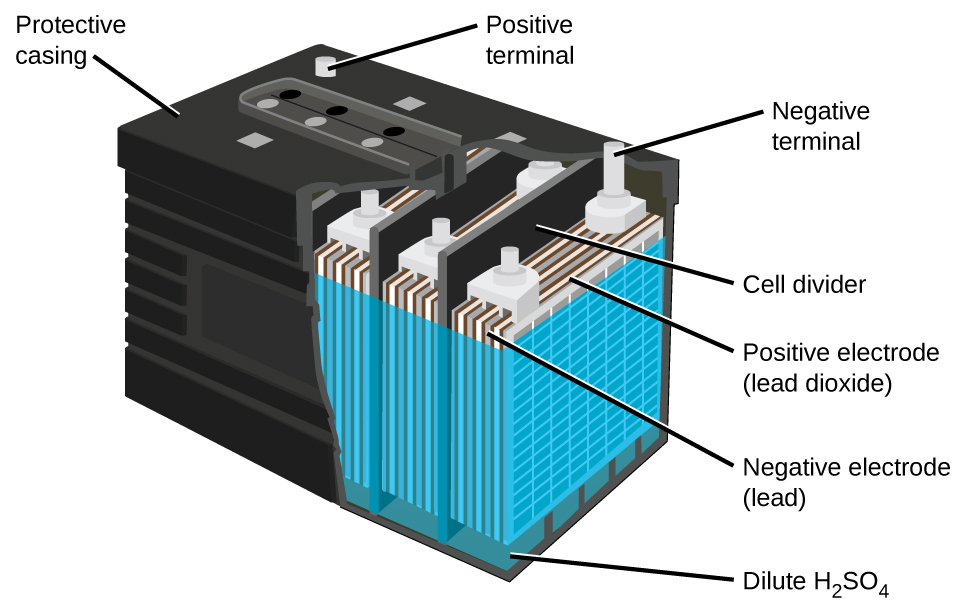
Como se mencionó anteriormente, a diferencia de una celda seca, la batería de almacenamiento de plomo es recargable. Obsérvese que la reacción redox directa genera sulfato de plomo sólido (II) el cual se acumula lentamente en las placas. Adicionalmente, la concentración de ácido sulfúrico disminuye. Cuando el automóvil está funcionando normalmente, su generador recarga la batería forzando las reacciones anteriores a funcionar en la dirección opuesta, o no espontánea.
\[2 \ce{PbSO_4} \left( s \right) + 2 \ce{H_2O} \left( l \right) \rightarrow \ce{Pb} \left( s \right) + \ce{PbO_2} \left( s \right) + 4 \ce{H+} \left( aq \right) + 2 \ce{SO_4^{2-}} \left( aq \right) \nonumber \]
Esta reacción regenera el plomo, el óxido de plomo (IV) y el ácido sulfúrico necesarios para que la batería funcione correctamente. Teóricamente, una batería de almacenamiento de plomo debería durar para siempre. En la práctica, la recarga no es\(100\%\) eficiente debido a que parte del sulfato de plomo (II) cae de los electrodos y se acumula en el fondo de las celdas.
Las baterías de almacenamiento de plomo contienen una cantidad significativa de plomo, por lo que siempre deben desecharse adecuadamente.
Otras Baterías
La batería de níquel-cadmio o NiCad (Figura\(\PageIndex{6}\)) se utiliza en pequeños aparatos eléctricos y dispositivos como taladros,
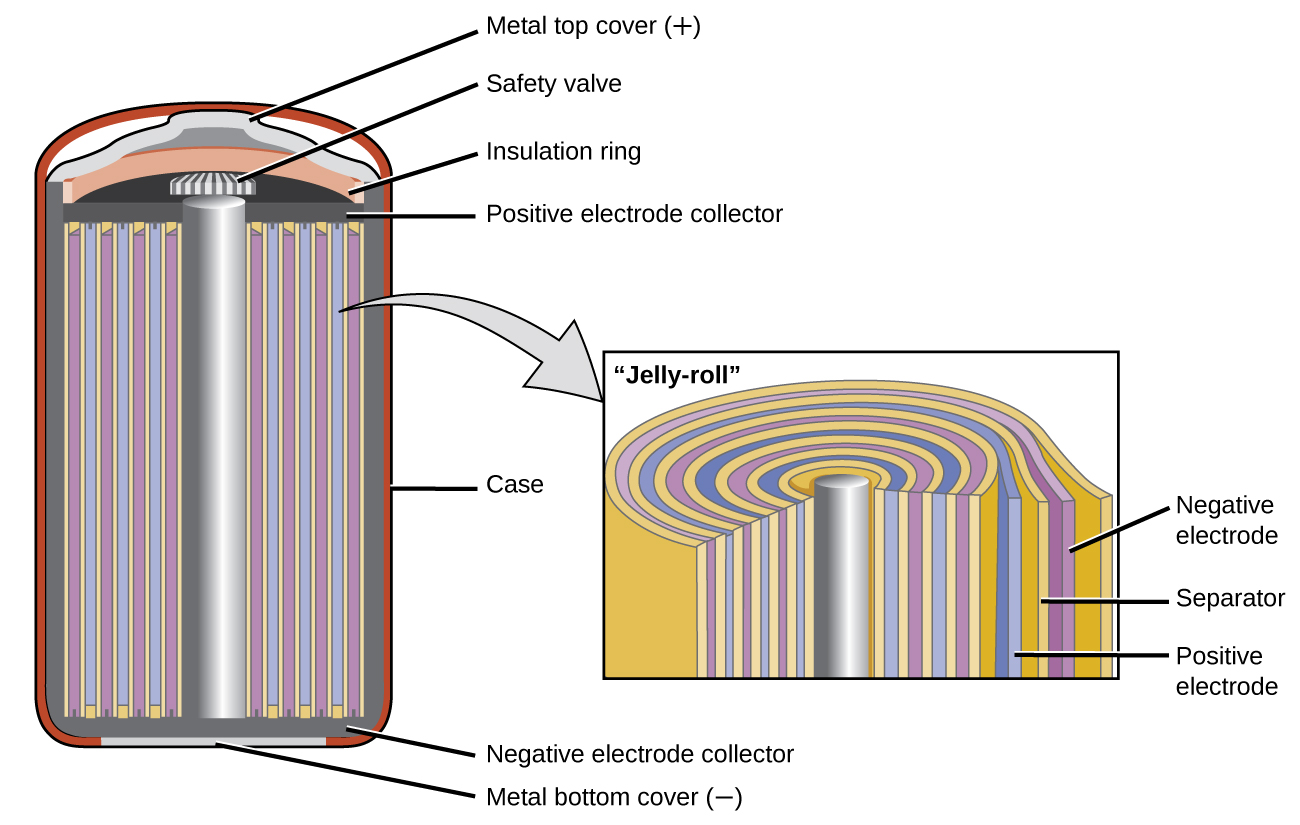
aspiradoras portátiles y sintonizadores digitales AM/FM. Consiste en un cátodo niquelado, ánodo cadmio y un electrodo de hidróxido de potasio. Las placas positiva y negativa, a las que el separador evita que se cortocircuiten, se enrollan juntas y se colocan en la caja. Este es un diseño “gelatinoso” y permite que la celda NiCd entregue mucha más corriente que una batería alcalina de tamaño similar.
El voltaje es de aproximadamente 1.2 V a 1.25 V a medida que la batería se descarga. Cuando se trata adecuadamente, una batería de NiCd se puede recargar aproximadamente 1000 veces.
El cadmio es un metal pesado tóxico, por lo que las baterías de NiCd nunca deben abrirse ni colocarse en la basura normal.
Las baterías de iones de litio se encuentran entre las baterías recargables más populares y se utilizan en muchos dispositivos electrónicos portátiles. El voltaje de la batería es de aproximadamente 3.7 V. Las baterías de litio son populares porque pueden proporcionar una gran cantidad de corriente, son más livianas que las baterías comparables de otros tipos, producen un voltaje casi constante a medida que se descargan y solo pierden lentamente su carga cuando se almacenan. Las baterías especializadas de yoduro de litio (polímero) encuentran aplicación en muchos dispositivos críticos de larga duración, como marcapasos y otros dispositivos médicos electrónicos implantables. Estos dispositivos están diseñados para durar 15 o más años.
Las baterías de litio primarias desechables deben distinguirse de iones de litio secundarios o un polímero de litio. El término “batería de litio” se refiere a una familia de diferentes químicas de litio-metal, que comprende muchos tipos de cátodos y electrolitos pero todos con litio metálico como ánodo. Las baterías de litio son ampliamente utilizadas en dispositivos electrónicos portátiles de consumo y en vehículos eléctricos que van desde vehículos de tamaño completo hasta juguetes controlados por radio.

(0.197 a 0.984 in) de diámetro y 1 a 6 mm (0.039 a 0.236 in) de alto — como un botón en una prenda, de ahí el nombre. Una lata metálica forma el cuerpo inferior y el terminal positivo de la celda. Una tapa superior aislada es el terminal negativo. Las celdas de botón son celdas individuales, generalmente celdas primarias desechables. Los materiales comunes del ánodo son zinc o litio. Los materiales catódicos comunes son dióxido de manganeso, óxido de plata, monofluoruro de carbono, óxido cúprico u oxígeno del aire. Anteriormente eran comunes las pilas de botón de óxido mercúrico, pero ya no están disponibles debido a la toxicidad y los efectos ambientales del mercurio.
Las celdas de botón son muy peligrosas para los niños pequeños. Las células botón que se tragan pueden causar quemaduras internas graves y lesiones significativas o la muerte.
Pilas de combustible
Una pila de combustible es un dispositivo que convierte la energía química en energía eléctrica. Las pilas de combustible son similares a
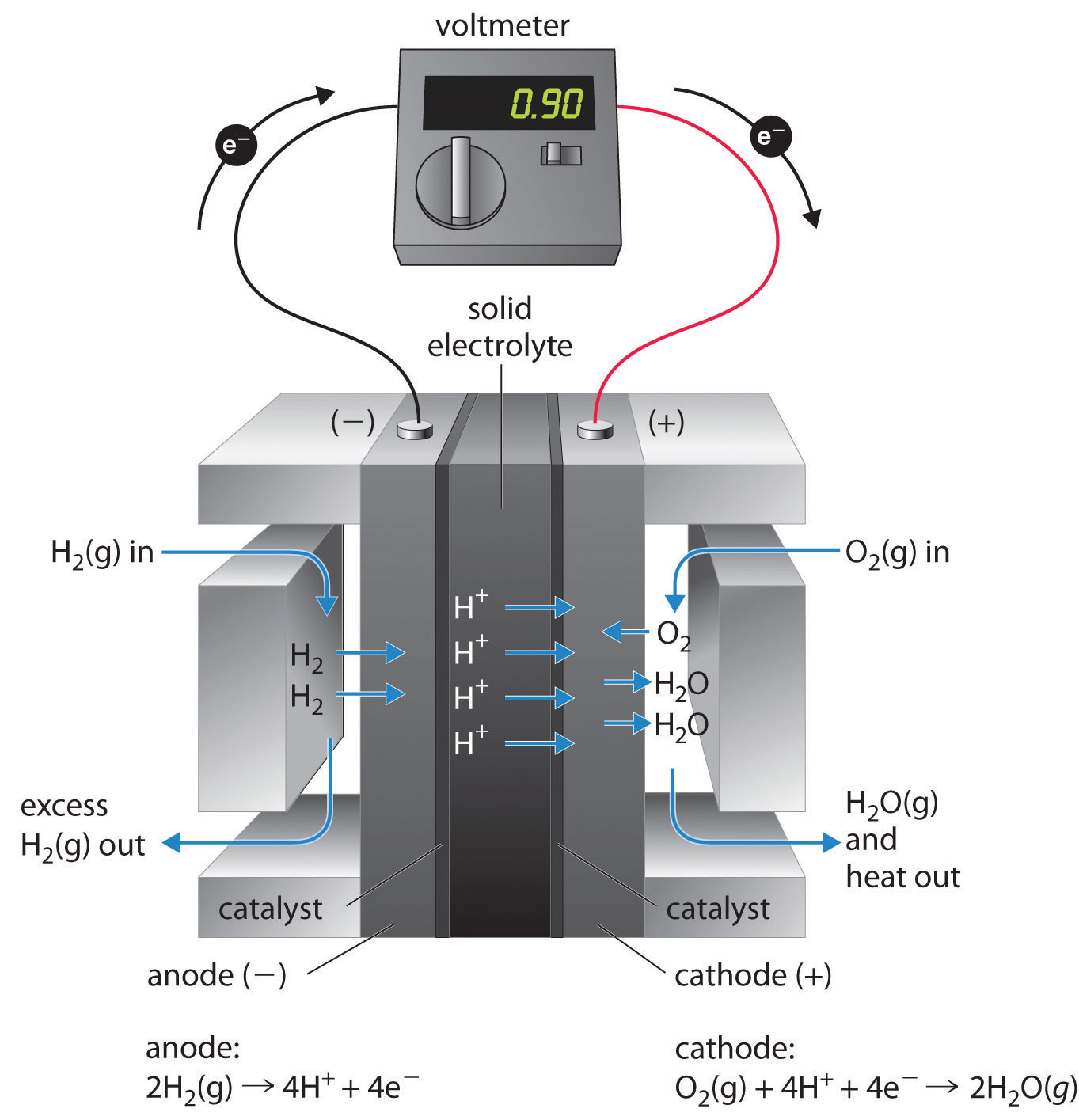
pero requieren una fuente continua de combustible, a menudo hidrógeno. Seguirán produciendo electricidad mientras se disponga de combustible. Las pilas de combustible de hidrógeno se han utilizado para suministrar energía a satélites, cápsulas espaciales, automóviles, embarcaciones y submarinos (Figura\(\PageIndex{8}\)).
El voltaje es de aproximadamente 0.9 V. La eficiencia de las celdas de combustible es típicamente de aproximadamente 40% a 60%, que es mayor que el típico motor de combustión interna (25% a 35%) y, en el caso de la pila de combustible de hidrógeno, produce solo agua como escape. Aunque las pilas de combustible son un medio esencialmente libre de contaminación para obtener energía eléctrica, su costo y complejidad tecnológica han limitado hasta ahora sus aplicaciones.
Electrólisis
En este capítulo, hemos descrito diversas celdas galvánicas en las que se utiliza una reacción química espontánea para generar energía eléctrica. En una celda electrolítica, sin embargo, ocurre el proceso opuesto, llamado electrólisis: se aplica un voltaje externo para impulsar una reacción no espontánea. La electrólisis tiene muchas aplicaciones comerciales e industriales. La electrometalurgia es el proceso de reducción de metales a partir de compuestos metálicos para obtener la forma pura del metal mediante electrólisis. De esta manera se producen aluminio, litio, sodio, potasio, magnesio, calcio y en algunos casos cobre. El cloro y el hidróxido de sodio son los principales productos de la electrólisis de la salmuera, una mezcla de agua/cloruro de sodio. La electrólisis del agua se utiliza para generar oxígeno para naves espaciales y submarinos nucleares.
La electrólisis también se utiliza en la limpieza y preservación de artefactos antiguos. Debido a que el proceso separa las partículas no metálicas de las metálicas, es muy útil para limpiar una amplia variedad de objetos metálicos, desde monedas viejas hasta objetos aún más grandes, incluyendo bloques de cilindros y culatas de hierro fundido oxidado al reconstruir motores de automóviles. La eliminación de óxido de pequeños objetos de hierro o acero por electrólisis se puede hacer en un taller doméstico utilizando materiales simples como una cubeta de plástico, agua del grifo, longitudes de barras de refuerzo, soda de lavado, alambre de empacado y un cargador de batería.
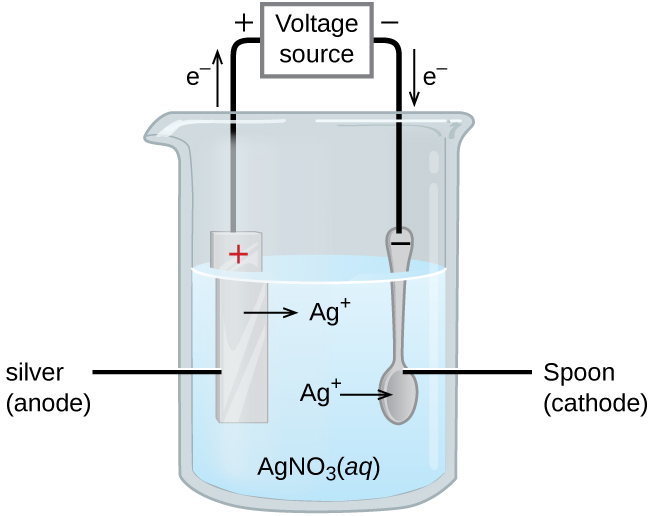
Un uso importante para las celdas electrolíticas es en la galvanoplastia. La galvanoplastia da como resultado un recubrimiento delgado de un metal en la parte superior de una superficie conductora. Las razones para la galvanoplastia incluyen hacer que el objeto sea más resistente a la corrosión, fortalecer la superficie, producir un acabado más atractivo o para purificar el metal. Los metales comúnmente utilizados en galvanoplastia incluyen cadmio, cromo, cobre, oro, níquel, plata y estaño. Los productos de consumo comunes incluyen vajillas chapadas en plata u oro, piezas de automóviles cromadas y joyas. Podemos hacernos una idea de cómo funciona esto investigando cómo se produce la vajilla plateada (Figura\(\PageIndex{9}\)).
Resumen
- La electroquímica es una rama de la química que se ocupa de la interconversión de energía química y energía eléctrica.
- Las baterías son celdas galvánicas, o una serie de celdas, que producen una corriente eléctrica.
- Existen dos tipos básicos de baterías: primaria y secundaria.
- Las baterías primarias son de “un solo uso” y no se pueden recargar. Las celdas secas y (la mayoría) las baterías alcalinas son ejemplos de baterías primarias.
- El segundo tipo es recargable y se llama batería secundaria. Ejemplos de baterías secundarias incluyen baterías de níquel-cadmio (NiCd), ácido de plomo y baterías de iones de litio.
- Las pilas de combustible son similares a las baterías en que generan una corriente eléctrica, pero requieren la adición continua de combustible y oxidante. La pila de combustible de hidrógeno utiliza hidrógeno y oxígeno del aire para producir agua, y generalmente es más eficiente que los motores de combustión interna.
- La electrólisis ocurre cuando se aplica un voltaje externo para impulsar una reacción no espontánea.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- TextMap: Chemistry-The Central Science (Brown et al.)
- Wikipedia

