13.2: Química de la Atmósfera
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Describir el ciclo del nitrógeno.
- Describir el ciclo del oxígeno.
- Describir las condiciones para la inversión de temperatura.
La mezcla de gases en la atmósfera forma un sistema complejo organizado en capas que juntas soportan la vida en la Tierra. Si bien existen numerosos gases, como se muestra en el Cuadro 13.1.1, los cuatro gases superiores constituyen 99.998% del volumen de aire limpio y seco (aire no contaminado que no contiene vapor de agua). De esta composición seca de la atmósfera el nitrógeno, por mucho, es el más común (78%). El nitrógeno diluye el oxígeno y evita la quema rápida o instantánea en la superficie de la Tierra, ya que el gas oxígeno es un reactivo necesario del proceso de combustión. El nitrógeno también es necesario y utilizado por los seres vivos para elaborar proteínas, aunque como gas nitrógeno, N 2, no está disponible para la mayoría de los seres vivos. El oxígeno es utilizado por todos los seres vivos para hacer moléculas que son esenciales para la vida. También es esencial para la respiración aeróbica así como para la combustión o la quema.
Ciclo de Nitrógeno
Toda la vida requiere compuestos nitrogenados, e.g., proteínas y ácidos nucleicos. El aire, que es 79% de gas nitrógeno (N 2), es el principal reservorio de nitrógeno. Pero la mayoría de los organismos no pueden usar nitrógeno en esta forma. La figura13.2.1 ilustra todo el ciclo del nitrógeno. Las plantas deben asegurar su nitrógeno en forma “fija”, es decir, incorporado en compuestos como: iones nitrato (NO 3 −), iones amonio (NH 4 +) y urea (NH 2) 2 CO. Los animales aseguran su nitrógeno (y todos los demás) compuestos de las plantas (o animales que se han alimentado de plantas).
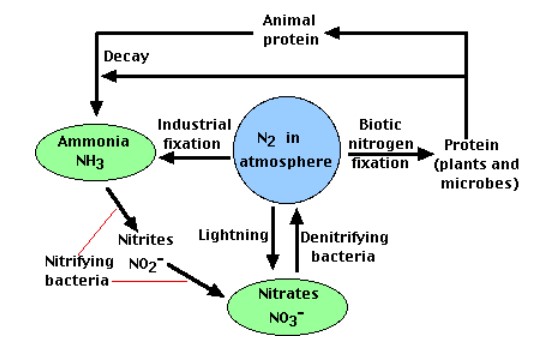
Cuatro procesos participan en el ciclo del nitrógeno a través de la biosfera: (1) fijación de nitrógeno, (2) descomposición, (3) nitrificación y (4) desnitrificación. Los microorganismos juegan un papel importante en estos cuatro.
Fijación de nitrógeno
La molécula de nitrógeno (N 2) es bastante inerte. Para descomponerlo para que sus átomos puedan combinarse con otros átomos requiere la entrada de cantidades sustanciales de energía. Tres procesos son los responsables de la mayor parte de la fijación de nitrógeno en la biosfera:
- fijación atmosférica por relámpago
- fijación biológica por ciertos microbios solos o en una relación simbiótica con algunas plantas y animales
- fijación industrial
Fijación atmosférica
La enorme energía de los rayos rompe las moléculas de nitrógeno y permite que sus átomos se combinen con el oxígeno del aire formando óxidos de nitrógeno. Estos se disuelven en la lluvia, formando nitratos, que son llevados a la tierra. La fijación de nitrógeno atmosférico probablemente aporta un 5-8% del nitrógeno total fijado.
Fijación Industrial
Bajo gran presión, a una temperatura de 600°C, y con el uso de un catalizador, se pueden combinar nitrógeno atmosférico e hidrógeno (generalmente derivado de gas natural o petróleo) para formar amoníaco (NH 3). El amoníaco se puede utilizar directamente como fertilizante, pero la mayor parte del mismo se procesa posteriormente a urea y nitrato de amonio (NH 4 NO 3).
Fijación Biológica
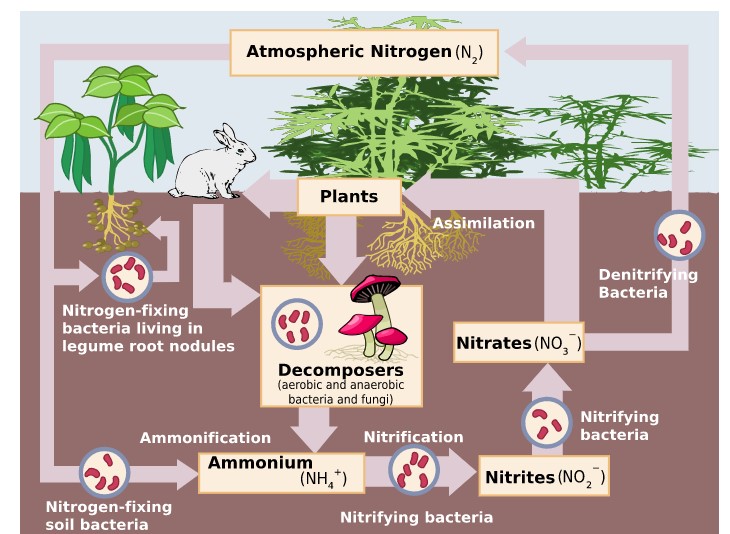
La capacidad de fijar nitrógeno en el suelo (Figura13.2.2) sólo en ciertas bacterias y arqueas.
- Algunos viven en una relación simbiótica con plantas de la familia de las leguminosas (e.g., soja, alfalfa).
- Algunos establecen relaciones simbióticas con plantas distintas a las leguminosas (por ejemplo, alisos).
- Algunos establecen relaciones simbióticas con animales, por ejemplo, termitas y “gusanos de barco” (bivalvos madereros).
- Algunas bacterias fijadoras de nitrógeno viven libres en el suelo.
- Las cianobacterias fijadoras de nitrógeno son esenciales para mantener la fertilidad de ambientes semiacuáticos como los arrozales.
La fijación biológica de nitrógeno requiere un complejo conjunto de enzimas y un enorme gasto de ATP. Aunque el primer producto estable del proceso es el amoníaco, éste se incorpora rápidamente en proteínas y otros compuestos orgánicos nitrogenados.
Decaimiento
Las proteínas elaboradas por las plantas entran y pasan a través de las redes alimentarias tal como lo hacen los carbohidratos. En cada nivel trófico, su metabolismo produce compuestos orgánicos nitrogenados que regresan al ambiente, principalmente en las excreciones. Los beneficiarios finales de estos materiales son microorganismos de descomposición. Descomponen las moléculas en las excreciones y los organismos muertos en amoníaco.
Nitrificación
El amoníaco puede ser absorbido directamente por las plantas, generalmente a través de sus raíces. Sin embargo, la mayor parte del amoníaco producido por la descomposición se convierte en nitratos. Hasta hace poco se pensaba que esto siempre se realizaba en dos pasos:
- Las bacterias del género Nitrosomonas se oxidanNH3 a nitritos (NO−2).
- Las bacterias del género Nitrobacter oxidan los nitritos a nitratos (NO−3).
Estos dos grupos de bacterias autótrofas se denominan bacterias nitrificantes. A través de sus actividades (que les abastecen de todas sus necesidades energéticas), el nitrógeno se pone a disposición de las raíces de las plantas. Sin embargo, en 2015, dos grupos reportaron encontrar que bacterias del género Nitrospira pudieron llevar a cabo ambas etapas: amoníaco a nitrito y nitrito a nitrato. Esta habilidad se llama “comammox” (para la oxidación completa del amoníaco).
Además, tanto el suelo como el océano contienen microbios arqueales, asignados a la Crenarchaeota, que convierten el amoníaco en nitritos. Son más abundantes que las bacterias nitrificantes y pueden llegar a desempeñar un papel importante en el ciclo del nitrógeno.
Muchas leguminosas, además de fijar el nitrógeno atmosférico, también realizan la nitrificación, convirtiendo parte de su nitrógeno orgánico en nitritos y nitratos. Estos llegan al suelo cuando arrojan sus hojas.
Desnitrificación
Los tres procesos anteriores eliminan el nitrógeno de la atmósfera y lo pasan a través de ecosistemas. La desnitrificación reduce los nitratos y nitritos a gas nitrógeno, reponiendo así la atmósfera. En el proceso se forman varios intermedios:
- óxido nítrico (NO)
- óxido nitroso (N 2 O) (un gas de efecto invernadero 300 veces más potente que el CO 2)
- ácido nitroso (HONO)
Una vez más, las bacterias son los agentes. Viven profundamente en el suelo y en sedimentos acuáticos donde las condiciones son anaeróbicas. Utilizan nitratos como alternativa al oxígeno para el aceptor final de electrones en su respiración.
Anammox (una identificación aeróbica de buey amm onia)
Bajo condiciones anaerobias en sedimentos marinos y de agua dulce, otras especies de bacterias son capaces de oxidar el amoníaco (conNO−2) formando gas nitrógeno.
NH+4+NO−2→N2+2H2O
La reacción de anammox puede representar hasta el 50% de la desnitrificación que ocurre en los océanos. Todos estos procesos participan en el cierre del ciclo del nitrógeno.
¿Los desnitrificadores se mantienen al día?
La agricultura ahora puede ser responsable de la mitad de la fijación de nitrógeno en la tierra mediante el uso de fertilizantes producidos por la fijación industrial y el cultivo de legumbres como la soja y la alfalfa. Esta es una notable influencia en un ciclo natural. ¿Los desnitrificadores mantienen en equilibrio el ciclo del nitrógeno? Probablemente no. Ciertamente, hay ejemplos de enriquecimiento de nitrógeno en los ecosistemas. Un ejemplo preocupante: las “floraciones” de algas en lagos y ríos como fertilizantes nitrogenados se lixivian del suelo de granjas adyacentes (y céspedes). La acumulación de nutrientes disueltos en un cuerpo de agua se llama eutrofización.
Ciclo de Oxígeno
El oxígeno es el elemento más abundante en la corteza terrestre. La superficie terrestre está compuesta por la corteza, la atmósfera y la hidrosfera. Alrededor del 50% de la masa de la corteza terrestre consiste en oxígeno (combinado con otros elementos, principalmente silicio). El oxígeno se presenta como moléculas de O 2 y, en cierta medida, como moléculas de O 3 (ozono) en el aire. Forma alrededor del 20% de la masa del aire. Alrededor del 89% del agua en masa consiste en oxígeno combinado. En combinación con carbono, hidrógeno y nitrógeno, el oxígeno es una gran parte de las plantas y los animales.
El oxígeno es un gas incoloro, inodoro e insípido a temperaturas normales. Es ligeramente más denso que el aire. Aunque solo es ligeramente soluble en agua (49 mL de gas se disuelve en 1 L en STP), la solubilidad del oxígeno es muy importante para la vida acuática.
El oxígeno es esencial en procesos de combustión como la quema de combustibles. Plantas y animales utilizan el oxígeno del aire en la respiración (Figura13.2.4). La principal forma en que el oxígeno libre se pierde de la atmósfera es a través de y, mecanismos en los que la vida y consumen oxígeno y liberan dióxido de carbono.
El proceso de respiración se representa como:
6O+2C6H12O6→6CO+26H2O
Las plantas verdes reponen continuamente el oxígeno en la atmósfera mediante un proceso llamado fotosíntesis (Figura13.2.3). Los productos de la fotosíntesis pueden variar, pero, en general, el proceso convierte el dióxido de carbono y el agua en glucosa (un azúcar) y oxígeno utilizando la energía de la luz:
&\ ce {6CO2} (g)\ :+\: &&\ ce {6H2O} (l)
\:\ mathrm {\ underset {luz} {\ xrightarrow {clorofila}}}\:
&&\ ce {C6H12O6} (aq)\ :+\: &&\ ce {6O2} (g)\\
&\ mathrm {carbono\\ dióxido} &&\ ce {agua} &&\ ce { glucosa} &&\ ce {oxígeno}
\ end {alignat}\ nonumber\]
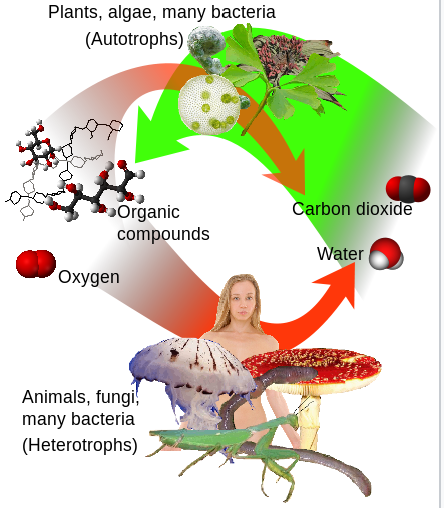
Panorama y fotosíntesis (verde) y respiración (rojo).
El agua (a la derecha), junto con el dióxido de carbono (CO 2), forman oxígeno y compuestos orgánicos (a la izquierda),
que puede ser respirado al agua y (CO 2). Fuente: Wikipedia
Así, el oxígeno que se convirtió en dióxido de carbono y agua por los procesos metabólicos en plantas y animales regresa a la atmósfera por fotosíntesis. Los organismos fotosintetizadores incluyen la vida vegetal de las áreas terrestres así como de los océanos. El pequeño marino fue descubierto en 1986 y representa más de la mitad de la fotosíntesis del océano abierto.
El oxígeno es un reactivo clave en diversas reacciones de oxidación mencionadas en la sección 8.5. El oxígeno libre atmosférico también es consumido por la intemperie química y las reacciones superficiales. Un ejemplo de meteorización superficial es la formación de óxido:
El ozono se forma de forma natural en la atmósfera superior por la acción de la luz ultravioleta del sol sobre el oxígeno allí. La mayor parte del ozono atmosférico ocurre en la estratosfera, una capa de la atmósfera que se extiende de aproximadamente 10 a 50 kilómetros sobre la superficie terrestre. Este ozono actúa como barrera a la luz ultravioleta dañina del sol al absorberla a través de una reacción de descomposición química:
O3(g)ultravioletlight→O(g)+O2(g)
Inversión de temperatura
En meteorología, una inversión, también conocida como inversión de temperatura, es una desviación del cambio normal de una propiedad amosférica con altitud. Casi siempre se refiere a una inversión de la tasa de lapso térmico. Normalmente, la temperatura del aire disminuye con un incremento en la altitud. Durante una inversión, el aire más cálido se mantiene por encima del aire más frío; se invierte el perfil de temperatura normal con altitud.
Una inversión atrapa la contaminación del aire, como el smog, cerca del suelo. Una inversión también puede suprimir la convección actuando como una “tapa”. Si esta tapa se rompe por alguna de varias razones, la convección de cualquier humedad presente puede entonces estallar en tormentas eléctricas violentas La inversión de temperatura puede resultar notoriamente en lluvias heladas en climas fríos.
Resumen
- Las diferentes formas de nitrógeno que se pueden utilizar en el metabolismo se producen a través del proceso de fijación de nitrógeno.
- Las bacterias en el suelo llevan a cabo un proceso conocido como desnitrificación que convierte los nitratos de nuevo en gas nitrógeno.
- El oxígeno se produce principalmente a través de la fotosíntesis. Una fuente adicional de oxígeno libre atmosférico proviene de la cual la radiación de alta energía descompone el agua atmosférica y el óxido nitroso.
- El oxígeno se utiliza durante la respiración celular y la descomposición. Así como durante la meteorización química y diversas reacciones de oxidación.
- La inversión de temperatura es cuando una capa de aire frío queda atrapada bajo una capa de aire más cálido. El aire fresco y denso puede atrapar y acumular contaminantes del aire.
Colaboradores y Atribuciones
- Template:ContribKimball
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- TextMap: Microbiology (Boundless)
- Wikipedia


