13.5: Smog fotoquímico: haciendo neblina mientras el sol brilla
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Describir el smog fotoquímico.
- Enumere diferentes medios para abordar el smog fotoquímico.
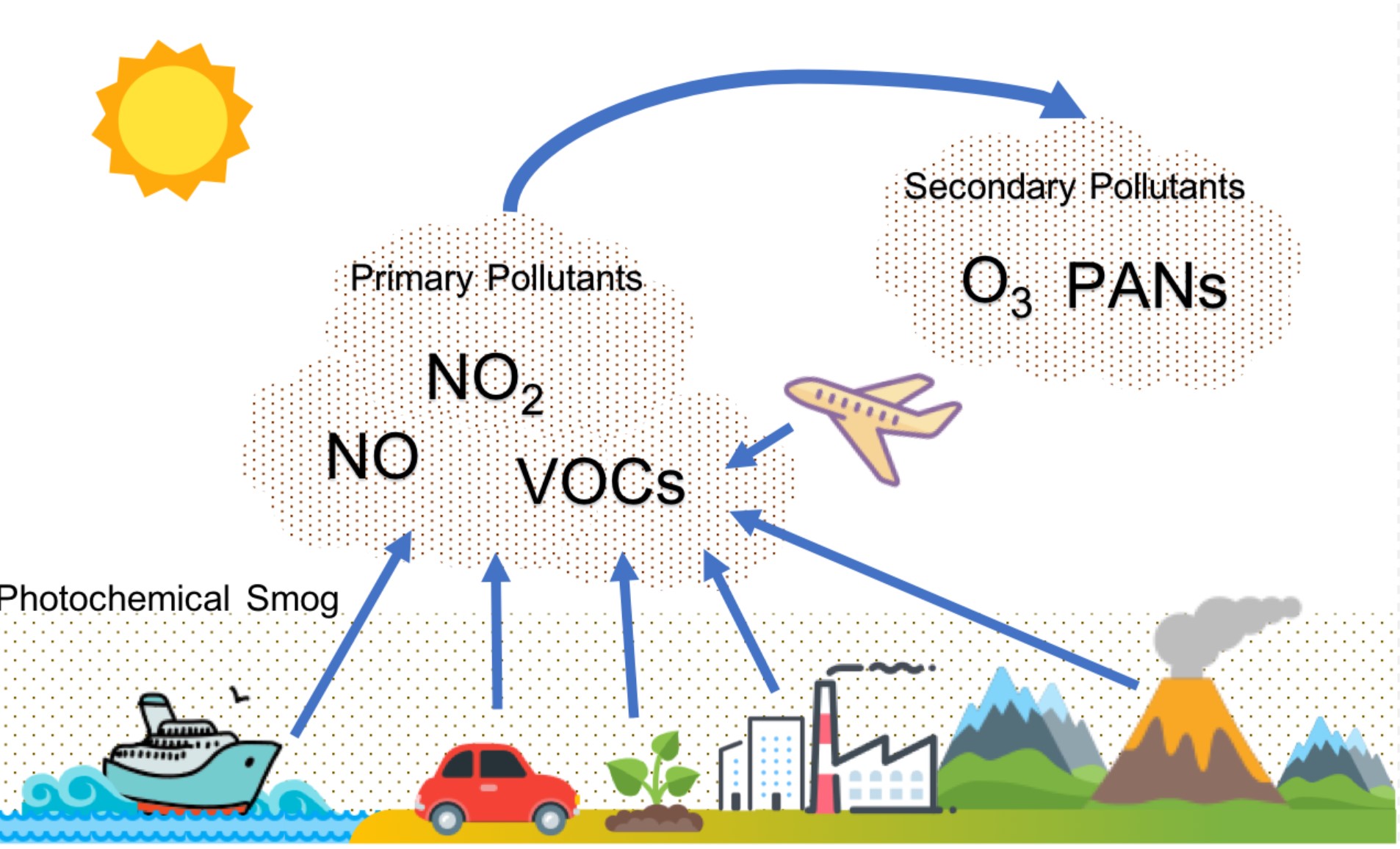
El smog fotoquímico es un tipo de contaminación del aire debido a la reacción de la radiación solar con mezclas contaminantes transportadas por el aire de óxidos de nitrógeno (NOx) y compuestos orgánicos volátiles (hidrocarburos). El smog es un subproducto de la industrialización moderna. Debido a la industria y la cantidad de vehículos motorizados, esto es más un problema en las grandes ciudades que tienen un clima cálido, soleado y seco.
- Oxidación: El smog fotoquímico también se conoce como smog oxidante. Las reacciones de oxidación se han definido de varias maneras. En cuanto a la transferencia de oxígeno, la oxidación es una ganancia de oxígeno. La oxidación también se puede definir como una pérdida de hidrógeno. El uso más importante de la oxidación se describe en términos de transferencia de electrones. La oxidación puede describirse como un aumento en el número de oxidación o pérdida de electrones. Los números de oxidación representan una distribución de carga. En otras palabras, los números de oxidación representan la carga del átomo si el compuesto estaba compuesto por iones.
- Reducción: La reducción puede implicar la ganancia de hidrógeno o pérdida de oxígeno. La reducción puede referirse a la ganancia de electrones, lo que resulta en una disminución en el número de oxidación.
Formación de Smog Fotoquímico
Las diferentes reacciones involucradas en la formación de smog fotoquímico se dan a continuación.
Paso 1: La gente comienza a conducir por la mañana, el nitrógeno se quema u oxida
N2+O2→2NO
- El número de oxidación de N 2 es 0. El nitrógeno en NO ha adquirido un número de oxidación de +2.
Paso 2: Después de unas horas, el NO se combina con O 2, en otra reacción de oxidación
2NO+O2→2NO2
- El nitrógeno en NO tiene un número de oxidación de +2. El nitrógeno en NO 2 tiene un número de oxidación de +4.
Paso 3: El dióxido de nitrógeno absorbe energía lumínica, dando como resultado una reacción de reducción
NO2→NO+O
- El nitrógeno en NO 2 tiene un número de oxidación de +4 y el nitrógeno en NO es +2.
Paso 4: En la luz del sol, el oxígeno atómico se combina con el gas oxígeno para formar ozono
O+O2→O3
Paso 5: La reacción depende de la temperatura y la luz solar
O3+NO⇌NO2+O2
Reacciones Alternativas
El NO y el NO 2 también pueden reaccionar con los hidrocarburos en lugar de ozono para formar otros compuestos volátiles conocidos como PAN (nitrato de peroxiacetilo) como se muestra en la Figura. La acumulación de ozono y compuestos orgánicos volátiles junto con la energía del sol forma el smog fotoquímico marrón visto en días calurosos y soleados. Vista panorámica de Santiago cubierto por una capa de smog el 10 de mayo de 2006. La Región Metropolitana de Santiago que enfrenta el otoño más seco de los últimos 28 años debido a la falta de lluvias, lo que aunado a la mala circulación del aire, provoca un incremento del smog.
Peligros para la salud
Debido a que el ozono es altamente reactivo, tiene la capacidad de oxidar y destruir el tejido pulmonar. Las exposiciones a corto plazo a niveles elevados de ozono (por encima de .75 ppm) se han relacionado con una serie de irritaciones respiratorias que incluyen tos, sibilancias, dolor subesternal, faringitis y disnea. Se ha demostrado que la exposición prolongada a la molécula provoca una reducción permanente de la función pulmonar, así como elevar el riesgo de desarrollar asma. El dióxido de azufre es un componente común del smog londinense. Los estudios epidemiológicos han relacionado la exposición a corto plazo al dióxido de azufre con irritaciones respiratorias, incluyendo tos, sibilancias y faringitis.
Otros efectos nocivos del smog
Las plantas son dañadas por la exposición a óxidos de nitrógeno, ozono y nitrato de peroxiacetilo (PAN, ver arriba), todos los oxidantes presentes en una atmósfera ahumada. El PAN es el más dañino de estos constituyentes, dañando especialmente las hojas de las plantas más jóvenes. La exposición al ozono provoca la formación de manchas amarillas en las hojas, una condición llamada punteado clorótico. Algunas especies de plantas, como la lechuga de hoja de espada, la solana negra, la almidera y el tomate de doble fortuna, son extremadamente susceptibles al daño por especies oxidantes en el smog y se utilizan como bioindicadores de la presencia de smog. Los costos de daños en cultivos y huertos por smog alcanzan millones de dólares al año en áreas propensas a este tipo de contaminación del aire, como el sur de California.
Los materiales que se ven afectados negativamente por el smog son generalmente aquellos que son atacados por oxidantes. El mejor ejemplo de tal material es el caucho, especialmente el caucho natural, que es atacado por el ozono. De hecho, el endurecimiento y agrietamiento del caucho natural se ha utilizado como prueba para el ozono atmosférico.
Las partículas de aerosol atmosféricas que reducen la visibilidad son la manifestación más común del daño causado a la calidad atmosférica por el smog. El proceso de formación de smog ocurre por la oxidación de materiales orgánicos en la atmósfera, y los materiales orgánicos que contienen carbono son los constituyentes más comunes de las partículas de aerosol en una atmósfera afectada por el smog. Los árboles de coníferas (pino y ciprés) y los cítricos son los principales contribuyentes a los hidrocarburos orgánicos que son precursores de la formación de partículas orgánicas en el smog.
Control de Smog fotoquímico
Cada vehículo nuevo que se venda en Estados Unidos debe incluir un convertidor catalítico para reducir las emisiones fotoquímicas. Los convertidores catalíticos obligan al CO y a los hidrocarburos incompletamente quemados a reaccionar con un catalizador metálico, típicamente platino, para producir CO 2 y H 2 O. Adicionalmente, los convertidores catalíticos reducen los óxidos de nitrógeno de los gases de escape a O 2 y N 2, eliminando el ciclo de formación de ozono. Muchos científicos han sugerido que bombear gas por la noche podría reducir la formación de ozono fotoquímico al limitar la cantidad de exposición que los COV tienen con la luz solar.
Prevención del smog con química verde
El smog es básicamente un problema químico, lo que indicaría que debería ser susceptible de soluciones químicas. En efecto, la práctica de la química verde y la aplicación de los principios de la ecología industrial pueden ayudar a reducir el smog. Esto se debe en gran parte a que una premisa básica de la química verde es evitar la generación y liberación de especies químicas con el potencial de dañar el medio ambiente. La mejor manera de prevenir la formación de smog es evitar la liberación de óxidos de nitrógeno y vapores orgánicos que permiten la formación de smog. A un nivel aún más fundamental, se pueden tomar medidas para evitar el uso de tecnologías susceptibles de liberar tales sustancias, por ejemplo, mediante el uso de alternativas a los automóviles contaminantes para el transporte.
La evolución de los dispositivos de control de contaminación automotriz para reducir el smog proporciona un ejemplo de cómo se puede usar la química verde para reducir la contaminación. Las primeras medidas tomadas para reducir las emisiones de hidrocarburos y óxidos de nitrógeno de los automóviles fueron en gran medida medidas de mando y control y de “fin de tubería”. Estas medidas primitivas implementadas a principios de los 70 sí redujeron las emisiones, pero con una fuerte penalización en el consumo de combustible y en el rendimiento de conducción de los vehículos. Sin embargo, en las últimas tres décadas, el motor del automóvil de combustión interna se ha convertido en una máquina altamente sofisticada controlada por computadora que generalmente funciona bien, emite pocos contaminantes del aire y es altamente eficiente. (Y sería mucho más eficiente si aquellos conductores que sienten que deben conducir a los “utilitarios deportivos”, cambiaran a vehículos de un tamaño más sensato). Este cambio ha requerido un enfoque integrado que implica la reformulación de la gasolina. El primer cambio importante fue la eliminación de la gasolina del tetraetilplomo, un compuesto organometálico que envenenó los catalizadores de escape automotriz (y ciertamente no fue bueno para las personas). La gasolina también se reformuló para eliminar hidrocarburos excesivamente volátiles e hidrocarburos insaturados (aquellos con dobles enlaces entre átomos de carbono) que son especialmente reactivos en la formación de smog fotoquímico.
Un enfoque aún más drástico para eliminar las emisiones formadoras de smog es el uso de automóviles eléctricos que no queman gasolina. Estos vehículos ciertamente no contaminan ya que están siendo conducidos, pero sufren el problema probablemente irresoluble de un rango muy limitado entre cargas y la necesidad de baterías relativamente pesadas. Sin embargo, los automóviles híbridos que utilizan un pequeño motor de gasolina o diesel que proporciona electricidad para impulsar motores eléctricos que impulsan el automóvil y para recargar baterías relativamente más pequeñas pueden remediar en gran medida los problemas de emisión y economía de combustible con los automóviles. El motor de combustión interna de estos vehículos funciona sólo cuando es necesario para proporcionar potencia y, al hacerlo, puede funcionar a una velocidad relativamente uniforme que proporciona la máxima economía con emisiones mínimas.
Otro enfoque que se está utilizando en vehículos tan grandes como los autobuses que tienen acceso conveniente y frecuente a las estaciones de servicio es el uso de celdas de combustible que pueden generar electricidad directamente a partir de la combinación catalítica de hidrógeno elemental y oxígeno, produciendo solo agua inofensiva como producto. También hay procesos catalíticos que pueden generar hidrógeno a partir de combustibles líquidos, como el metanol, de manera que los vehículos que transportan dicho combustible puedan ser alimentados por electricidad generada en celdas de combustible.
La química ecológica se puede aplicar a dispositivos y procesos distintos de los automóviles para reducir las emisiones de formación de humo. Esto es especialmente cierto en el área de solventes orgánicos utilizados para la limpieza de piezas y otras operaciones industriales, cuyos vapores a menudo se liberan a la atmósfera. La sustitución del agua con aditivos adecuados o incluso el uso de fluido de dióxido de carbono supercrítico puede eliminar tales emisiones.
Resumen
- El smog fotoquímico es una mezcla de contaminantes que se forman (principalmente durante los calurosos meses de verano) cuando los óxidos de nitrógeno y los compuestos orgánicos volátiles (COV) reaccionan a la luz solar, creando una neblina marrón sobre las ciudades.
- El smog fotoquímico se forma a partir de las reacciones de las emisiones naturales y artificiales de óxidos de nitrógeno y COV.
- El smog es un problema grave en muchas ciudades y continúa dañando la salud humana y es especialmente dañino para las personas mayores, niños y personas con afecciones cardíacas y pulmonares como enfisema, bronquitis y asma.
- Los catalizadores en vehículos propulsados por gas ayudan a reducir las emisiones fotoquímicas.
- La práctica de la química verde y la aplicación de los principios de la ecología industrial pueden ayudar a reducir el smog.
Colaboradores y Atribuciones
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
- Stanley Manahan (University of Missouri)
- Wikipedia

