13.8: Ozono estratosférico - Escudo Vital de la Tierra
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Describir el agotamiento de la capa de ozono.
- Explicar cómo reaccionan los átomos de cloro y bromo con el ozono que conduce al agotamiento de la capa de ozono.
La capa de ozono estratosférico de la Tierra juega un papel crítico en la absorción de la radiación ultravioleta emitida por el sol. En los últimos treinta años, se ha descubierto que el ozono estratosférico se está agotando como resultado de los contaminantes antropogénicos. Hay una serie de reacciones químicas que pueden agotar el ozono estratosférico; sin embargo, algunas de las más significativas implican la destrucción catalítica del ozono por radicales halógenos como el cloro y el bromo.
Introducción
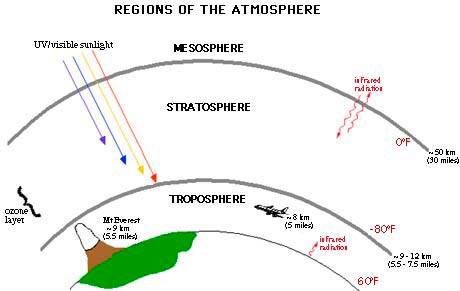
La atmósfera de la Tierra se divide en cinco capas. En orden de más cercano y grueso a más lejano y más delgado las capas se enumeran de la siguiente manera: troposfera, estratosfera, mesosfera, termosfera y exósfera. La mayor parte del ozono en la atmósfera reside en la estratosfera, que se extiende desde seis millas sobre la superficie de la Tierra hasta 31 millas. Los humanos dependen en gran medida de la absorción de los rayos ultravioleta B por la capa de ozono porque la radiación UV-B causa cáncer de piel y puede provocar daños genéticos. La capa de ozono ha protegido históricamente a la Tierra de los dañinos rayos UV, aunque en las últimas décadas esta protección ha disminuido debido al agotamiento del ozono estratosférico.
El agotamiento del ozono es en gran parte el resultado de sustancias artificiales. Los humanos han introducido gases y químicos en la atmósfera que han agotado rápidamente la capa de ozono en el siglo pasado. Este agotamiento hace que los humanos sean más vulnerables a los rayos UV-B que se sabe que causan cáncer de piel, así como otras deformidades genéticas. La posibilidad de agotamiento del ozono fue introducida por primera vez por los científicos a fines de la década de 1960 cuando los sueños de transporte súper sónico comenzaron a hacerse realidad. Los científicos habían sido conscientes desde hace mucho tiempo de que el óxido nítrico (NO) puede reaccionar catalíticamente con el ozono (O3) para producirO2NO moléculas; sin embargo, las moléculas producidas a nivel del suelo tienen una vida media demasiado corta para llegar a la estratosfera. No fue hasta el advenimiento de los jets súper sónicos comerciales (que vuelan en la estratosfera y a una altitud mucho mayor que los jets convencionales) que el potencialNO para reaccionar con el ozono estratosférico se convirtió en una posibilidad. La amenaza de agotamiento del ozono del transporte comercial súper sónico fue tan grande que a menudo se la cita como la razón principal por la que el gobierno federal estadounidense sacó apoyo para su desarrollo en 1971. El miedo al agotamiento del ozono disminuyó hasta 1974 cuando Sherwood Rowland y Mario Molina descubrieron que los clorofluorocarbonos podían ser fotolizados por fotones de alta energía en la estratosfera. Descubrieron que este proceso podría liberar radicales de cloro que reaccionarían catalíticamenteO3 y destruirían la molécula. Este proceso se llama la teoría Rowland-Molina delO3 agotamiento.
El Ciclo Chapman
La estratosfera se encuentra en un ciclo constante con moléculas de oxígeno y su interacción con los rayos ultravioleta. Este proceso se considera un ciclo debido a su constante conversión entre diferentes moléculas de oxígeno. La capa de ozono se crea cuando los rayos ultravioleta reaccionan con las moléculas de oxígeno (O 2) para crear ozono (O 3) y oxígeno atómico (O). Este proceso se llama el ciclo Chapman.
Paso 1: Una molécula de oxígeno es fotolizada por radiación solar, creando dos radicales de oxígeno:
hν+O2→2O.
Paso 2: Los radicales de oxígeno reaccionan entonces con oxígeno molecular para producir ozono:
O2+O.→O3
Paso 3: El ozono reacciona entonces con un radical de oxígeno adicional para formar oxígeno molecular:
O3+O.→2O2
Paso 4: El ozono también se puede reciclar en oxígeno molecular al reaccionar con un fotón:
O3+hν→O2+O.
Es importante tener en cuenta que el ozono está siendo constantemente creado y destruido por el ciclo Chapman y que estas reacciones son procesos naturales, que se vienen dando desde hace millones de años. Debido a esto, el grosor de la capa de ozono en cualquier momento en particular puede variar mucho. También es importante saber que el O 2 se está introduciendo constantemente en la atmósfera a través de la fotosíntesis, por lo que la capa de ozono tiene la capacidad de regenerarse a sí misma.
Química del Agotamiento del Ozono
Las moléculas de CFC están compuestas por átomos de cloro, flúor y carbono y son extremadamente estables. Esta estabilidad extrema permite que los CFC lleguen lentamente a la estratosfera (la mayoría de las moléculas se descomponen antes de que puedan cruzar a la estratosfera desde la troposfera). Esta vida prolongada en la atmósfera les permite alcanzar grandes altitudes donde los fotones son más enérgicos. Cuando los CFC entran en contacto con estos fotones de alta energía, sus componentes individuales se liberan del todo. La siguiente reacción muestra cómo los átomos de Cl tienen un ciclo de destrucción de ozono:
Cl+O3→ClO+O2
ClO+O.→Cl+O2
O3+O.→2O2
El cloro es capaz de destruir gran parte del ozono porque actúa como catalizador. El cloro inicia la descomposición del ozono y se combina con un oxígeno liberado para crear dos moléculas de oxígeno. Después de cada reacción, el cloro vuelve a comenzar el ciclo destructivo con otra molécula de ozono. Un átomo de cloro puede así destruir miles de moléculas de ozono. Debido a que las moléculas de ozono se están descomponiendo son incapaces de absorber ninguna luz ultravioleta, por lo que experimentamos una radiación UV más intensa en la superficie de la tierra.
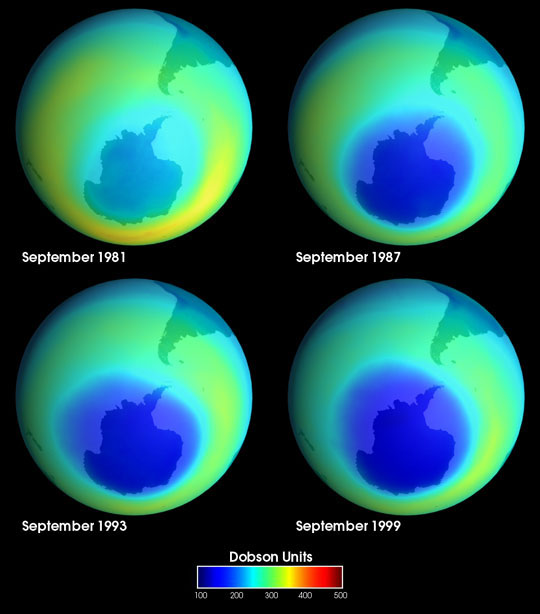
De 1985 a 1988, los investigadores que estudiaban las propiedades atmosféricas sobre el polo sur notaron continuamente concentraciones significativamente reducidas de ozono directamente sobre el continente de la Antártida. Durante tres años se asumió que los datos de ozono eran incorrectos y se debían a algún tipo de mal funcionamiento del instrumento. En 1988, los investigadores finalmente se dieron cuenta de su error y concluyeron que un enorme agujero en la capa de ozono efectivamente se había desarrollado sobre la Antártida. El examen de los datos satelitales de la NASA mostró posteriormente que el agujero había comenzado a desarrollarse a mediados de la década de 1970.
El agujero de ozono sobre la Antártida está formado por una gran cantidad de condiciones atmosféricas únicas en el continente que se combinan para crear un ambiente ideal para la destrucción del ozono.
- Debido a que la Antártida está rodeada de agua, los vientos sobre el continente soplan en una dirección única en el sentido de las agujas del reloj creando un llamado “vórtice polar” que contiene efectivamente una sola masa de aire estática sobre el continente. En consecuencia, el aire sobre la Antártida no se mezcla con el aire en el resto de la atmósfera terrestre.
- La Antártida tiene las temperaturas invernales más frías del planeta, llegando a menudo a -110 F. Estas temperaturas escalofriantes dan como resultado la formación de nubes estratosféricas polares (PSC's) que son un conglomerado de H 2 O y HNO 3 congelados. Debido a sus temperaturas extremadamente frías, los PSC forman una atracción electrostática con moléculas de CFC así como otros compuestos halogenados
A medida que llega la primavera a la Antártida, los PSC se funden en la estratosfera y liberan todos los compuestos halogenados que previamente fueron absorbidos en la nube. En el verano antártico, los fotones de alta energía son capaces de fotolizar los compuestos halogenados, liberando radicales halógenos que luego destruyen catalíticamente O 3. Debido a que la Antártida está constantemente rodeada por un vórtice polar, los halógenos radicales no pueden diluirse en todo el globo. El agujero de ozono se desarrolla como resultado de este proceso.
La investigación de Resent sugiere que la fuerza del vórtice polar de un año determinado se correlaciona directamente con el tamaño del agujero de ozono. En años con un fuerte vórtice polar, se observa que el orificio de ozono se expande en diámetro, mientras que en años con un vórtice polar más débil, se observa que el orificio de ozono se contrae
Sustancias que agotan el ozono
Las siguientes sustancias figuran como sustancias que agotan el ozono bajo el Título VI de la Ley de Aire Limpio de los Estados Unidos:
| Sustancia | Potencial de agotamiento de ozono |
|---|---|
| clorofluorocarbono-11 (CFC—11) | 1.0 |
| clorofluorocarbono-12 (CFC—12) | 1.0 |
| clorofluorocarbono-13 (CFC—13) | 1.0 |
| clorofluorocarbono-111 (CFC—111) | 1.0 |
| clorofluorocarbono-112 (CFC—112) | 1.0 |
| clorofluorocarbono-113 (CFC—113) | 0.8 |
| clorofluorocarbono-114 (CFC—114) | 1.0 |
| clorofluorocarbono-115 (CFC—115) | 0.6 |
| clorofluorocarbono-211 (CFC—211) | 1.0 |
| clorofluorocarbono-212 (CFC—212) | 1.0 |
| clorofluorocarbono-213 (CFC—213) | 1.0 |
| clorofluorocarbono-214 (CFC—214) | 1.0 |
| clorofluorocarbono-215 (CFC—215) | 1.0 |
| clorofluorocarbono-216 (CFC—216) | 1.0 |
| clorofluorocarbono-217 (CFC—217) | 1.0 |
| halón-1211 | 3.0 |
| halón-1301 | 10.0 |
| halón-2402 | 6.0 |
| tetracloruro de carbono | 1.1 |
| metilcloroformo | 0.1 |
| hidroclorofluorocarbono-22 (HCFC—22) | 0.05 |
| hidroclorofluorocarbono-123 (HCFC—123) | 0.02 |
| hidroclorofluorocarbono-124 (HCFC—124) | 0.02 |
| hidroclorofluorocarbono-141 (b) (HCFC—141 (b)) | 0.1 |
| hidroclorofluorocarbono-142 (b) (HCFC-142 (b)) | 0.06 |
Resumen
- Cualquier alteración del equilibrio que resulte en una mayor tasa de destrucción de ozono que la creación de ozono resultaría en el agotamiento del ozono.
- Algunos compuestos que liberan cloro o bromo cuando se exponen a luz UV intensa en la estratosfera contribuyen al agotamiento del ozono, y se denominan sustancias que agotan el ozono (ODS)
- El Protocolo de Montreal es un acuerdo internacional que comprometió a todas las partes (naciones signatarias) a un cronograma para eliminar la producción y el uso de CFC y otras sustancias conocidas por ser perjudiciales para la capa de ozono.
Colaboradores y Atribuciones
- Libretext: Supplemental Module, Physical and Theoretical Chemistry

