13.6: Lluvia ácida- Contaminación del Aire Contaminación del Agua
- Page ID
- 72395
- Describir la lluvia ácida y sus efectos.
La lluvia ácida es un término que se refiere a una mezcla de deposición húmeda y seca (material depositado) de la atmósfera (Figura\(\PageIndex{1}\)) que contiene cantidades superiores a lo normal de ácidos nítrico y sulfúrico. Los precursores, o precursores químicos, de la formación de lluvia ácida resultan tanto de fuentes naturales, como volcanes y vegetación en descomposición, como de fuentes artificiales, principalmente emisiones de dióxido de azufre (SO 2) y óxidos de nitrógeno (NO x) resultantes de la combustión de combustibles fósiles. La lluvia ácida ocurre cuando estos gases reaccionan en la atmósfera con agua, oxígeno y otros químicos para formar diversos compuestos ácidos. El resultado es una solución suave de ácido sulfúrico y ácido nítrico.
\[SO_2 + HOH \rightarrow H_2SO_3 \label{1} \]
\[2 NO_2 + HOH \rightarrow HNO_2 + HNO_3 \label{2} \]
Cuando se liberan dióxido de azufre y óxidos de nitrógeno de las centrales eléctricas y otras fuentes, los vientos predominantes soplan estos compuestos a través de las fronteras estatales y nacionales, a veces a lo largo de cientos de millas
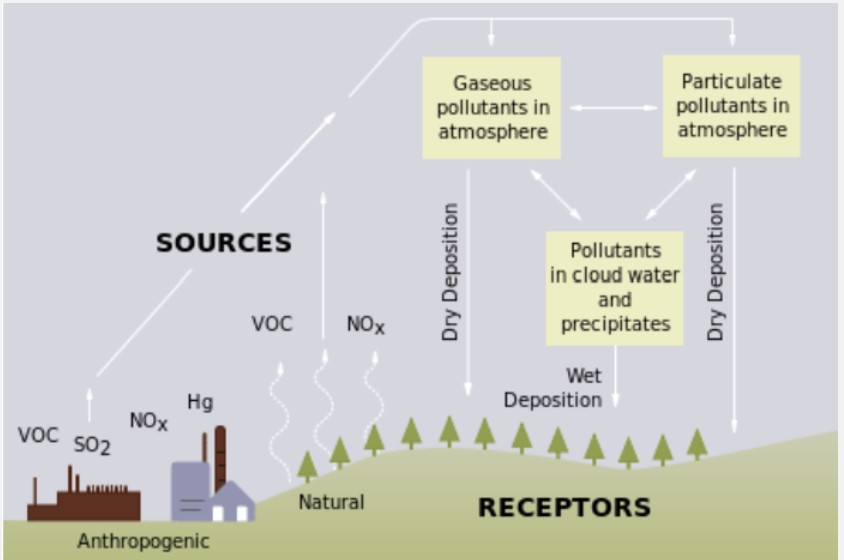
La lluvia ácida se mide usando una escala llamada “pH”. Cuanto menor sea el pH de una sustancia, más ácida es. El agua pura tiene un pH de 7.0. Sin embargo, la lluvia normal es ligeramente ácida debido a que el dióxido de carbono (CO 2) se disuelve formando ácido carbónico débil, dando a la mezcla resultante un pH de aproximadamente 5.6 a concentraciones atmosféricas típicas de CO 2. A partir del año 2000, la lluvia más ácida que cae en Estados Unidos tiene un pH de aproximadamente 4.3.
Efectos de la Lluvia Acida
La lluvia ácida provoca la acidificación de lagos y arroyos y contribuye al daño de los árboles en elevaciones altas (por ejemplo, abetos rojos por encima de los 2,000 pies) y muchos suelos forestales sensibles. Además, la lluvia ácida acelera la descomposición de los materiales de construcción y pinturas, incluyendo edificios irremplazables, estatuas y esculturas que forman parte del patrimonio cultural de nuestra nación. Antes de caer a la tierra, los gases de dióxido de azufre (SO 2) y óxido de nitrógeno (NO x) y sus derivados de materia particulada, sulfatos y nitratos, contribuyen a la degradación de la visibilidad y dañan la salud pública.
Los efectos ecológicos de la lluvia ácida se ven más claramente en los ambientes acuáticos, o acuáticos, como arroyos, lagos y marismas. La mayoría de los lagos y arroyos tienen un pH entre 6 y 8, aunque algunos lagos son naturalmente ácidos incluso sin los efectos de la lluvia ácida. La lluvia ácida afecta principalmente a cuerpos de agua sensibles, los cuales se encuentran en cuencas cuyos suelos tienen una capacidad limitada para neutralizar compuestos ácidos (llamados “capacidad amortiguadora”). Los lagos y arroyos se vuelven ácidos (es decir, el valor del pH disminuye) cuando el agua misma y su suelo circundante no pueden amortiguar la lluvia ácida lo suficiente como para neutralizarla. En áreas donde la capacidad de amortiguación es baja, la lluvia ácida libera aluminio de los suelos a lagos y arroyos; el aluminio es altamente tóxico para muchas especies de organismos acuáticos. La lluvia ácida provoca un crecimiento más lento, lesiones o muerte de los bosques como se muestra en la Figura\(\PageIndex{2}\). Por supuesto, la lluvia ácida no es la única causa de este tipo de condiciones. Otros factores contribuyen al estrés general de estas áreas, incluyendo contaminantes del aire, insectos, enfermedades, sequía o clima muy frío. En la mayoría de los casos, de hecho, los impactos de la lluvia ácida en los árboles se deben a los efectos combinados de la lluvia ácida y estos otros factores estresantes ambientales.

La lluvia ácida y la deposición seca de partículas ácidas contribuyen a la corrosión de los metales (como el bronce).
El daño que causa la lluvia ácida a los edificios y esculturas de piedra caliza y mármol se debe a una reacción clásica de base ácida. El mármol y la piedra caliza consisten en carbonato de calcio (CaCo 3), una sal derivada del ácido débil H 2 CO 3. La reacción de un ácido fuerte con una sal de un ácido débil va a completarse. Así podemos escribir la reacción de piedra caliza o mármol con ácido sulfúrico diluido de la siguiente manera:
\[CaCO_{3(s)} + H_2SO_{4(aq)} \rightarrow CaSO_{4(s)} + H_2O_{(l)} + CO_{2(g)} \label{3} \]
Debido a que el CaSO 4 es escasamente soluble en agua, el resultado neto de esta reacción es disolver el mármol o la piedra caliza.
Estos efectos reducen significativamente el valor social de edificios, puentes, objetos culturales (como estatuas, monumentos y lápidas) y automóviles (Figura\(\PageIndex{3}\)).

Los sulfatos y nitratos que se forman en la atmósfera a partir de las emisiones de dióxido de azufre (SO 2) y óxidos de nitrógeno (NO x) contribuyen al deterioro de la visibilidad, lo que significa que no podemos ver tan lejos ni con tanta claridad a través del aire. Los contaminantes que causan la lluvia ácida —dióxido de azufre (SO 2) y óxidos de nitrógeno (NO x) —dañan la salud humana. Estos gases interactúan en la atmósfera para formar finas partículas de sulfato y nitrato que pueden ser transportadas largas distancias por los vientos e inhaladas profundamente en los pulmones de las personas. Las partículas finas también pueden penetrar en interiores. Muchos estudios científicos han identificado una relación entre los niveles elevados de partículas finas y el aumento de la enfermedad y la muerte prematura por trastornos cardíacos y pulmonares, como el asma y la bronquitis.
Resumen
- La lluvia ácida es un término que se refiere a una mezcla de deposición húmeda y seca (material depositado) de la atmósfera que contiene cantidades superiores a lo normal de ácidos nítrico y sulfúrico.
- El agua de lluvia ácida en el suelo, arroyos, lagos y marismas (y otros cuerpos de agua) puede ser dañina para árboles, plantas, animales, especialmente plantas y animales acuáticos.
- La lluvia ácida y la deposición seca de partículas ácidas contribuyen a la corrosión de los metales (como el bronce) y al deterioro de la pintura y la piedra (como el mármol y la piedra caliza).
Colaboradores y Atribuciones
- Essentials of Environmental Science by Kamala Doršner is licensed under CC BY 4.0. Modified from the original by Matthew R. Fisher.
- Charles Ophardt, Professor Emeritus, Elmhurst College
- Virtual Chembook
- TextMap: General Chemistry (Averill and Eldredge)

