16.4: Proteínas- Polímeros de Aminoácidos
- Page ID
- 72562
- Identificar diferentes aminoácidos.
- Describir cómo se forman las proteínas de cadena corta (polipéptidos) a partir de aminoácidos.
Las proteínas pueden definirse como compuestos de alta masa molar que consisten en gran parte o completamente en cadenas de aminoácidos. Sus masas van desde varios miles hasta varios millones de daltons (Da). Además de los átomos de carbono, hidrógeno y oxígeno, todas las proteínas contienen átomos de nitrógeno y azufre, y muchas también contienen átomos de fósforo y trazas de otros elementos. Las proteínas cumplen una variedad de funciones en los organismos vivos y a menudo se clasifican por estos roles biológicos. El tejido muscular es en gran parte proteína, al igual que la piel y el cabello. Las proteínas están presentes en la sangre, en el cerebro e incluso en el esmalte dental. Cada tipo de célula en nuestros cuerpos elabora sus propias proteínas especializadas, así como proteínas comunes a todas o a la mayoría de las células. Comenzamos nuestro estudio de las proteínas analizando las propiedades y reacciones de los aminoácidos, a lo que le sigue una discusión sobre cómo los aminoácidos se unen covalentemente para formar péptidos y proteínas. Terminamos el capítulo con una discusión de enzimas, las proteínas que actúan como catalizadores en el cuerpo.
Las proteínas en todas las especies vivas, desde bacterias hasta humanos, se construyen a partir del mismo conjunto de 20 aminoácidos, llamados así porque cada una contiene un grupo amino unido a un ácido carboxílico. Los aminoácidos en las proteínas son α-aminoácidos, lo que significa que el grupo amino está unido al α-carbono del ácido carboxílico. Los humanos pueden sintetizar solo aproximadamente la mitad de los aminoácidos necesarios; el resto debe obtenerse de la dieta y se conocen como aminoácidos esenciales. Sin embargo, se han encontrado dos aminoácidos adicionales en cantidades limitadas en proteínas: La selenocisteína se descubrió en 1986, mientras que la pirrolisina se descubrió en 2002.
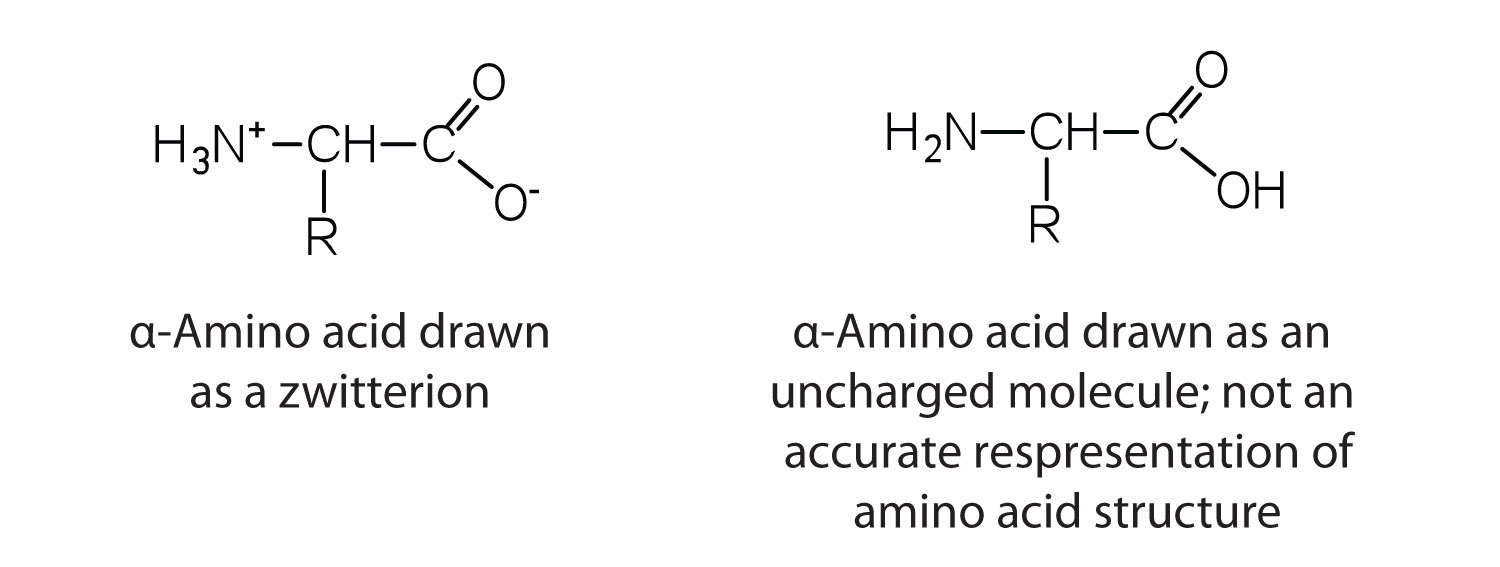
Los aminoácidos son incoloros, no volátiles, sólidos cristalinos, fundiendo y descomponiéndose a temperaturas superiores a 200°C, estas temperaturas de fusión son más parecidas a las de sales inorgánicas que a las de aminas o ácidos orgánicos e indican que las estructuras de los aminoácidos en estado sólido y en neutro se representan mejor como teniendo tanto un grupo cargado negativamente como un grupo cargado positivamente. Tal especie es conocida como zwitterion.
Clasificación
Además de los grupos amino y carboxilo, los aminoácidos tienen una cadena lateral o grupo R unido al carbono α. Cada aminoácido tiene características únicas derivadas del tamaño, forma, solubilidad y propiedades de ionización de su grupo R. Como resultado, las cadenas laterales de los aminoácidos ejercen un profundo efecto sobre la estructura y actividad biológica de las proteínas. Aunque los aminoácidos se pueden clasificar de varias maneras, un enfoque común es clasificarlos de acuerdo a si el grupo funcional en la cadena lateral a pH neutro es no polar, polar pero sin carga, cargado negativamente o cargado positivamente. Las estructuras y nombres de los 20 aminoácidos, sus abreviaturas de una y tres letras, y algunas de sus características distintivas se dan en la Tabla\(\PageIndex{1}\).
| Nombre común | Abreviatura | Fórmula estructural (a pH 6) | Masa molar | Característica distintiva |
|---|---|---|---|---|
| Aminoácidos con un grupo R no polar | ||||
| glicina | gly (G) | 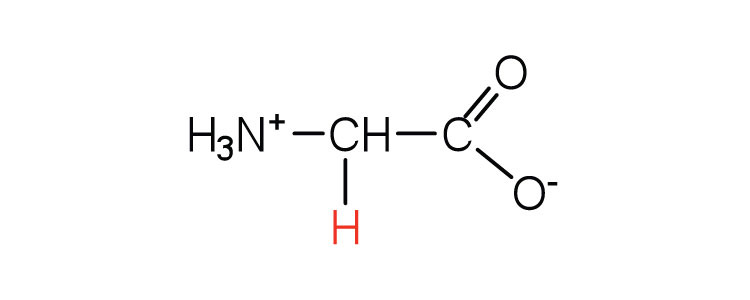 |
75 | el único aminoácido que carece de carbono quiral |
| alanina | ala (A) | 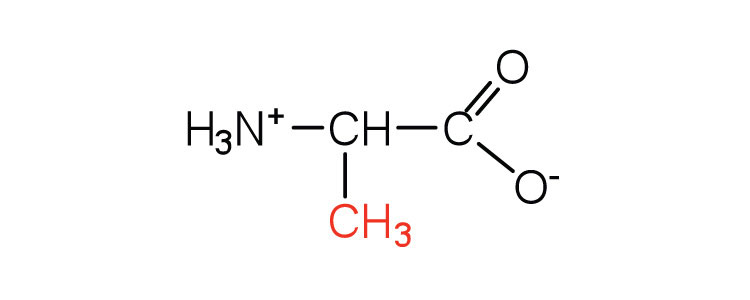 |
89 | — |
| valina | val (V) | 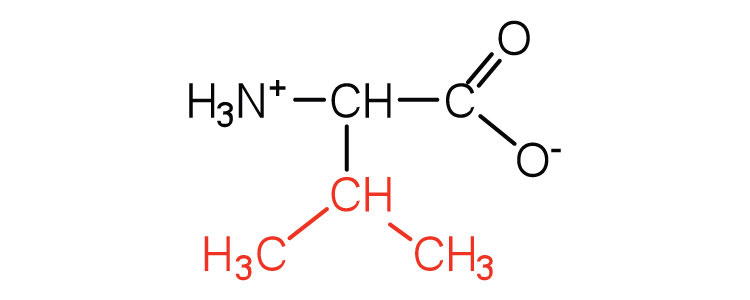 |
117 | un aminoácido de cadena ramificada |
| leucina | leu (L) | 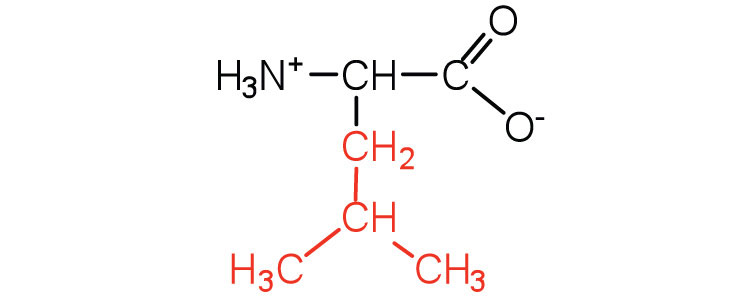 |
131 | un aminoácido de cadena ramificada |
| isoleucina | ile (I) | 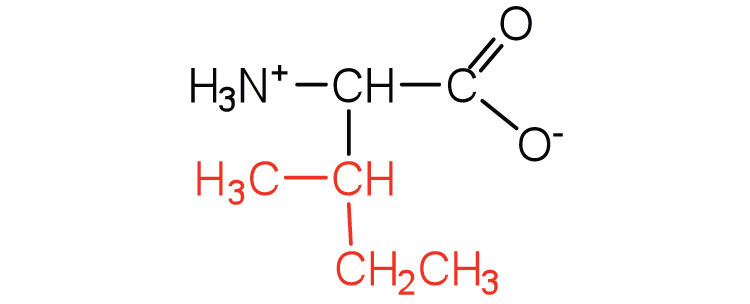 |
131 | un aminoácido esencial porque la mayoría de los animales no pueden sintetizar aminoácidos de cadena ramificada |
| fenilalanina | phe (F) | 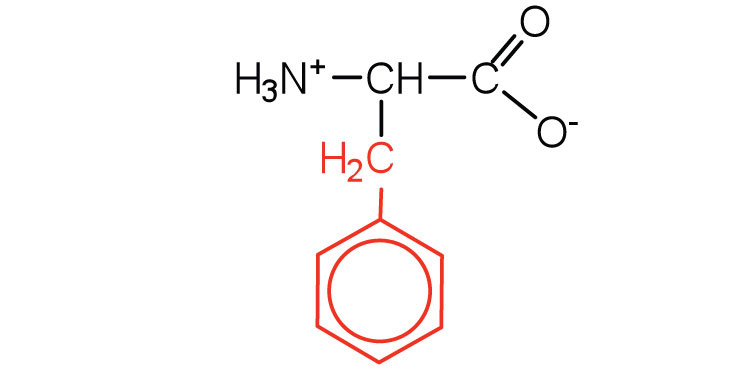 |
165 | también clasificado como un aminoácido aromático |
| triptófano | trp (W) | 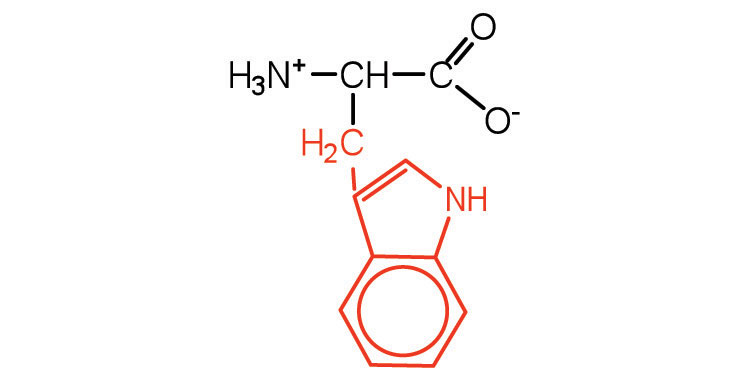 |
204 | también clasificado como un aminoácido aromático |
| metionina | con (M) | 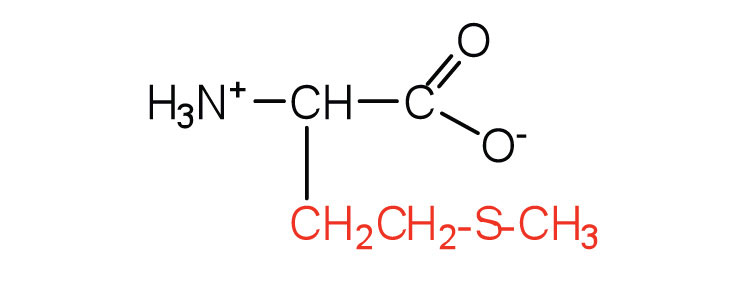 |
149 | funciones de la cadena lateral como donante del grupo metilo |
| prolina | pro (P) | 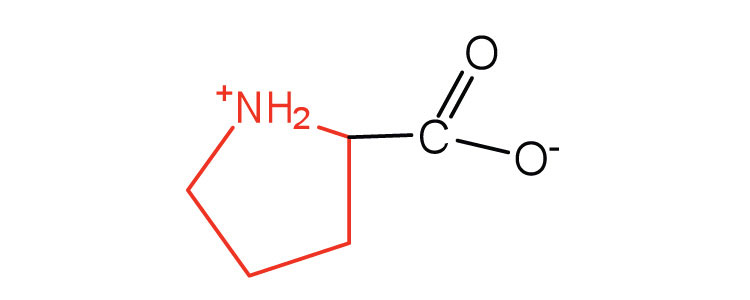 |
115 | contiene un grupo amina secundaria; denominado ácido α-imino |
| Aminoácidos con un grupo R polar pero neutro | ||||
| serina | ser (S) | 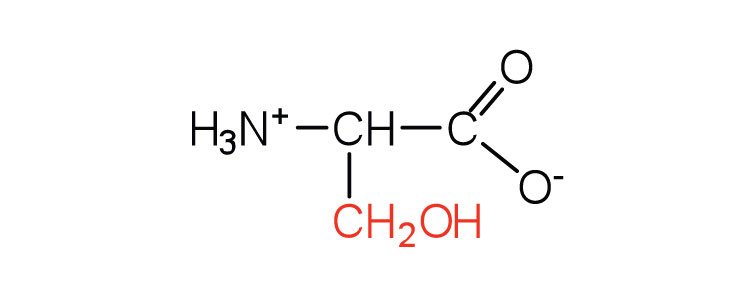 |
105 | encontrado en el sitio activo de muchas enzimas |
| treonina | thr (T) | 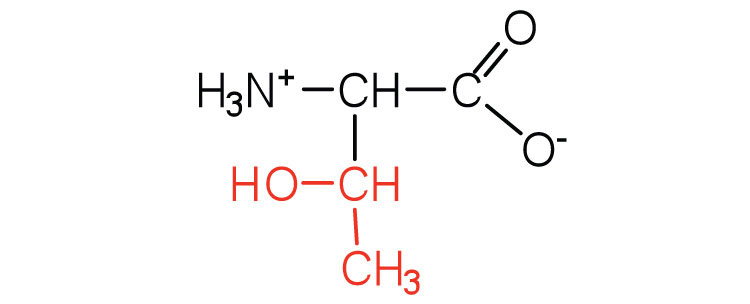 |
119 | llamado así por su similitud con la treosa de azúcar |
| cisteína | cys (C) | 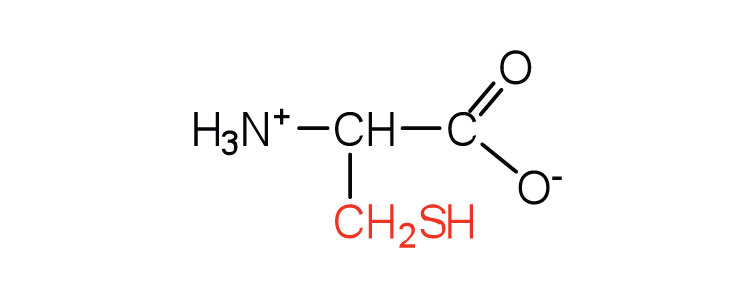 |
121 | la oxidación de dos moléculas de cisteína produce cistina |
| tirosina | tyr (Y) | 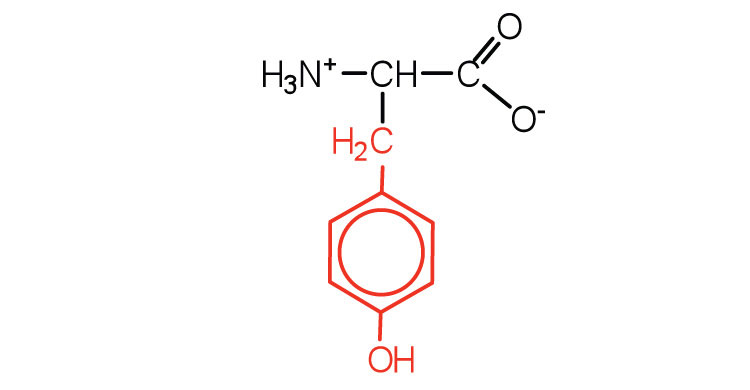 |
181 | también clasificado como un aminoácido aromático |
| asparagina | asn (N) | 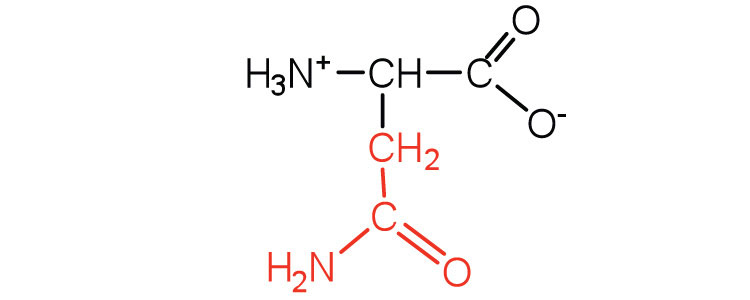 |
132 | la amida del ácido aspártico |
| glutamina | gln (Q) | 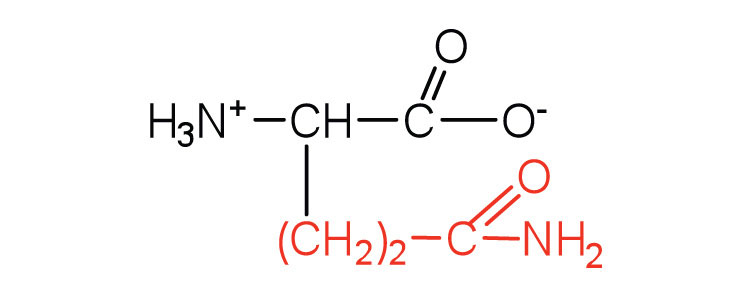 |
146 | la amida del ácido glutámico |
| Aminoácidos con un grupo R cargado negativamente | ||||
| ácido aspártico | asp (D) | 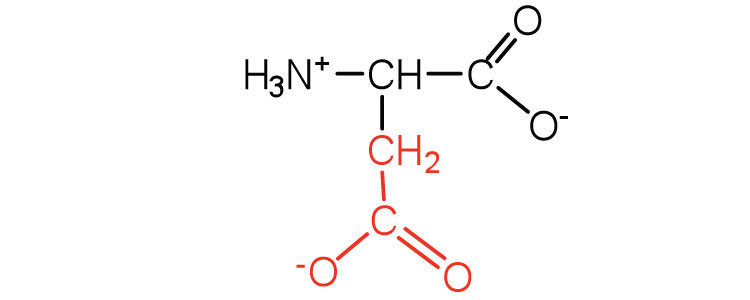 |
132 | los grupos carboxilo se ionizan a pH fisiológico; también conocido como aspartato |
| ácido glutámico | glu (E) | 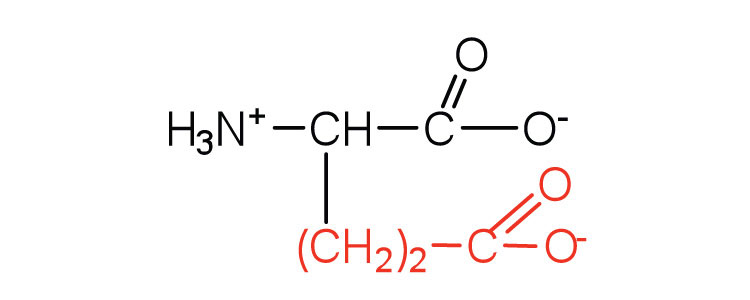 |
146 | los grupos carboxilo se ionizan a pH fisiológico; también conocido como glutamato |
| Aminoácidos con un grupo R cargado positivamente | ||||
| histidina | su (H) | 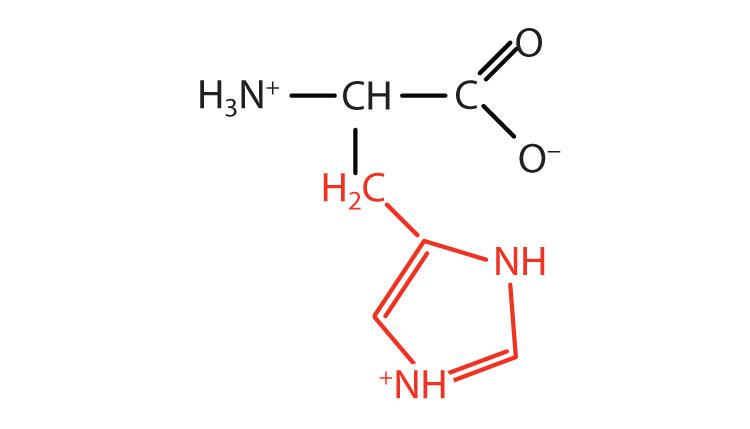 |
155 | el único aminoácido cuyo grupo R tiene un pH pK a (6.0) cercano a fisiológico |
| lisina | lys (K) | 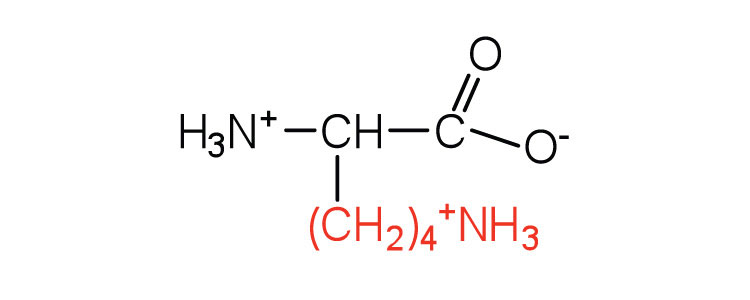 |
147 | — |
| arginina | arg (R) | 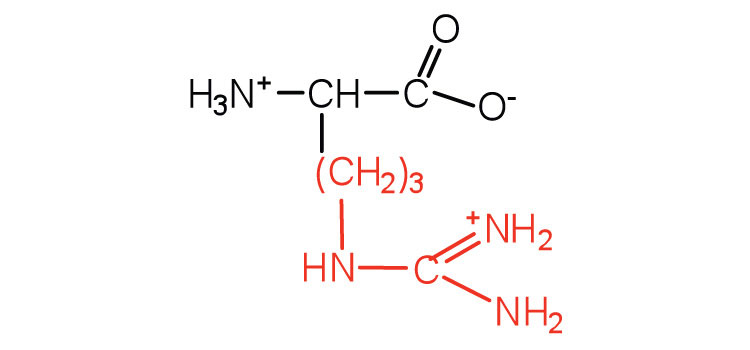 |
175 | una base casi tan fuerte como el hidróxido de sodio |
El primer aminoácido que se aisló fue la asparagina en 1806. Se obtuvo de la proteína que se encuentra en el jugo de espárragos (de ahí el nombre). La glicina, el principal aminoácido que se encuentra en la gelatina, fue nombrada por su sabor dulce (glykys griegos, que significa “dulce”). En algunos casos, un aminoácido que se encuentra en una proteína es en realidad un derivado de uno de los 20 aminoácidos comunes (uno de esos derivados es la hidroxiprolina). La modificación ocurre después de que el aminoácido ha sido ensamblado en una proteína.
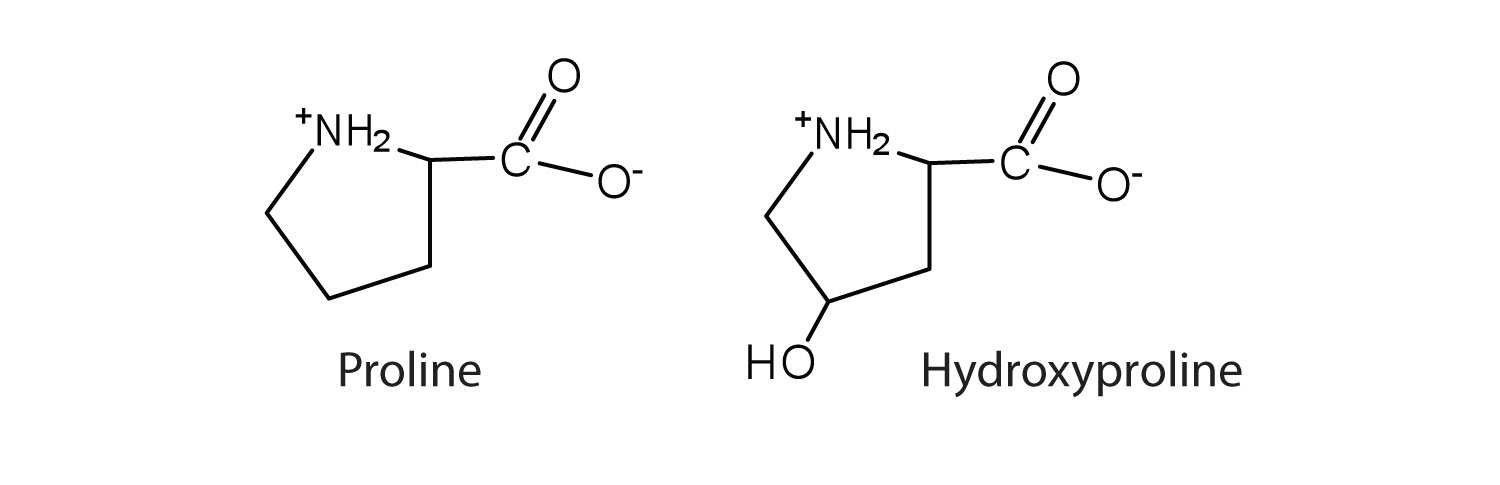
Zwitteriones
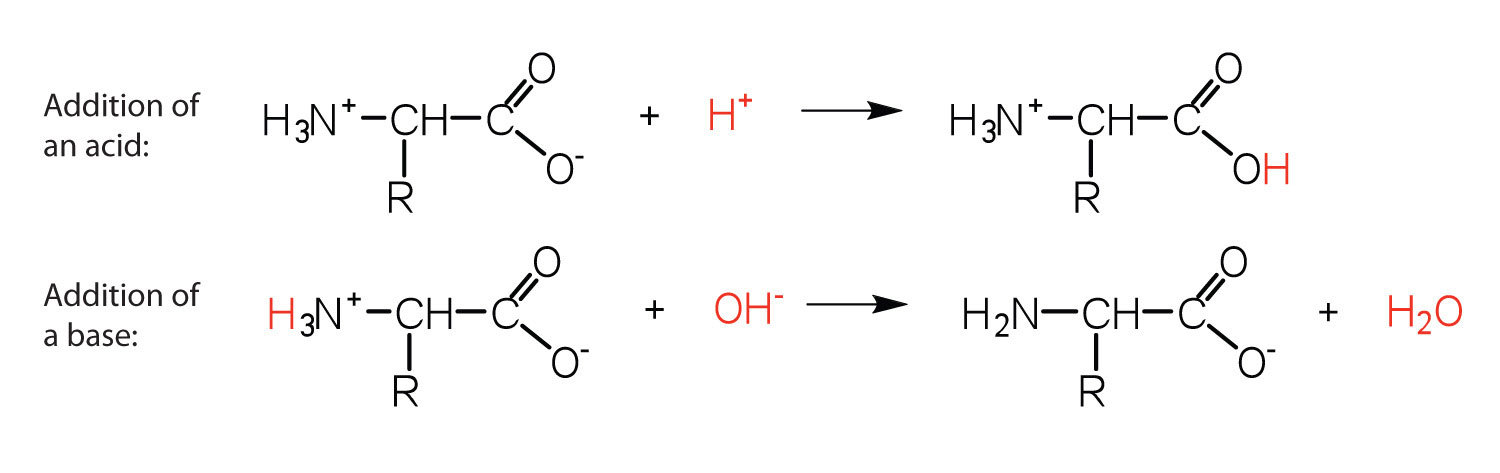
La estructura de un aminoácido le permite actuar tanto como ácido como base. Un aminoácido tiene esta capacidad porque a un cierto valor de pH (diferente para cada aminoácido) casi todas las moléculas de aminoácidos existen como zwitteriones. Si se agrega ácido a una solución que contiene el zwitterión, el grupo carboxilato captura un ion hidrógeno (H +), y el aminoácido se carga positivamente. Si se agrega base, la eliminación de iones del ion H + del grupo amino del zwitterión produce un aminoácido cargado negativamente. En ambas circunstancias, el aminoácido actúa para mantener el pH del sistema, es decir, para eliminar el ácido agregado (H +) o la base (OH −) de la solución.
El enlace peptídico: péptidos y proteínas
Dos o más aminoácidos pueden unirse en cadenas llamadas péptidos. Anteriormente, se discutió la reacción entre amoníaco y un ácido carboxílico para formar una amida. En una reacción similar, el grupo amino de una molécula de aminoácido reacciona con el grupo carboxilo en otra, liberando una molécula de agua y formando un enlace amida como se muestra en la Figura.\(\PageIndex{1}\)
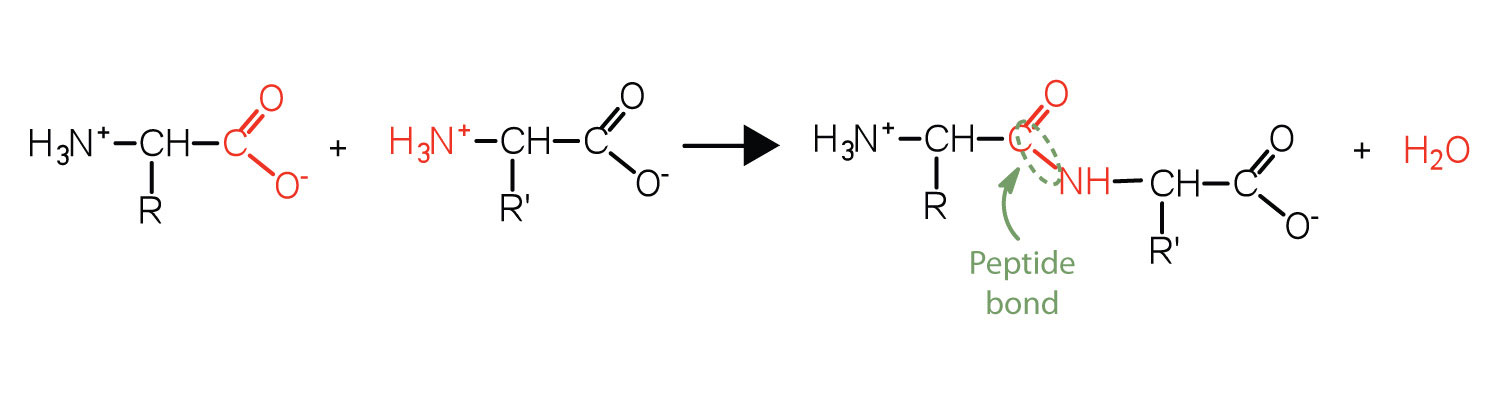
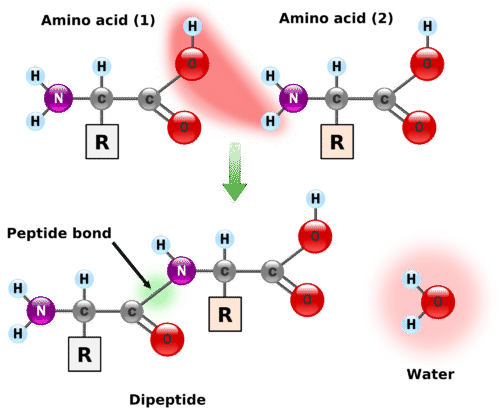
Un enlace amida que une dos unidades de aminoácidos se denomina enlace peptídico. Tenga en cuenta que la molécula producto todavía tiene un grupo amino reactivo a la izquierda y un grupo carboxilo reactivo a la derecha. Estos pueden reaccionar con aminoácidos adicionales para alargar el péptido. El proceso puede continuar hasta que miles de unidades se hayan unido, resultando en proteínas grandes.
Una cadena que consta de solo dos unidades de aminoácidos se llama dipéptido; una cadena que consiste en tres es un tripéptido. Por convención, las estructuras peptídicas y proteicas se representan con el aminoácido cuyo grupo amino está libre (el extremo N-terminal) a la izquierda y el aminoácido con un grupo carboxilo libre (el extremo C-terminal) a la derecha.
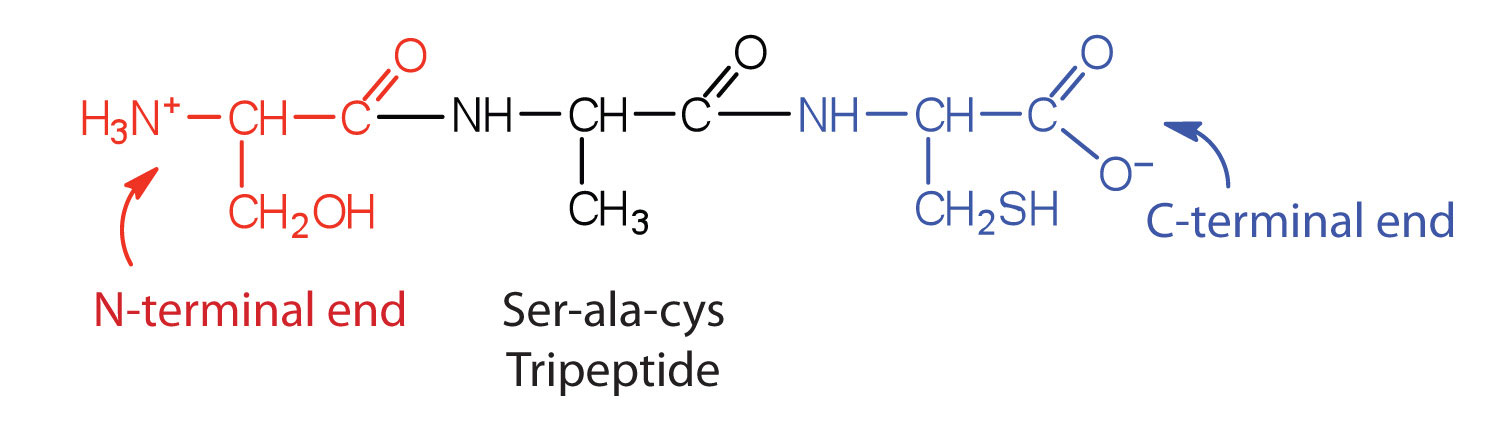
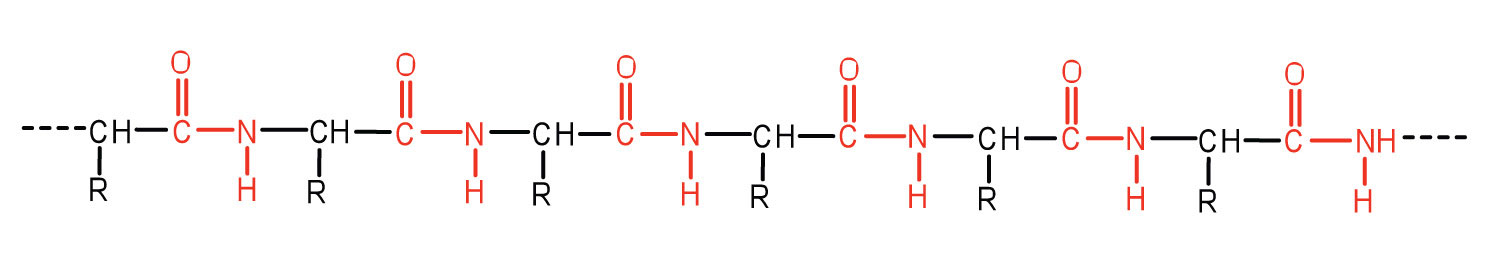
El término general péptido se refiere a una cadena de aminoácidos de longitud no especificada. Sin embargo, las cadenas de aproximadamente 50 aminoácidos o más generalmente se denominan proteínas o polipéptidos. En su forma fisiológicamente activa, una proteína puede estar compuesta por una o más cadenas polipeptídicas.
Las células peptídicas en nuestros cuerpos tienen un mecanismo intrincado para la fabricación de proteínas. Los humanos tienen que utilizar otras técnicas para sintetizar las mismas proteínas en un laboratorio. La química de la síntesis de péptidos es complicada. Ambos grupos activos en un aminoácido pueden reaccionar y la secuencia de aminoácidos debe ser específica para que la proteína funcione. Robert Merrifield desarrolló el primer enfoque sintético para hacer proteínas en el laboratorio, un enfoque manual que fue largo y tedioso (y, ganó el Premio Nobel de Química en 1984 por su trabajo). Hoy en día, sin embargo, los sistemas automatizados pueden producir un péptido en un período de tiempo muy corto.
La Secuencia de Aminoácidos
La secuencia particular de aminoácidos en una cadena más larga se denomina secuencia de aminoácidos. Por convención, la secuencia de aminoácidos se enumera en el orden tal que el grupo amina libre está en el extremo izquierdo de la molécula y el grupo carboxilo libre está en el extremo derecho de la molécula.
Por ejemplo, supongamos que se forma una secuencia de los aminoácidos glicina, triptófano y alanina con el grupo amina libre como parte de la glicina y el grupo carboxilo libre como parte de la alanina. La secuencia de aminoácidos se puede escribir fácilmente usando las abreviaturas como Gly-Trp-Ala. Esta es una secuencia diferente de Ala-Trp-Gly porque los grupos amina y carboxilo libres estarían en diferentes aminoácidos en ese caso.
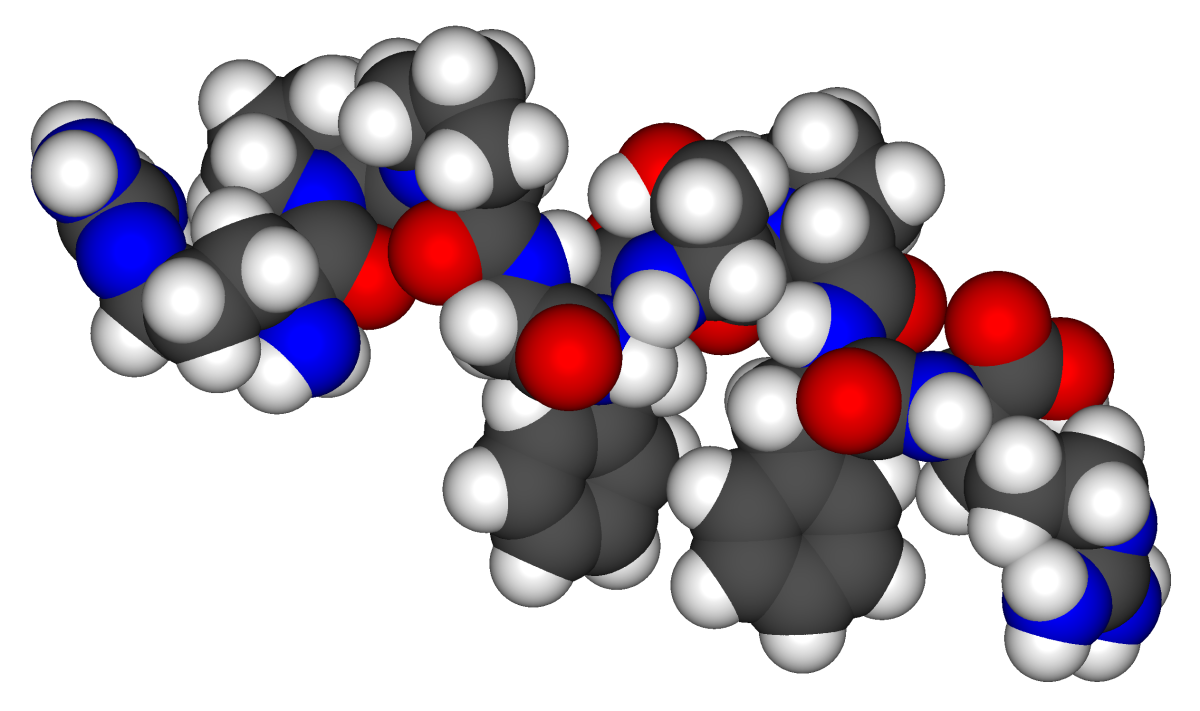
Para que los péptidos y proteínas sean fisiológicamente activos, no es suficiente que incorporen ciertas cantidades de aminoácidos específicos. El orden, o secuencia, en la que están conectados los aminoácidos también es de importancia crítica. La bradiquinina es un péptido de nueve aminoácidos (Figura\(\PageIndex{2}\)) producido en la sangre que tiene la siguiente secuencia de aminoácidos:
arg-pro-gly-phe-ser-pro-phe-arg
Este péptido disminuye la presión arterial, estimula el tejido muscular liso, aumenta la permeabilidad capilar y causa dolor. Cuando se invierte el orden de los aminoácidos en la bradiquinina,
arg-phe-pro-ser-phe-gly-pro-pro-arg
el péptido resultante de esta síntesis no muestra ninguna actividad de la bradiquinina.
Así como millones de palabras diferentes se escriben con nuestro alfabeto inglés de 26 letras, millones de proteínas diferentes se elaboran con los 20 aminoácidos comunes. Sin embargo, así como el alfabeto inglés se puede usar para escribir galimatías, los aminoácidos se pueden juntar en la secuencia incorrecta para producir proteínas no funcionales. Aunque la secuencia correcta es normalmente de suma importancia, no siempre es absolutamente necesaria. Así como a veces puede dar sentido a las palabras escritas incorrectamente en inglés, una proteína con un pequeño porcentaje de aminoácidos “incorrectos” puede seguir funcionando. Sin embargo, rara vez funciona así como una proteína que tiene la secuencia correcta. También hay casos en los que aparentemente menores errores de secuencia tienen efectos desastrosos. Por ejemplo, en algunas personas, cada molécula de hemoglobina (una proteína en la sangre que transporta oxígeno) tiene una sola unidad de aminoácido incorrecta de aproximadamente 300 (una sola valina reemplaza a un ácido glutámico). Ese error “menor” es responsable de la anemia falciforme, una afección hereditaria que suele ser fatal.
Dibujar el polipéptido Asp-Val-Ser.
Solución
1. Identificar las estructuras de cada uno de los tres aminoácidos dados y dibujarlos en el mismo orden dado en el nombre.
2. Dejando el orden igual, conectar los aminoácidos entre sí formando enlaces peptídicos. Tenga en cuenta que el orden dado en el nombre es de la misma manera que los aminoácidos están conectados en la molécula. El primero en la lista es siempre el\(\ce{N}\) extremo terminal del polipéptido.
Enumere todos los posibles polipéptidos que se pueden formar a partir de cisteína (Cys), leucina (Leu) y arginina (Arg).
Solución
Aunque solo hay tres aminoácidos, el orden en el que están unidos cambia la identidad, propiedades y función del polipéptido resultante. Hay seis posibles polipéptidos formados a partir de estos tres aminoácidos.
Cys-Leu-Arg
Cys-Arg-Leu
Leu-Cys-Arg
Leu-Arg-Cys
Arg-Cys-Leu
Arg-Leu-Cys
Dibuja la estructura para cada péptido.
- gly-val
- val-gly
RESPUESTAS
a.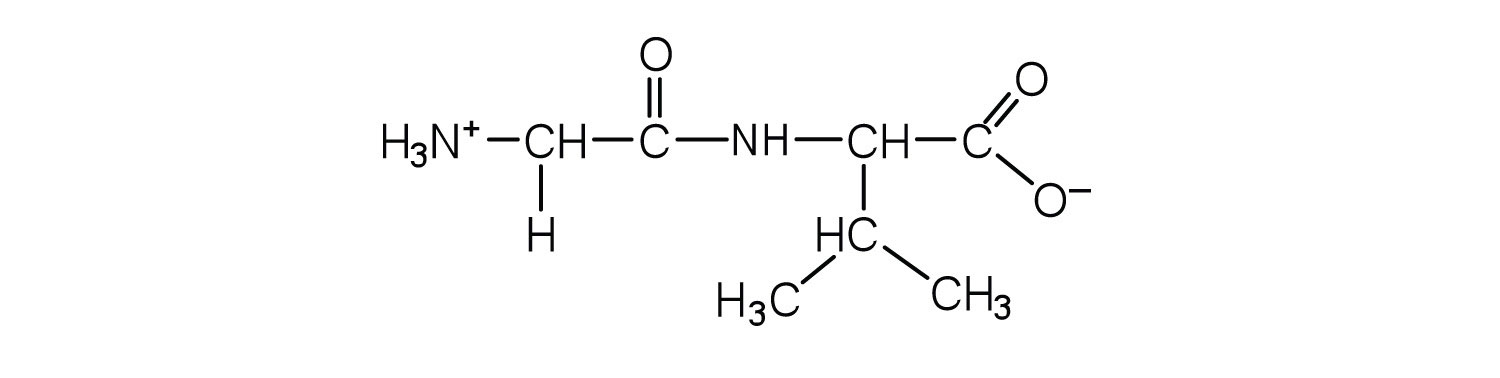
b.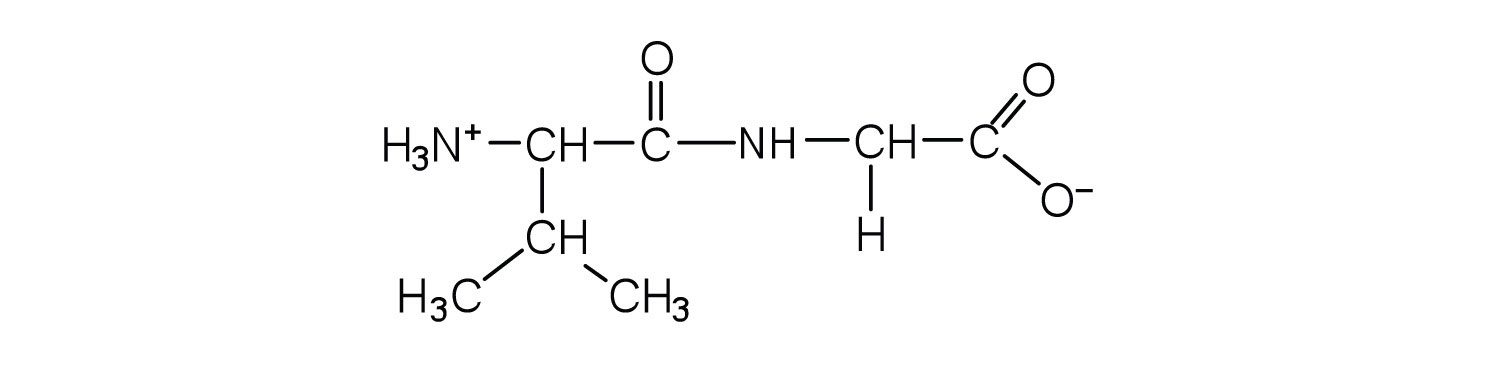
Resumen
- El grupo amino de un aminoácido puede reaccionar con el grupo carboxilo en otro aminoácido para formar un enlace peptídico que une los dos aminoácidos entre sí.
- Se pueden añadir aminoácidos adicionales a través de la formación de enlaces peptídicos de adición (amida).
- Una cadena que consta de solo dos unidades de aminoácidos se llama dipéptido; una cadena que consiste en tres es un tripéptido.
- Las cadenas de aproximadamente 50 aminoácidos o más se suelen llamar proteínas o polipéptidos.
- Una secuencia de aminoácidos en un péptido o proteína se escribe con el aminoácido N-terminal primero y el aminoácido C-terminal al final (escribiendo de izquierda a derecha).
- El orden, o secuencia, en la que están conectados los aminoácidos también es de importancia crítica para que un péptido o proteína sea fisiológicamente activo.
Colaboradores y Atribuciones
- Libretext: The Basics of GOB Chemistry (Ball et al.)
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)




