16.5: Estructura y Función de las Proteínas
- Page ID
- 72594
- Describir los cuatro niveles de estructura proteica.
- Identificar los tipos de interacciones atractivas que mantienen las proteínas en su estructura tridimensional más estable
- Explicar el papel de una enzima en el cuerpo.
Cada una de las miles de proteínas naturales tiene su propia composición y secuencia de aminoácidos características que dan como resultado una forma tridimensional única. Desde la década de 1950, los científicos han determinado las secuencias de aminoácidos y la conformación tridimensional de numerosas proteínas y así han obtenido importantes pistas sobre cómo cada proteína realiza su función específica en el cuerpo.
Las proteínas son compuestos de alta masa molar que consisten en gran parte o en su totalidad por cadenas de aminoácidos. Debido a su gran complejidad, las moléculas proteicas no pueden clasificarse sobre la base de similitudes estructurales específicas, ya que se clasifican los carbohidratos y los lípidos. Las dos principales clasificaciones estructurales de las proteínas se basan en cualidades mucho más generales: si la proteína es (1) similar a la fibra e insoluble o (2) globular y soluble. Algunas proteínas, como las que componen el cabello, la piel, los músculos y el tejido conectivo, son similares a las fibras. Estas proteínas fibrosas son insolubles en agua y generalmente cumplen funciones estructurales, conectivas y protectoras. Ejemplos de proteínas fibrosas son queratinas, colágenos, miosinas y elastinas. El cabello y la capa externa de la piel están compuestos de queratina. Los tejidos conectivos contienen colágeno. Las miosinas son proteínas musculares y son capaces de contracción y extensión. Las elastinas se encuentran en los ligamentos y el tejido elástico de las paredes arteriales.
Las proteínas globulares, la otra clase principal, son solubles en medios acuosos. En estas proteínas, las cadenas se pliegan de manera que la molécula en su conjunto es aproximadamente esférica. Los ejemplos familiares incluyen albúmina de huevo de claras de huevo y albúmina sérica en sangre. La albúmina sérica juega un papel importante en el transporte de ácidos grasos y en el mantenimiento de un equilibrio adecuado de las presiones osmóticas en el organismo. La hemoglobina y la mioglobina, que son importantes para unir oxígeno, también son proteínas globulares.
Niveles de estructura proteica
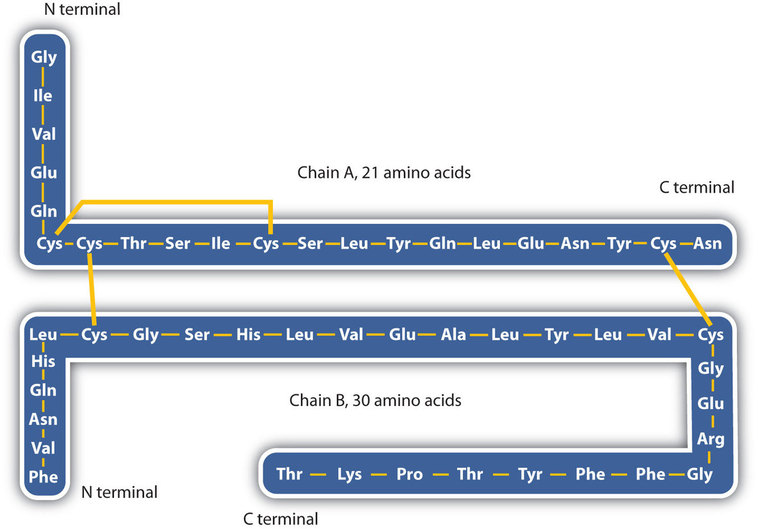
La estructura de las proteínas se describe generalmente como que tiene cuatro niveles organizacionales. El primero de ellos es la estructura primaria, que es el número y secuencia de aminoácidos en la cadena o cadenas polipeptídicas de una proteína, comenzando con el grupo amino libre y mantenido por los enlaces peptídicos que conectan cada aminoácido con el siguiente. La estructura primaria de la insulina, compuesta por 51 aminoácidos, se muestra en la Figura\(\PageIndex{1}\).
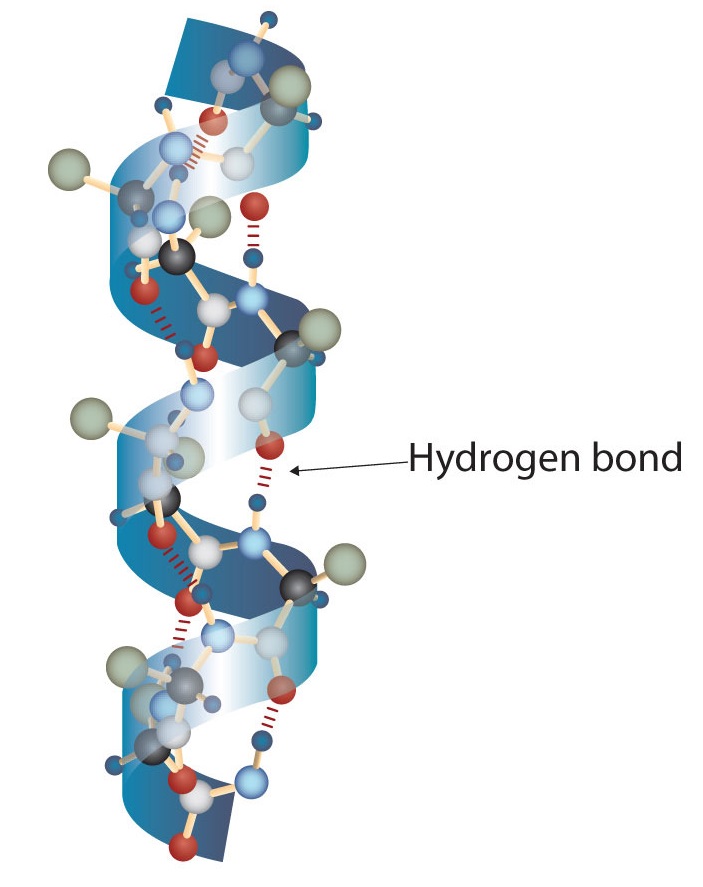
Una molécula de proteína no es una maraña aleatoria de cadenas polipeptídicas. En cambio, las cadenas están dispuestas en conformaciones únicas pero específicas. El término estructura secundaria se refiere a la disposición fija del esqueleto polipeptídico. A partir de estudios de rayos X, Linus Pauling y Robert Corey postularon que ciertas proteínas o porciones de proteínas se tuercen en espiral o hélice. Esta hélice se estabiliza mediante enlaces de hidrógeno intracatenarios entre el átomo de oxígeno carbonilo de un aminoácido y el átomo de hidrógeno de amida cuatro aminoácidos en la cadena (ubicado en el siguiente giro de la hélice) y se conoce como hélice α diestra. Los datos de rayos X indican que esta hélice hace un giro por cada 3.6 aminoácidos, y las cadenas laterales de estos aminoácidos se proyectan hacia afuera desde la cadena principal enrollada (Figura\(\PageIndex{2}\)). Las α-queratinas, que se encuentran en el pelo y la lana, son exclusivamente α-helicoidales en conformación. Algunas proteínas, como la gammaglobulina, la quimotripsina y el citocromo c, tienen poca o ninguna estructura helicoidal. Otras, como la hemoglobina y la mioglobina, son helicoidales en ciertas regiones pero no en otras.
Otro tipo común de estructura secundaria, llamada conformación de lámina plisada β, es una disposición laminar en la que dos o más cadenas polipeptídicas extendidas (o regiones separadas en la misma cadena) están alineadas una al lado de la otra. Los segmentos alineados pueden correr paralelos o antiparalelos, es decir, los terminales N pueden estar orientados en la misma dirección en cadenas adyacentes o en diferentes direcciones, y están conectados por enlaces de hidrógeno entre cadenas (Figura\(\PageIndex{3}\)). La lámina plisada β es particularmente importante en proteínas estructurales, como la fibroína de seda. También se observa en porciones de muchas enzimas, como la carboxipeptidasa A y la lisozima.

La estructura terciaria se refiere a la forma tridimensional única de la proteína como un todo, que resulta del plegamiento y flexión de la cadena principal de la proteína. La estructura terciaria está íntimamente ligada al correcto funcionamiento bioquímico de la proteína. La Figura\(\PageIndex{4}\) muestra una representación de la estructura tridimensional de la insulina.

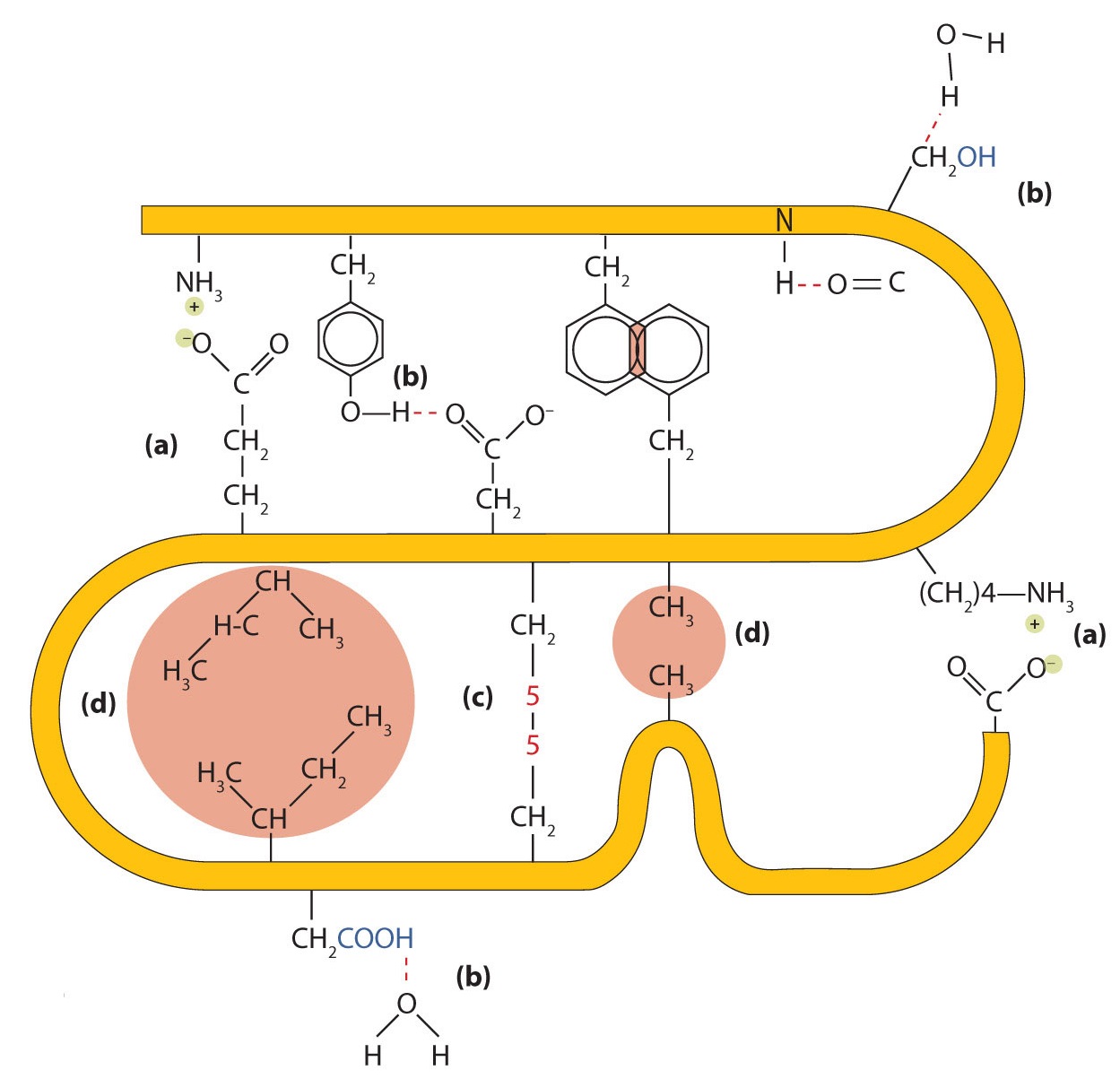
Cuatro tipos principales de interacciones atractivas determinan la forma y estabilidad de la estructura terciaria de las proteínas.
Estudiaste varios de ellos previamente.
- Unión iónica. Los enlaces iónicos son el resultado de atracciones electrostáticas entre cadenas laterales de aminoácidos con carga positiva y negativa. Por ejemplo, la atracción mutua entre un ion carboxilato de ácido aspártico y un ion lisina amonio ayuda a mantener un área plegada particular de una proteína (parte (a) de la Figura\(\PageIndex{5}\)).
- Enlace de hidrógeno. Los enlaces de hidrógeno se forman entre un átomo de oxígeno altamente electronegativo o un átomo de nitrógeno y un átomo de hidrógeno unido a otro átomo de oxígeno o un átomo de nitrógeno, como los que se encuentran en las cadenas laterales de aminoácidos polares. Los enlaces de hidrógeno (así como las atracciones iónicas) son extremadamente importantes tanto en las interacciones intra como intermoleculares de las proteínas (parte (b) de la Figura\(\PageIndex{5}\)).
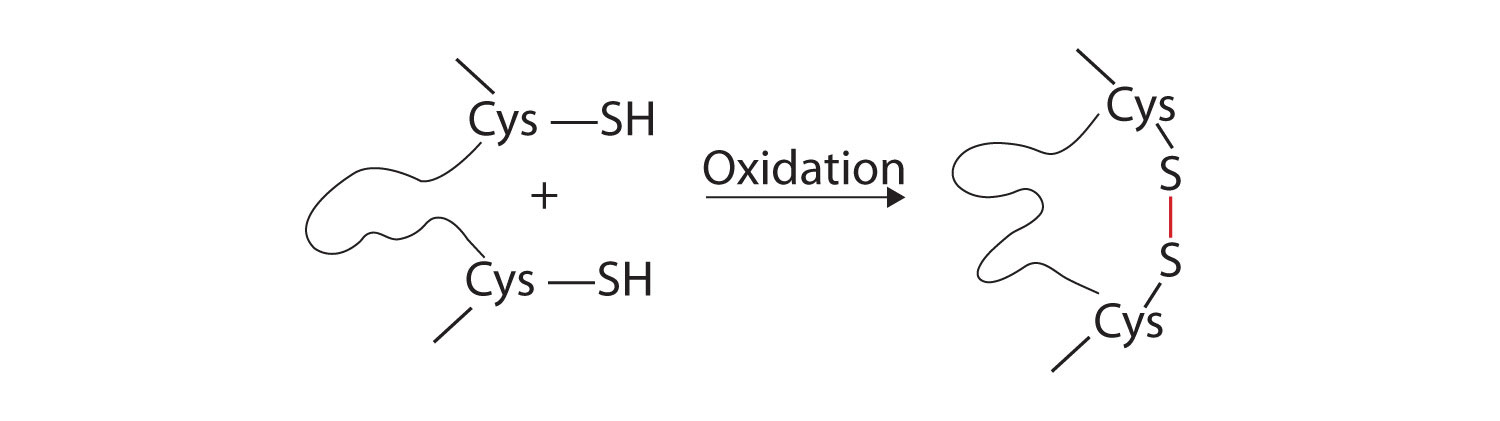
- Enlaces disulfuro. Dos unidades de aminoácidos de cisteína se pueden acercar juntas a medida que la molécula de proteína se pliega. La posterior oxidación y unión de los átomos de azufre en los grupos sulfhidrilo (SH) altamente reactivos conduce a la formación de cistina (parte (c) de la Figura\(\PageIndex{5}\)). Los enlaces disulfuro intracatenarios se encuentran en muchas proteínas, incluida la insulina (barras amarillas en la Figura\(\PageIndex{1}\)) y tienen un fuerte efecto estabilizador sobre la estructura terciaria.
- Fuerzas de dispersión. Las fuerzas de dispersión surgen cuando un átomo normalmente no polar se vuelve momentáneamente polar debido a una distribución desigual de electrones, lo que lleva a un dipolo instantáneo que induce un desplazamiento de electrones en un átomo no polar vecino. Las fuerzas de dispersión son débiles pero pueden ser importantes cuando faltan otros tipos de interacciones o son mínimas (parte (d) de la Figura\(\PageIndex{5}\)). Este es el caso de la fibroína, la proteína principal en la seda, en la que una alta proporción de aminoácidos en la proteína tienen cadenas laterales no polares. El término interacción hidrofóbica a menudo se usa mal como sinónimo de fuerzas de dispersión. Las interacciones hidrófobas surgen porque las moléculas de agua se involucran en enlaces de hidrógeno con otras moléculas de agua (o grupos en proteínas capaces de formar enlaces de hidrógeno). Debido a que los grupos no polares no pueden participar en enlaces de hidrógeno, la proteína se pliega de tal manera que estos grupos quedan enterrados en la parte interior de la estructura de la proteína, minimizando su contacto con el agua.
Cuando una proteína contiene más de una cadena polipeptídica, cada cadena se denomina subunidad. La disposición de múltiples subunidades representa un cuarto nivel de estructura, la estructura cuaternaria de una proteína. La hemoglobina, con cuatro cadenas o subunidades polipeptídicas, es el ejemplo más frecuentemente citado de una proteína que tiene estructura cuaternaria (Figura\(\PageIndex{6}\)). La estructura cuaternaria de una proteína es producida y estabilizada por los mismos tipos de interacciones que producen y mantienen la estructura terciaria. Una representación esquemática de los cuatro niveles de estructura proteica se encuentra en la Figura\(\PageIndex{7}\).
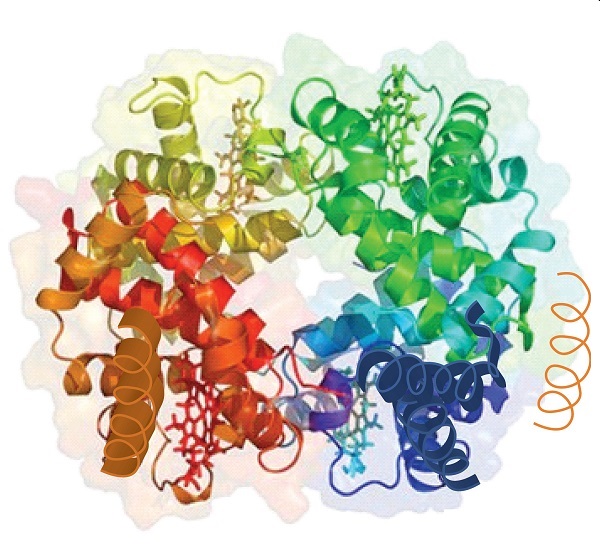
Fuente: Imagen de la RCSB PDB (www.pdb.org) de PDB ID 1I3D (R.D. Kidd, H.M. Baker, A.J. Mathews, T. Brittain, E.N. Baker (2001) Oligomerización y unión al ligando en una hemoglobina homotetramérica: dos estructuras cristalinas de alta resolución de la hemoglobina de Bart (gamma (4)), un marcador para alfa-talasemia. Protein Sci. 1739—1749).

La estructura primaria consiste en la secuencia específica de aminoácidos. La cadena peptídica resultante puede torcerse en una hélice α, que es un tipo de estructura secundaria. Este segmento helicoidal se incorpora en la estructura terciaria de la cadena polipeptídica plegada. La cadena polipeptídica única es una subunidad que constituye la estructura cuaternaria de una proteína, tal como la hemoglobina que tiene cuatro cadenas polipeptídicas.
Proteínas Globulares y Fibrosas
Una vez que las proteínas se forman y han desarrollado todos los niveles de su estructura, pueden clasificarse como fibrosas o globulares. Estas clasificaciones dan la forma básica de toda la molécula proteica. Si bien muchas proteínas son proteínas globulares (ver figura abajo), las proteínas de queratina son fibrosas (ver figura abajo) y conforman el cabello, las uñas y la capa externa de la piel.


Enzimas: Exquisitas Maquinas
La primera enzima que se aisló fue descubierta en 1926 por el químico estadounidense James Sumner, quien cristalizó la proteína. La enzima fue la ureasa, la cual cataliza la descomposición hidrolítica de la urea, un componente de la orina, en amoníaco y dióxido de carbono.
\[\ce{H_2NCON_2} \left( aq \right) + \ce{H_2O} \left( l \right) \overset{\text{urease}}{\rightarrow} 2 \ce{NH_3} \left( g \right) + \ce{CO_2} \left( g \right) \nonumber \]
Su descubrimiento fue ridiculizado al principio porque nadie creía que las enzimas se comportarían de la misma manera que lo hacían otros químicos. Finalmente se demostró que Sumner tenía razón y ganó el Premio Nobel de Química en 1946.
Enzimas y reacciones bioquímicas
La mayoría de las reacciones químicas dentro de los organismos serían imposibles bajo las condiciones en las células. Por ejemplo, la temperatura corporal de la mayoría de los organismos es demasiado baja para que las reacciones ocurran lo suficientemente rápido como para llevar a cabo procesos de vida. Los reactivos también pueden estar presentes en concentraciones tan bajas que es poco probable que se encuentren y colisionen. Por lo tanto, la velocidad de la mayoría de las reacciones bioquímicas debe ser incrementada por un catalizador. Un catalizador es un químico que acelera las reacciones químicas. En los organismos, los catalizadores se llaman enzimas. Esencialmente, las enzimas son catalizadores biológicos.
Al igual que otros catalizadores, las enzimas no son reactivos en las reacciones que controlan. Ayudan a que los reactivos interactúen pero no se agotan en las reacciones. En cambio, pueden ser utilizados una y otra vez. A diferencia de otros catalizadores, las enzimas suelen ser altamente específicas para reacciones químicas particulares. Generalmente catalizan solo uno o unos pocos tipos de reacciones.
Las enzimas son extremadamente eficientes para acelerar las reacciones. Pueden catalizar hasta varios millones de reacciones por segundo. Como resultado, la diferencia en las tasas de reacciones bioquímicas con y sin enzimas puede ser enorme. Una reacción bioquímica típica puede tardar horas o incluso días en ocurrir en condiciones celulares normales sin una enzima, pero menos de un segundo con una enzima.
La\(\PageIndex{10}\) figura representa una reacción enzimática típica. Un sustrato es la molécula o moléculas sobre las que actúa la enzima. En la reacción catalizada por ureasa, la urea es el sustrato.

El primer paso en la reacción es que el sustrato se une a una parte específica de la molécula enzimática, conocida como el sitio activo. La unión del sustrato viene dictada por la forma de cada molécula. Las cadenas laterales de la enzima interactúan con el sustrato de una manera específica, dando como resultado la formación y ruptura de enlaces. El sitio activo es el lugar sobre una enzima donde se une el sustrato. Una enzima se pliega de tal manera que normalmente tiene un sitio activo, generalmente un bolsillo o grieta formada por el patrón de plegado de la proteína. Debido a que el sitio activo de una enzima tiene una forma tan única, solo un sustrato en particular es capaz de unirse a esa enzima. Es decir, cada enzima cataliza solo una reacción química con un solo sustrato. Una vez formado el complejo enzima/sustrato, se produce la reacción y el sustrato se transforma en productos. Finalmente, la molécula o moléculas del producto se liberan del sitio activo. Tenga en cuenta que la enzima no se ve afectada por la reacción y ahora es capaz de catalizar la reacción de otra molécula sustrato.
Para muchas enzimas, el sitio activo sigue un modelo de cerradura y llave (Figura\(\PageIndex{11A}\) ) donde el sustrato encaja exactamente en el sitio activo. La enzima y el sustrato deben ser una combinación perfecta para que la enzima solo funcione como catalizador para una reacción. Otras enzimas tienen un modelo de ajuste inducido (Figura\(\PageIndex{11B}\) ). En un modelo de ajuste inducido, el sitio activo puede hacer ajustes menores para acomodar el sustrato. Esto da como resultado una enzima que es capaz de interactuar con un pequeño grupo de sustratos similares. Observe la forma del sitio activo en comparación con la forma del sustrato en B de la siguiente figura. El sitio activo se ajusta para acomodar el sustrato.

Inhibidores
Un inhibidor es una molécula que interfiere con la función de una enzima, ya sea ralentizando o deteniendo la reacción química. Los inhibidores pueden funcionar de diversas maneras, pero una de las más comunes se ilustra en la siguiente figura.

Un inhibidor competitivo se une competitivamente en el sitio activo y bloquea la unión del sustrato. Dado que no se produce ninguna reacción con el inhibidor, se evita que la enzima catalizar la reacción.
Un inhibidor no competitivo no se une en el sitio activo. Se une en un sitio alostérico, que es algún otro sitio en la enzima, y cambia la forma de la proteína. El sitio alostérico es cualquier sitio en la enzima que no sea el sitio activo. La unión del inhibidor no competitivo al sitio alostérico da como resultado un cambio en la estructura tridimensional que altera la forma del sitio activo de manera que el sustrato ya no encajará adecuadamente en el sitio activo (ver figura a continuación).

Cofactores y coenzimas
Algunas enzimas requieren la presencia de otro sustrato como molécula “auxiliar” para funcionar correctamente. Los cofactores y coenzimas sirven en este papel. Los cofactores son especies inorgánicas y las coenzimas son pequeñas moléculas orgánicas. Muchas vitaminas, como las vitaminas B, son coenzimas. Algunos iones metálicos que funcionan como cofactores para diversas enzimas incluyen zinc, magnesio, potasio y hierro.
Actividad catalítica de las enzimas
Las enzimas generalmente reducen la energía de activación al reducir la energía necesaria para que los reactivos se unan y reaccionen. Una forma en que actúan las enzimas es juntando los reactivos (sustratos) para que no tengan que gastar energía moviéndose hasta que choquen al azar. Las enzimas se unen a ambas moléculas reaccionantes (sustratos), de manera firme y específica, en un sitio en el sitio activo de la enzima. Las enzimas también pueden llevar moléculas al sitio activo para separarlas. Por ejemplo, la sacarasa es la enzima para la descomposición de la sacarosa que ingresa al sitio activo de la enzima y ayuda a debilitar las interacciones entre la fructosa y la glucosa que componen la sacarosa. La sacarasa es específica para la descomposición de la sacarosa al igual que la mayoría de las enzimas. El sitio activo es específico para los reactivos de la reacción bioquímica que cataliza la enzima. Al igual que las piezas del rompecabezas que encajan entre sí, el sitio activo solo puede unir ciertos sustratos. Las actividades de las enzimas también dependen de la temperatura, concentración y pH de los surroudings.
Concentración
Como ocurre con la mayoría de las reacciones, la concentración del (de los) reactivo (s) afecta la velocidad de reacción. Esto también es cierto en la concentración de enzimas. Cuando la concentración de sustrato o enzima es baja, la velocidad de la reacción será más lenta que donde hay concentraciones más altas. Las dos especies deben interactuar para que ocurra una reacción y concentraciones más altas de una o ambas darán como resultado interacciones más efectivas entre las dos.
Sin embargo, continuar aumentando la concentración del sustrato no siempre aumentará la velocidad de reacción. Esto se debe a que en algún momento, todas las enzimas estarán ocupadas y no estarán disponibles para unirse con otra molécula sustrato hasta que el sustrato forme una molécula producto y se libere de la enzima.
pH
Algunas enzimas funcionan mejor a pH ácidos, mientras que otras funcionan mejor en ambientes neutros. Por ejemplo, las enzimas digestivas secretadas en el ambiente ácido (pH bajo) del estómago ayudan a descomponer las proteínas en moléculas más pequeñas. La principal enzima digestiva en el estómago es la pepsina, que funciona mejor a un pH de aproximadamente 1.5. Estas enzimas no funcionarían óptimamente a otros pH. La tripsina es otra enzima en el sistema digestivo, que rompe las cadenas proteicas de los alimentos en partículas más pequeñas. La tripsina actúa en el intestino delgado, que no es un ambiente ácido. El pH óptimo de la tripsina es de aproximadamente 8.
Diferentes reacciones y diferentes enzimas lograrán su velocidad máxima a ciertos valores de pH. Como se muestra en la siguiente figura, la enzima logra una velocidad máxima de reacción a un pH de 4. Observe que la reacción continuará a valores de pH cada vez más bajos debido a que la enzima seguirá funcionando a otros valores de pH pero no será tan efectiva. A valores de pH muy altos o muy bajos, se producirá la desnaturalización porque una enzima es solo una proteína con una función específica.

Temperatura
Al igual que con el pH, las reacciones también tienen una temperatura ideal donde la enzima funciona de manera más efectiva. Seguirá funcionando a temperaturas cada vez más altas, pero la tasa será menor. Para muchas reacciones biológicas, la temperatura ideal es en condiciones fisiológicas que está alrededor de las\(37^\text{o} \text{C}\) cuales es la temperatura corporal normal. Muchas enzimas pierden función a temperaturas cada vez más bajas. A temperaturas más altas, la forma de una enzima se deteriora. Sólo cuando la temperatura vuelve a la normalidad la enzima recupera su forma y actividad normal a menos que la temperatura sea tan alta que cause daños irreversibles.

Aplicaciones de Enzimas
Las enzimas se utilizan en la y otras aplicaciones industriales cuando se requieren catalizadores extremadamente específicos (Tabla\(\PageIndex{1}\)). Las enzimas en general están limitadas en el número de reacciones que han evolucionado para catalizar y también por su falta de estabilidad en y a altas temperaturas. Como consecuencia, es un área activa de investigación e implica intentos de crear nuevas enzimas con propiedades novedosas, ya sea a través del diseño racional o de la evolución in vitro. Estos esfuerzos han comenzado a ser exitosos, y ahora se han diseñado algunas enzimas “desde cero” para catalizar reacciones que no ocurren en la naturaleza.
| Aplicación | Enzimas utilizadas | Usos |
|---|---|---|
| Industria de biocombustibles | Celulasas | Descomponer la celulosa en azúcares que pueden fermentarse para producir etanol celulósico. |
| Ligninasas | Pretratamiento de biomasa para la producción de biocombustibles. | |
| Detergente biológico | Proteasas, amilasas, lipasas | Elimine las manchas de proteínas, almidón y grasa o aceite de la ropa y vajilla. |
| Mananasas | Elimina las manchas de comida del aditivo alimentario común goma guar. | |
| Industria cervecera | Amilasa, glucanasas, proteasas | Polisacáridos divididos y proteínas en la malta. |
| Betaglucanasas | Mejorar las características de filtración de mosto y cerveza. | |
| Amiloglucosisdasa y pululanasas | Prepara cerveza baja en calorías y ajusta la fermentabilidad. | |
| Acetolacatato desacrboxilasa (ALDC) | Incrementar la eficiencia de fermentación reduciendo la formación de diacetilo. | |
| Usos culinarios | Papaína | Ablandar la carne para cocinar. |
| Industria láctea | Renin | Hidrolizar proteína en la elaboración de queso. |
| Lipasas | Producir queso Camembert y queso azul como Roquefort. | |
| Procesamiento de alimentos | Axilasas | Producir azúcares a partir del almidón, como en la elaboración de jarabe de maíz alto en fructosa. |
| Proteasas | Bajar el nivel de proteína de la harina, como en la elaboración de galletas. | |
| Tripsina | Fabricar alimentos hipoalergénicos para bebés. | |
| Celulasas, pectinasas | Aclarar jugos de frutas. | |
| Biología molecular | Nucleasas, ADN ligasa y polimerasas | Utilizar la digestión de restricción y la reacción en cadena de la polimerasa para crear ADN recombinante. |
| Industria del papel | Xilanasas, hemicelulasas y lignina peroxidasas | Retire la lignina de la pulpa Kraft. |
| Cuidado personal | Proteasas | Quitar las proteínas de las lentes cotact para prevenir infecciones. |
| Industria del almidón | Axilasas | Convertir el almidón en glucosa y varios jarabes. |
Resumen
- Las proteínas se pueden dividir en dos categorías: fibrosas, que tienden a ser insolubles en agua, y globulares, que son más solubles en agua. Una proteína puede tener hasta cuatro niveles de estructura.
- La estructura primaria consiste en la secuencia específica de aminoácidos.
- La cadena peptídica resultante puede formar una hélice α o una lámina plisada β (o estructuras locales que no son tan fáciles de clasificar), lo que se conoce como estructura secundaria. Estos segmentos de estructura secundaria se incorporan a la estructura terciaria de la cadena polipeptídica plegada.
- La estructura cuaternaria describe las disposiciones de las subunidades en una proteína que contiene más de una subunidad. Cuatro tipos principales de interacciones atractivas determinan la forma y estabilidad de la proteína plegada: enlaces iónicos, enlaces de hidrógeno, enlaces disulfuro y fuerzas de dispersión.
- Una enzima es un catalizador orgánico producido por una célula viva. Las enzimas son catalizadores tan potentes que las reacciones que promueven ocurren rápidamente a temperatura corporal.
- La molécula o moléculas sobre las que actúa una enzima se denominan sus sustratos.
- Una enzima tiene un sitio activo donde su sustrato o sustratos se unen para formar un complejo enzima-sustrato.
- El modelo original de bloqueo y llave de unión de enzima y sustrato representó una enzima rígida de configuración invariable que se une al sustrato apropiado. El nuevo modelo de ajuste inducido describe que el sitio activo de la enzima cambia su conformación después de unirse al sustrato.
- Las enzimas tienen numerosas aplicaciones en la industria alimentaria y láctea, industria de biocombustibles, industria papelera, etc.
Colaboradores y Atribuciones
- Libretext: The Basics of GOB Chemistry (Ball et al.)
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)
- Wikipedia

