2.1: La regla de Baldwin para las reacciones de cierre de anillos
- Page ID
- 74269
J.E. Baldwin propuso un conjunto de reglas para las reacciones de cierre de anillos. Sugirió que las reglas también son aplicables a los intermedios reactivos y apoyó sus puntos de vista con varios ejemplos de literatura y experimento especial diseñado para probar la validez de las reglas.
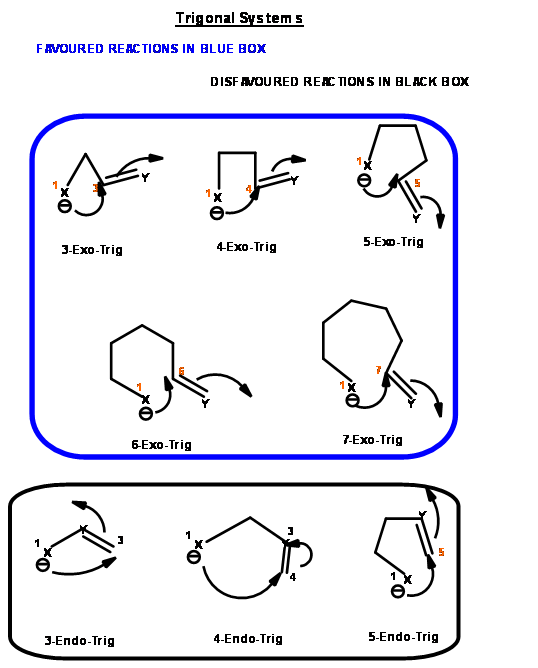
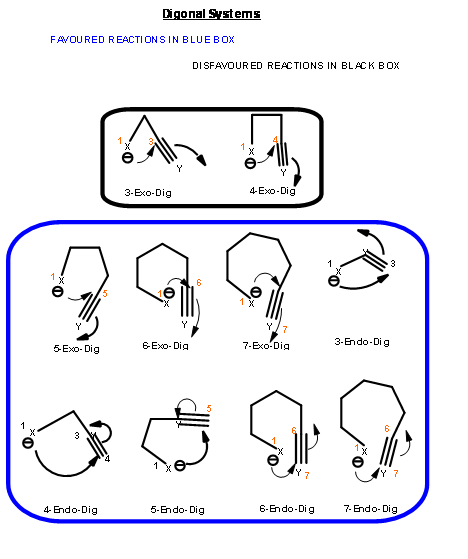
La reacción de cierre de anillo de un intermedio reactivo podría ser uno de los tres tipos. Un ataque podría ser en un centro de triple enlace (llamado centro Digonal, Dig -), un centro de doble enlace (llamado centro Trigonal, Trig -) o en un centro de enlace simple (llamado centro tetraédrico, Tet -). Las especies atacantes podrían ser un carbanión, un ion carbonio o un radical libre. El ataque podría ser endo -o exo -. Con respecto al anillo recién desarrollado en el estado de transición, cuando el par de electrones en el enlace desplazado es exo- al anillo en desarrollo, el estado de transición se describe como exo- ataque. Cuando forman parte del anillo recién desarrollado (o estado de transición) el sistema se describe como endo- ataque (Fig 2.2.1).
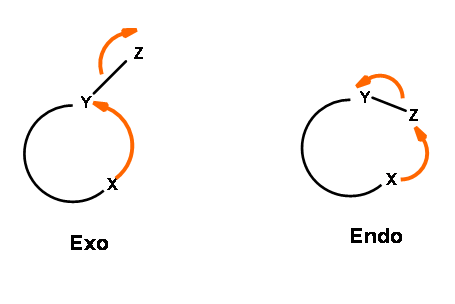
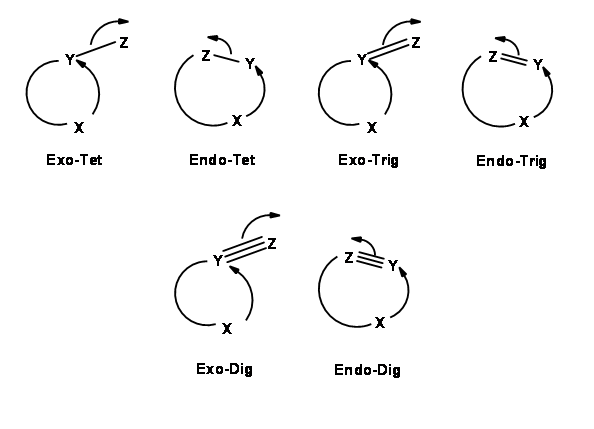
Para cada par de centro reactivo, podría haber dos modos de ataque —endo- o exo- como se muestra para el ataque de un anión (Fig 2.2.2).
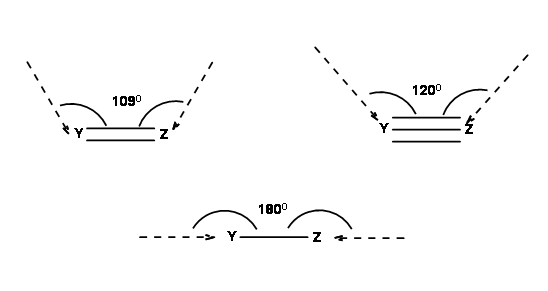
Las reacciones se producen solo cuando los orbitales en cuestión se superponen de manera eficiente. Para ello, Baldwin sugirió la siguiente geometría (Fig 2.2.3). En una reacción de formación de anillos, la geometría óptima podría lograrse solo cuando la longitud de la cadena (una atadura de átomos) que conecta los centros reactivos tenga una longitud óptima mínima.
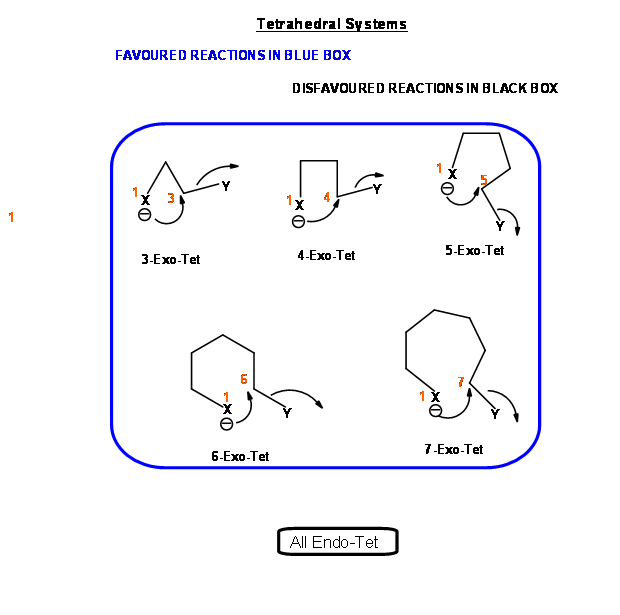
Con base en este criterio, Baldwin sugirió las siguientes reglas. El número (3 a 7) en la nomenclatura se refiere al número de átomos en la cadena que conduce al estado de transición cíclico propuesto.
Reglas de Baldwins
- Todas las reacciones Exo-Tet son reacciones favorecidas
- Todos los Endo-Tet son reacciones desfavorecidas
- Todas las reacciones de Exo-Trig son reacciones favorecidas
- Las reacciones de 3 a 5-Endo-Trig son reacciones desfavorecidas
- Las reacciones de 6 y 7-Endo-Trig son reacciones favorecidas
- Las reacciones de 3 a 7-Endo-Dig son reacciones favorecidas
- Las reacciones de 3 a 4-Exo-Dig son reacciones desfavorecidas
- 5 a 7-Exo-Dig son reacciones favorecidas
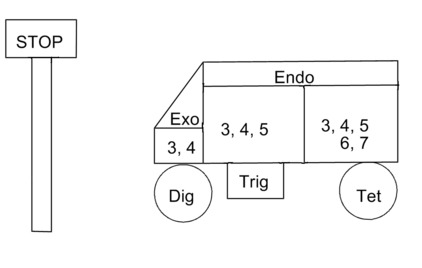
Estas reglas complejas son simples de aplicar, pero difíciles de recordar sin una 'ayuda de memoria' adecuada. E. Juaristi 2 (en su página web http://www.relaq.mx/RLQ/EusebioJuaristi_vitae.htm) sugiere los siguientes nemotécnicos para todas las Reacciones Desfavorecidas (la señal Stop). Aquí se presenta una versión modificada (Fig 2.2.4). Tenga en cuenta que los números van aumentando progresivamente. El letrero STOP y el vagón probablemente serían más fáciles de recordar.
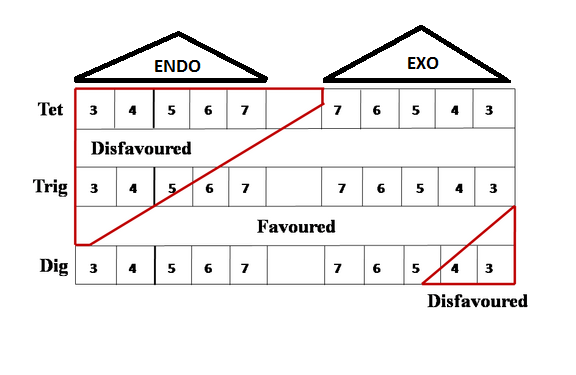
Un resumen alternativo de las Reglas de Baldwin es proporcionado por Clayden et. al., en su libro de texto inimitable. Esta tabla ahora es fácil de recordar (Fig 2.2.5). Hay que recordar 5-endo-trig y 4-Exo-Dig como puntos clave para las reacciones Desfavorecidas.
Baldwin citó varios ejemplos en apoyo de estas reglas. Los científicos pronto intentaron validar las reglas propuestas. Los factores estéricos y electrónicos parecen modificar estas conclusiones. En la mayoría de los estudios, las reglas fueron de aplicación general. Veamos el siguiente interesante estudio (Fig 2.2.6). Una reacción 6-endo-tet debe ser desfavorecida. Tales reacciones no forman un anillo, sino que parecen pasar por un estado de transición cíclico que conduce a la escisión de un enlace sigma, mientras que se forma un nuevo enlace sigma.
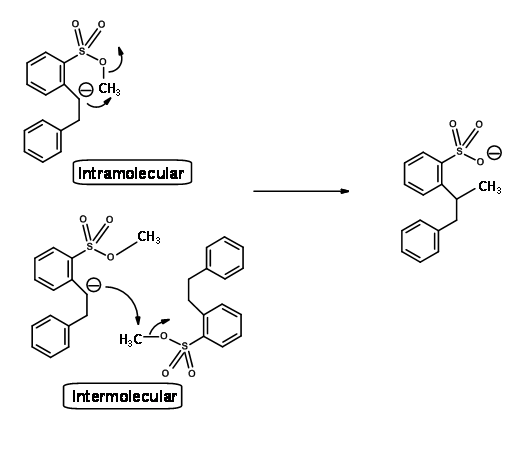
Usando un ingenioso experimento de doble marcaje que se muestra a continuación, Eschenmoser estableció claramente que esta reacción es intermolecular (Fig 2.2.7). Tomó una mezcla equimolar de materiales de partida hexadeutero y normales y realizó la reacción. Si la reacción fuera sólo intramolecular, el producto sería tanto hexadeutero- y no deutero- productos solamente. La distribución real del producto fue como se muestra en la Figura 2.2.7, la cual se ajusta únicamente al mecanismo intermolecular.
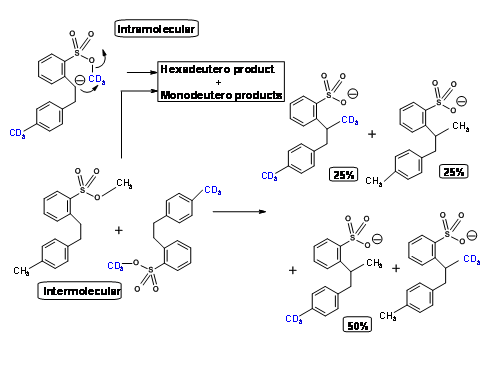
La restricción en tales casos radica obviamente en la longitud de la cadena que lleva los grupos reactivos. El ángulo de ataque de 180 0 no es alcanzable en un anillo de seis miembros. King y col. , mostró que a medida que aumentaba la longitud de la cadena (amarre), la reacción intramolecular se hizo más factible como se muestra en la Figura 2.2.8. Una reacción intramolecular se hizo factible solo cuando el teather permitió un estado de transición de anillo de diez miembros.
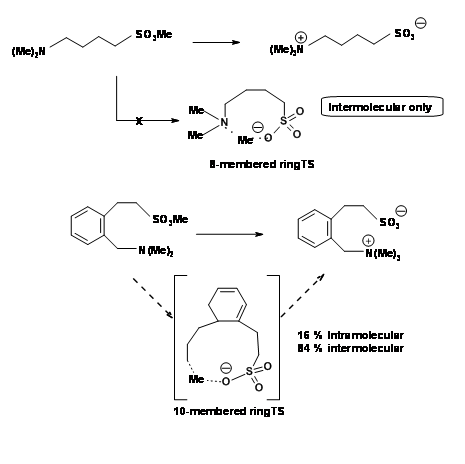
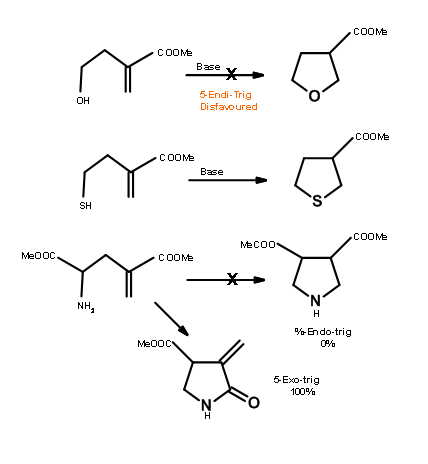
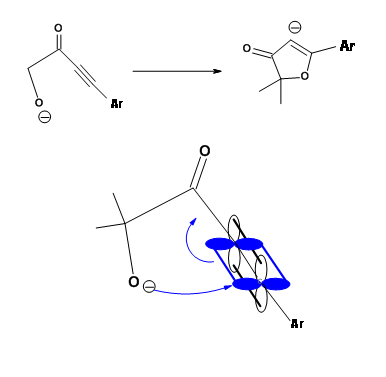
Otra ciclación desfavorecida es 5-Endo-Trig. La siguiente ciclación tipo Michael es de considerable interés (Fig 2.2.9). La adición intramolecular catalizada por base no procede como se esperaba. Sin embargo, la reacción catalizada por ácido procede. Una mirada cercana a un mecanismo alternativo sugiere que una ruta 5-Exo-Trig está disponible bajo condiciones catalizadas por ácido.
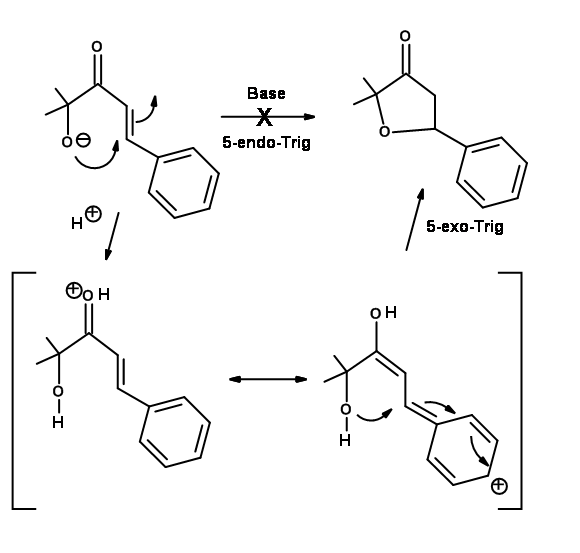
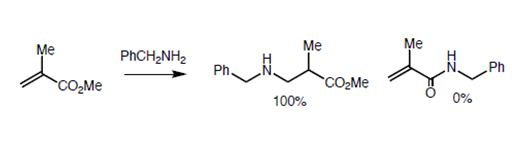
Baldwin ubica tres reacciones estrechamente relacionadas (Fig 2.2.10) para apoyar sus reglas. El análogo de oxígeno no se cicló como se anticipó para las reacciones de 5-Endo-Trig. Sin embargo, el análogo de tiol se cicló fácilmente para dar el anillo de tiofeno. Esto se atribuye al hecho de que el átomo más grande requiere ángulos de enlace completamente diferentes no previstos en las Reglas de Baldwin. El análogo de nitrógeno investigado prefirió una ruta alternativa. ¿Por qué el nitrógeno prefiere la amidación y no la ciclación tipo Michael? ¿Podría deberse a una olefina no reactiva? Esta pregunta fue respondida a través de una 'reacción de control' intermolecular mostrada en la Fig 2.2.11. El radical amina prefirió una adición de tipo Michael a la amidación.
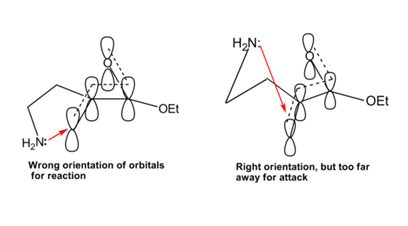
Esta falta de ciclación se atribuyó, por lo tanto, a que el par solitario no puede atacar los orbitales pi debido a una orientación incorrecta en una conformación y a las distancias involucradas en la otra conformación (ver Figura 2.2.12).
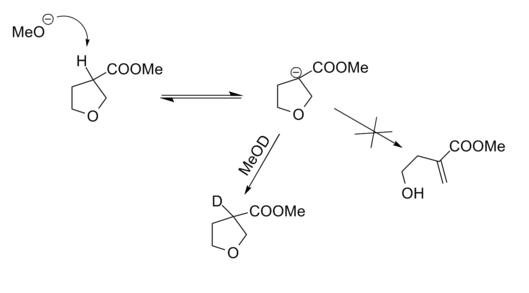
La aplicabilidad de la restricción 5-Endo-Trig de Baldwin se verificó mediante una retroreacción cuidadosamente planificada (Fig 2.2.13). El experimento de marcaje con deuterio demostró que la formación de aniones fue efectiva. La falta de reacción de escisión demostró que las conclusiones anteriores (restricción 5-Endo-Trig) también son válidas en reacciones inversas.
El hecho de que 5-Exo-Trig sea favorecido se ve en varias reacciones. El hecho de que las reacciones 6-Endo-Trig sean favorecidas también está bien documentado (Fig 2.2.14).
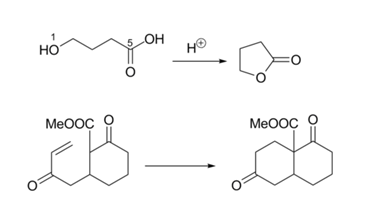
La ciclación 5-Endo-Dig se ve incómoda en papel (Fig 2.2.15). Pero la reacción procede hasta su finalización. Una mirada cercana a los orbitales en cuestión explica la reacción. La orientación de uno de los orbitales pi-es justo para que ocurra la reacción. Compárelo con la orientación que se muestra en la Figura 2.2.12.
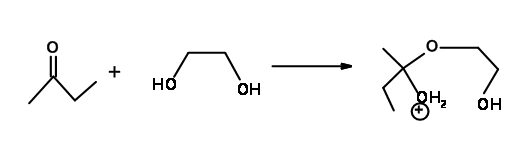
¿Qué tal la reacción de formación de acetal de cetonas con etilenglicol (Fig 2.2.16)? ¿Es este un caso de fracaso de las Reglas de Baldwin como en varias reacciones de iones carbonio?
Estas reglas son de aplicación general. Sin embargo, también hay varias excepciones. Un enfoque adecuado sería utilizar estas 'reglas pulgares' como pauta mientras se planifican esquemas sintéticos y no utilizarlos como reglas inviolables. Se podrán tener en cuenta los siguientes puntos al aplicar estas reglas.
1. Las reglas sugieren sólo los 'caminos favorecidos'. Esta expresión 'favorecido/desfavorecido' no debe leerse como 'permitido/deshabilitado'. En condiciones adecuadas, se puede abrir el camino alternativo de alta energía, ya sea parcial o exclusivamente.
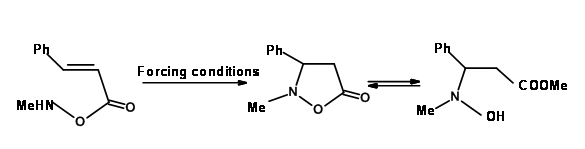
2. Cuando se involucra un átomo grande del Segundo Grupo de la tabla periódica, los requisitos de ángulo de estos átomos pueden variar. En tales casos, las reglas podrán no ser aplicables. Véase la Fig 2.2.10 para uno de esos ejemplos.
3. Las Reglas de Baldwin modificadas especiales han sido evolucionadas para aniones enolados.
Referencias
- J.E. Baldwin, J. Chem. Soc., Chem. Comuna. 734 (1976). J.E. Baldwin, J. Cutting, W. Dupond, L. Kruse, L. Silberman, R.C. Thomas, J. Chem. Soc., Chem. Comuna. 736 (1976). J.E. Baldwin, R.C. Thomas, L. Kruse, L. Silberman, J. Org. Chem., 42, 3846 (1977). J.E. Baldwin, L. Kruse, J. Chem. Soc., Chem. Commun., 233 (1977). J.E. Baldwin, M.J. Lusch, Tetraedro, 38, 2939 (1982). C.D.Johnson, Acc. Chem. Res., 26, 476 (1993).
- Eusebio Juaristi y Gabriel Cuevas, Rev. Soc. Quím. Méx, 36, 48 (1992)
- Química Orgánica por Clayden, Greeves, Warren y Wathers: Página 1144.
- Eschenmoser. Helv. Chim.. Acta., 53, 2059 (1970)
- King et. al., Chem. Commun., 175 (1982); Tetrahedron Lett., 23, 4465 (1982). y Peter Beak, Acc. Chem. Rec., 25, 215 (1992).

