5: Estrategias en la síntesis de Disparlure
- Page ID
- 74246
La polilla gitana (Porthytria dispar) es una plaga grave de los bosques. En 1976 B.A. Bierl et.al., (Science, 170,88 (1970)) aislaron la feromona sexual de extractos de 78 mil puntas de los dos últimos segmentos abdominales de polillas femeninas. La estructura se asignó como 5.1. Posteriormente, la molécula precursora —la cis-olefina también se aisló de la misma fuente.
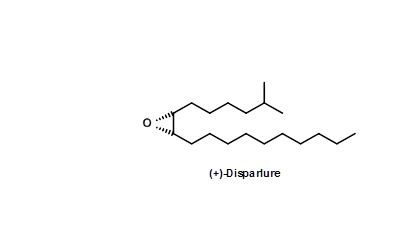
Un bioensayo de laboratorio a partir de materiales sintéticos mostró que solo 2 pg de 5.1 fueron suficientes para provocar bioactividad. Dado que la disponibilidad de la molécula a partir de fuentes naturales fue muy pequeña incluso para problemas de elucidación de la estructura y estudiar su papel anticipado como molécula de control de plagas, hubo un intenso interés en una síntesis eficiente de esta molécula. Algunas desconexiones para esta molécula simple se representan en la Figura 5.2.
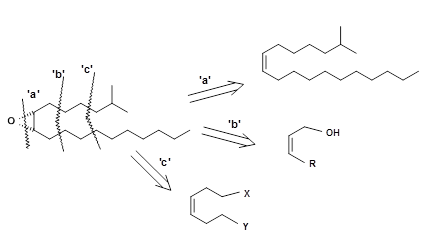
Los epóxidos se pueden hacer a partir de las olefinas correspondientes. En este caso, la olefina debe ser Z-olefina. Cuando la síntesis de tales olefinas no es estereoespecífica, la epoxidación directa con peróxidos produciría una mezcla de α- y β-epóxido de ambas olefinas isoméricas. Para evitar tales mezclas en la última etapa, se debe introducir selectividad en una etapa temprana de la síntesis.
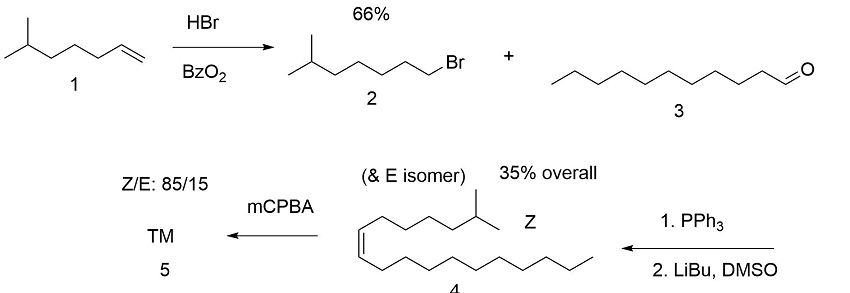
El primer intento se orientó hacia la síntesis de la olefina apropiada y la epoxidación (B.A. Bierl et.al., (Science, 170, 88 (1970)). La estereoselectividad fue insatisfactoria (Fig 5.3). Esto requirió una purificación extensa.
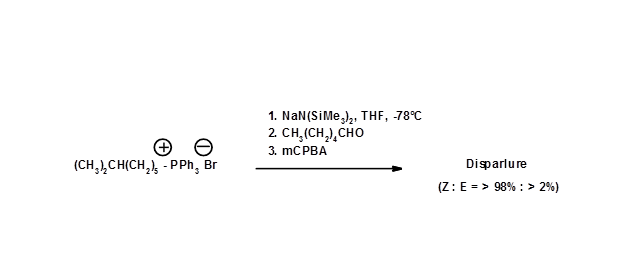
La relación de isómeros cis-/trans en la reacción de olefinación de Wittig podría alterarse mediante la modificación de reactivos y parámetros de reacción. H.T. Bestmann et al., (Chem. Ber., 109, 3375 (1976)) fueron capaces de mejorar la síntesis modificando las condiciones de reacción de Wittig (Fig 5.4).
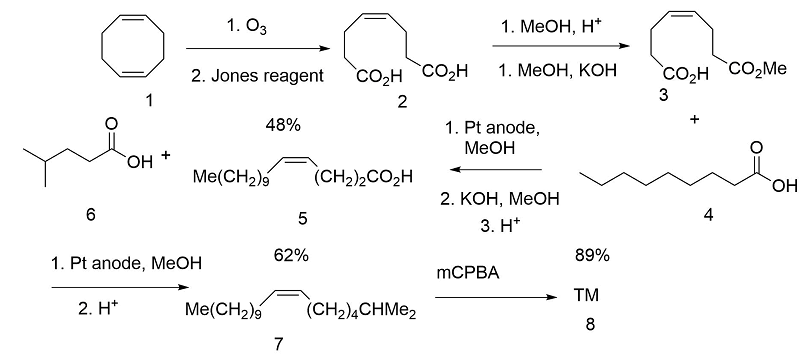
Las cis-olefinas puras podrían obtenerse por reducción catalítica de acetilenos (Angew. Chem., Int. Ed., 11, 60 (1972). Klunenberg et al., (Angew. Chem., Int. Ed., 17, 47 (1978) aprovechó los restos cis-olefina en 1,5-ciclooctadieno por oxidación selectiva de un doble enlace. Las cadenas se introdujeron por electrólisis secuencial de Kolbe (Fig 5.5).
Síntesis de Disparlures ópticamente puros
La epoxidación de olefinas produce solo racematos a menos que la etapa de epoxidación implique una síntesis asimétrica. La síntesis de isómeros puros (+) - y (-) - se pudo lograr de tres maneras.
- Resolución de un racemato: Este podría ser un método de elección cuando ambos enantiómeros son necesarios para estudios de SAR. Todas las antípodas del compuesto estarían disponibles a través de vías sintéticas idénticas.
- Síntesis asimétrica de intermedios apropiados: Cuando solo se desea una de las antípodas, este proceso proporciona una amplia gama de posibilidades sintéticas para la investigación. Cuando un gran número de compuestos estrechamente relacionados son las dianas, este método es una mejor opción.
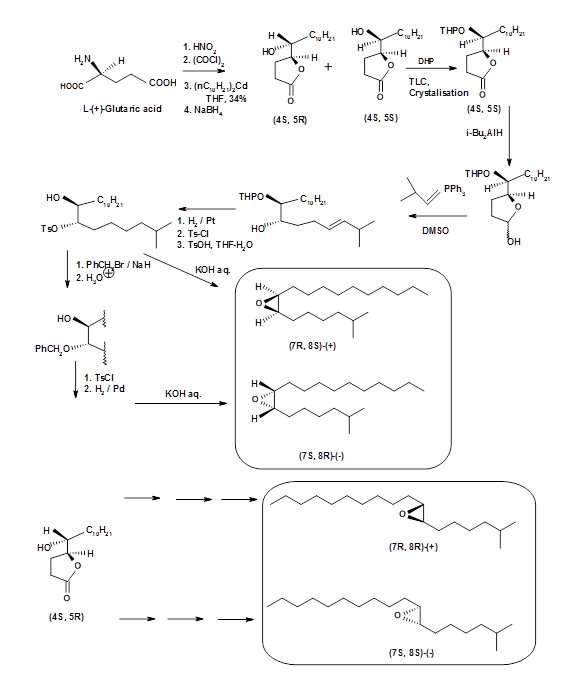
- Abastecimiento del intermedio quiral de un charco quiral adecuado: Una vez que el objetivo quiral es claro, este podría ser un método de elección. En el caso de Disparlure, la cantidad que se pudo aislar de la polilla gitana era tan pequeña que ni siquiera se pudo determinar la rotación óptica. Varios trabajadores han reportado síntesis de (+) - y (-) - Disparlure ópticamente puro y sus isómeros estructurales. El primer reporte provino de S. Iwaki et.al., (J. Am. Chem. Soc., 96, 7842 (1974)). Comenzaron con ácido L- (+) -glutámico y resolvieron el alcohol-lactonas diastereoméricas intermedias mediante la técnica de cristalización repetida (Fig 5.6). Su síntesis no fue estereoespecífica. Los estudios de SAR revelaron que el isómero cis- (+) - fue más efectivo.
Mori et al., (Tet. Lett., 3953 (1976); Tetrahedron, 53, 833 (1979)) pronto siguió con una síntesis de (+) - y (-) - Disparlures a partir del ácido L- (+) -tartárico (Fig 5.7).
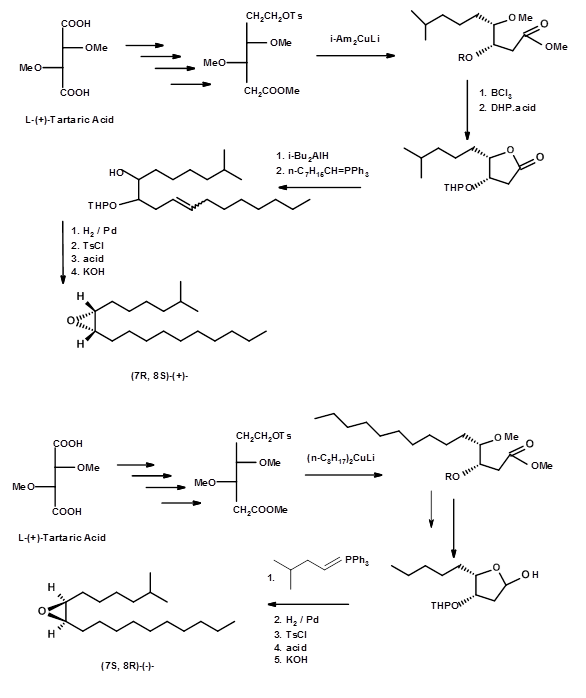
Esta síntesis tuvo el mérito de que algunos de los intermedios quirales eran cristalizables y por lo tanto susceptibles de fácil purificación a intermedios muy puros y productos finales puros. Sus intermedios fueron sometidos a análisis espectrales críticos para evaluar su pureza. Así, sus bioensayos dieron datos más confiables. Alexandros E. Koumbis et.al., (Tetrahedron Letters, 46, 4353 (2005)) (Fig 5.8) reportó una síntesis de (+) - y (-) - Disparlure a partir de otro sintón quiral -isopropilideno D- y L- eritrosis.
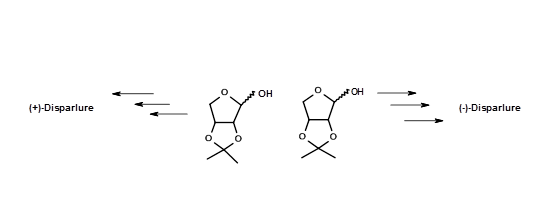
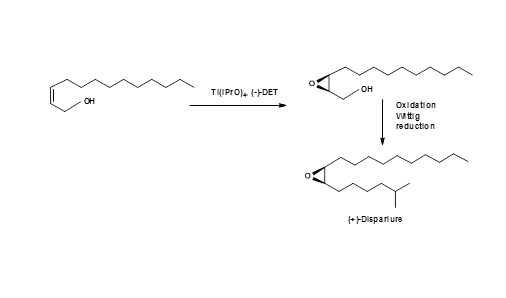
Una síntesis exitosa de (+) - Disparlure mediante la aplicación de epoxidación Sharpless fue reportada por Kossier B. E.. et.al., (J. Am. Chem. Soc., 103, 464 (1981)) (Fig 5.9).
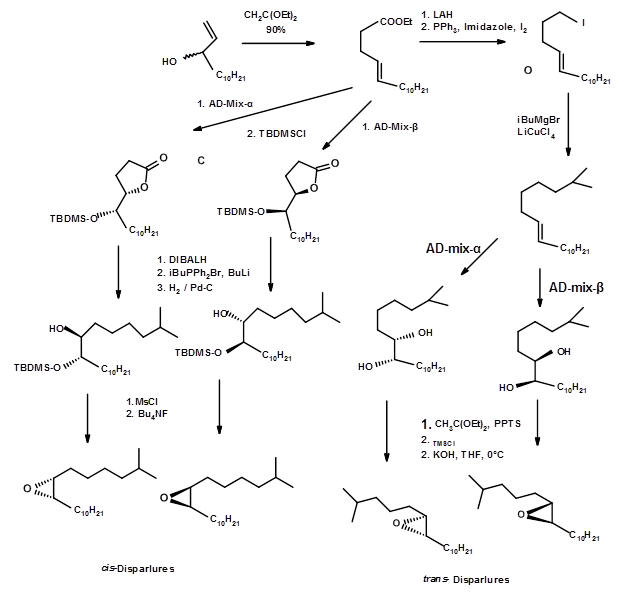
La síntesis de los cuatro isómeros en una forma muy pura provino de la escuela de Sharpless E. B. (Tet. Let., 6411 (1992)). Utilizando ambos agentes de hidroxilación quirales, reportaron una síntesis eficiente de todos los enantiómeros (Fig 5.10). La eficiencia de la síntesis asimétrica fue tan alta como 95% y dio 100% puro intermediado por cristalización. El proceso general fue muy eficiente.