6: Estrategias en la Síntesis de (-) -Mentol
( \newcommand{\kernel}{\mathrm{null}\,}\)
(-) -El mentol es uno de los productos químicos de perfume/sabor más importantes, ampliamente utilizados en productos farmacéuticos, cosméticos, pastas dentales, gomas de mascar y artículos de tocador. De la producción total estimada de alrededor de 20,000 m.ton, el mentol natural representa alrededor de 13 m.ton, el resto proviene de fuentes sintéticas. La fuente natural -aceite de Mentha Arvensis- siendo errática debido a la dependencia del monzón, la demanda de mentol sintético va en aumento. Los procesos de fabricación elegidos para discusión aquí demuestran tres metodologías importantes utilizadas en la industria para la síntesis de compuestos quirales. En la Figura 6.1 se proporciona un resumen de algunos de los procesos conocidos.
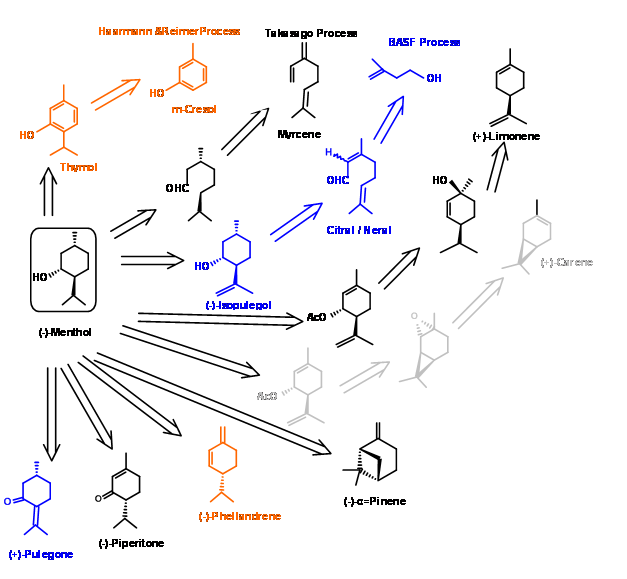
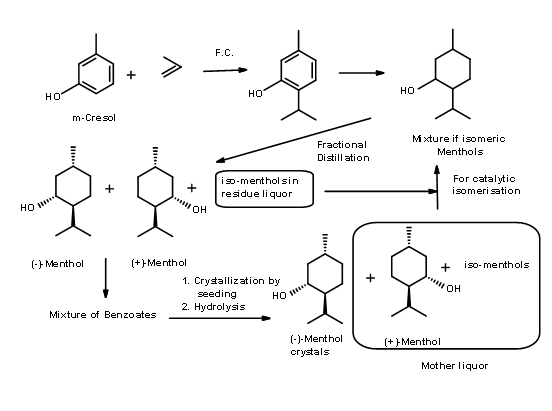
Proceso Symrise (anteriormente conocido como proceso de Haarmann & Reimer) (Patente de Estados Unidos 3.943.181 (Mar 9 1976)) — En este proceso (Fig 6.2), el timol se sintetiza a partir del m-cresol. La hidrogenación catalítica dio una mezcla de mentoles de los cuales se obtuvieron primero los mentoles como una mezcla racémica por destilación fraccionada cuidadosa. La mezcla residual se epimerizó para aumentar el contenido de mentol racémico mediante un proceso catalítico patentado. El avance en el proceso es la resolución del éster benzoato del racemato por recristalización mediante un proceso de siembra del concentrado con un epímero puro. El licor madre que ahora era rico en el isómero (+) se recicló llevándolo de nuevo al ciclo de destilación. En este proceso, el rendimiento global de (-) -mentol es de aproximadamente 90%.
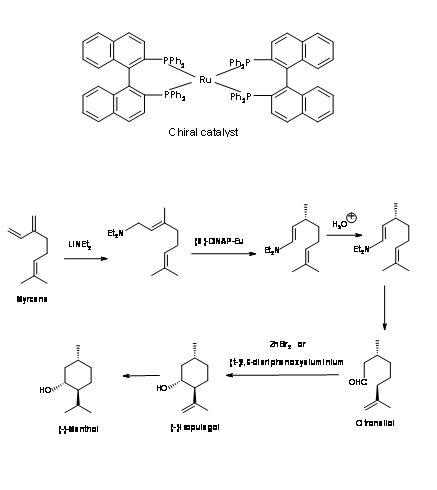
Proceso Takasago: En este proceso una isomerización catalizada por (S) -DINAP es el paso clave Fig 6.3. La adición de amida de litio al mirceno dio un compuesto de adición que se isomerizó usando un catalizador de rutenio quiral. La hidrólisis de la enamina resultante dio un aldehído citronelal de alta pureza enantiomérica. Esto fue ciclado por el catalizador de Lewis. La reducción catalítica de la olefina dio (-) -mentol1.
Proceso BASF: BASF ya ha establecido procesos para la síntesis de una serie de terpenos a partir de buteno. En vista de la alta demanda de (-) -mentol, extendieron la cadena de productos a (-) -mentol también. El esquema para la síntesis de la cadena de producto se muestra en la Figura 6.4.
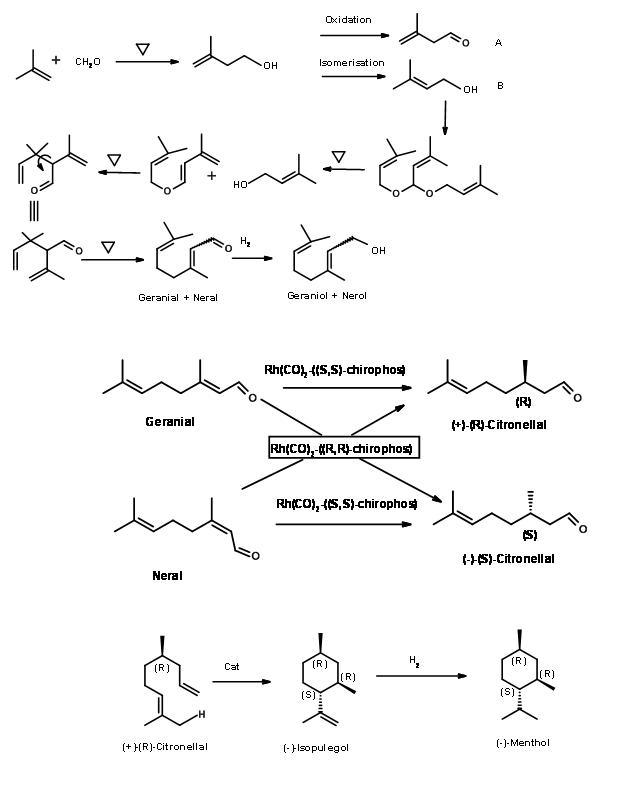
Higo 6.4
La extensión de la cadena de valor Citral a (+) -Citronelal, (-) -Isopulegol y finalmente a (-) -mentol dio una gama de productos de valor agregado. Cabe destacar que estos procesos han aprovechado los desarrollos en los procesos catalíticos en los últimos años. Los detalles de los catalizadores no se hacen públicos.
Referencias
- Preparación de citral, Patente de Estados Unidos 4288636 (09/08/1981)
- Método para la producción de mentol, Patente de Estados Unidos 7709688 (05/04/2010);
- Hidrogenación enantioselectiva de alcoholes alílicos y homoalílicos, J. Am. Chem. Soc., 1987, 109 (5), pp 1596—1597
- Norbert; Método para la producción de isopulegol, Patente de Estados Unidos 7550633 (23/06/2009);
- Compuestos de diarilfenoxi aluminio, Patente de Estados Unidos 7608742 (10/27/2009)
- PROCESO CONTINUO PARA LA PREPARACIÓN DE MENTOL EN FORMA PURA O ENRIQUECIDA, Solicitud de Patente de la OMPI WO/2009/033870
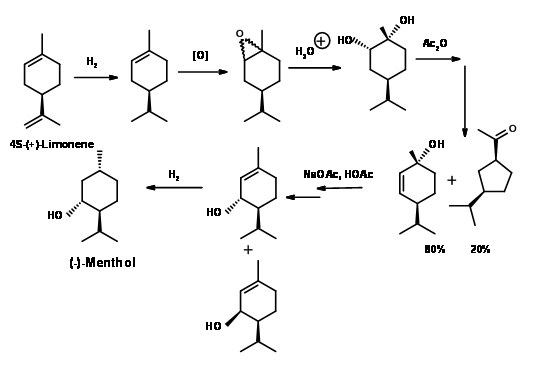
(-) -Mentol de (+) -Limoneno (Fig 6.5): El limoneno está disponible abundantemente a partir de cáscaras de cítricos. En la reducción catalítica selectiva con Ra-Ni, se pudo reducir a (+) -1-menteno, que en la epoxidación e hidrólisis dio (+) -1-hidroxineocarvomentol. La acilación seguida de pirólisis dio (-) -trans-mento-2-eno-1-ol como el producto principal. El producto crudo se solvolizó para dar una mezcla de piperityl actatos como los productos alílicos de migración. El producto crudo se destiló en esta etapa para separar los piperitoles cis y trans. El producto de contracción del anillo menor fue útil como perfume intermedio en otros lugares. La reducción final se logró mediante H2/Pd-C para dar 75% de rendimiento de (-) -mentol después de la destilación fraccionada.
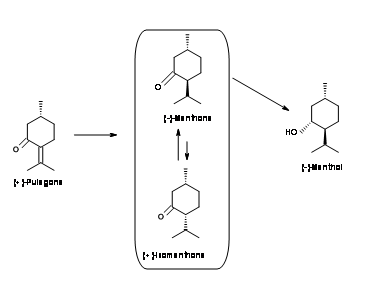
(-) -Mentol de (+) -Pulegona (Fig 6.6): El material de partida tiene la configuración correcta en C1. El problema es reducir el doble enlace enantioselectivamente. El doble enlace se reduce primero por hidrogenación catalítica para dar una mezcla de (-) -mentona y (+) -isomentona. La configuración todo-ecuatorial de (-) -mentol se logra mejor disolviendo la reducción de metal. El enolato intermedio está protonado al (-) -mentol termodinámicamente estable.
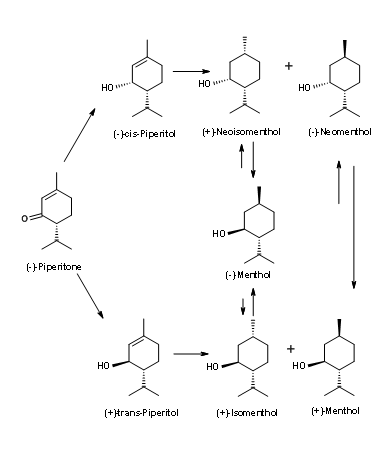
(-) -Mentol de (-) -Piperitona (Fig 6.7): Observe de cerca la estereoquímica en el centro asimétrico de (-) -Piperitona. El isopropilo está en la configuración incorrecta para (-) -mentona. El reto aquí es (1) isomerizar este centro y (2) reducir enantioselectivamente el doble enlace. Todos los intentos de producir (-) -mentol producen solo mezclas como se muestra en la Figura 6.7. De ahí que este proceso no haya tenido mucho éxito.
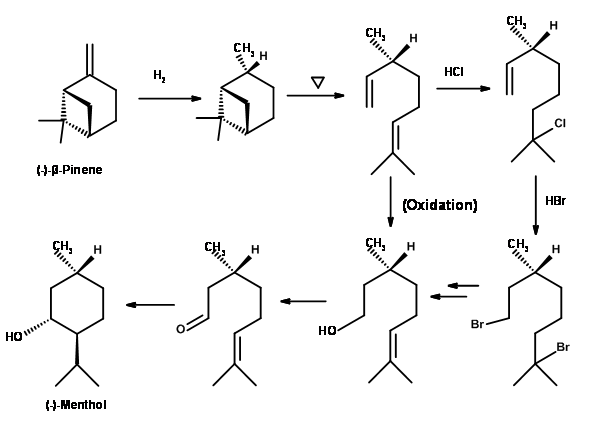
(-) -mentol de (-) -β-pineno (Fig 6.8): (-) -β-pineno ofrece una buena ruta porque las características estructurales requeridas están presentes y están disponibles en suficiente pureza óptica. La hidrogenación de (-) -β-pineno dio cis-pinano es un producto importante. En la pirólisis, el sistema de anillos puenteados se escindió para dar 2,6-dimetil-2,7-octadieno ópticamente puro. Se convirtió en (+) -Citronelol en buenos rendimientos por oxidación directa. Como alternativa, la olefina más sustituida se sometió primero a una adición de Markovnikov de HCl seguida de una adición anti-Markovnikov de HBr. La reacción de solvolisis proporcionó una mezcla de citroneloles. Oxidación catalítica del alcohol proporcionado (+) -Citronelal. Esto podría convertirse en (-) -mentol por procedimientos conocidos. Sin embargo, el producto se contaminó con trazas de (+) -mentol derivadas del trans-pinano generado en el primer paso.
(-) -mentol de (+) -δ-3-careno (Fig 6.9): δ-3-careno es otro sintón quiral que tiene las características estructurales requeridas para servir como material de partida para (-) -mentol. La isomerización catalítica de δ-3-careno dio (+) -δ-2-careno. Se investigaron dos rutas diferentes. En la primera ruta se pirolizó (+) -δ-2-careno para escindir el anillo de ciclopropano. El dieno resultante tuvo la estereoquímica correcta en C1 y C4. Esto último no importaba porque esta asimetría se pierde pronto y se regenera en el proceso. El tratamiento del dieno no conjugado con HCl y la deshidrohalogenación condujeron a un dieno conjugado. La adición de HCl condujo a un cloruro de alilo. La solvolisis con ácido acético-acetato de sodio proporcionó un desplazamiento S N 2 'causando un reordenamiento alílico. Los acetatos de piperitol resultantes dieron (+) -cis y (-) -trans-piperitoles que pudieron ser destilados fraccionalmente. Los (-) -trans-piperitoles puros produjeron (-) -mentol en la hidrogenación.
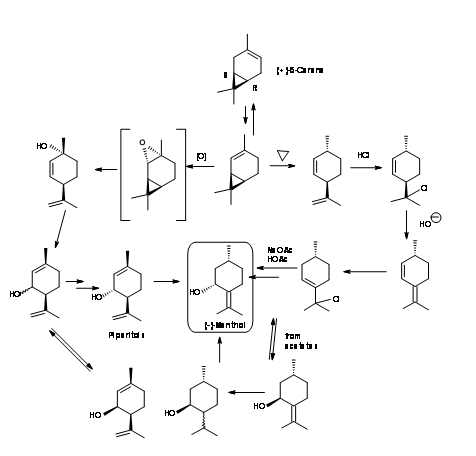
En la segunda ruta (+) -δ-2-careno se epoxidó para producir (+) -cis-2,8-p-mentadienol directamente. Al amortiguar con la mezcla de ácido fórmico-ácido acético, se produjo un reordenamiento alílico para dar una mezcla de formiato y acetato de ésteres de piperitilo. Los alcoholes correspondientes podrían ser destilados fraccionalmente. El isómero cis podría ser isomerizado para mejorar el rendimiento de (-) -trans-piperitol puro. La hidratación dio (-) -mentol.
Conclusión: En esta sección nos enfocamos en el desarrollo de rutas comercialmente viables para (-) -mentol. Observe la forma en que los reactivos modernos han influido en los procesos
Referencias
- Leffingwell, J.C. y R.E. Shackelford, Laevo-Mentol - Síntesis y propiedades organolépticas, Cosmética y Perfumería, 89 (6), 69-89, 1974
- Hopp, R., Mentol: sus orígenes, química, fisiología y propiedades toxicológicas, Rec. Adv. Ciencia del Tabaco, Vol. 19, 3-46 (1993).

