11: Estrategias en la Síntesis de Esteroides
- Page ID
- 74187
Las principales características esqueléticas de los anillos esteroideos se representan en las dos figuras mostradas en la Figura 11.1. El mismo sistema de numeración se mantiene incluso al describir estructuras de piezas obtenidas como intermedios sintéticos.
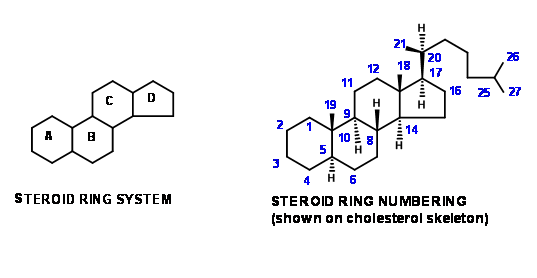
Esta convención nos ayuda a seguir el desarrollo de características estructurales a través de esquemas sintéticos largos. Los estudiantes también deben familiarizarse con otra convención seguida por químicos para categorizar esquemas sintéticos, originalmente evolucionados para esteroides. Descripciones similares también se encuentran en la química de alcaloides. 'Un\(AB \rightarrow ABC \rightarrow ABCD\) enfoque' significaría que se elige un esqueleto de naftaleno (ya sea aromático o perhidro- esqueleto adecuado) como SM. El anillo C se construye entonces sobre los anillos AB. El anillo D se forma entonces por cierre de anillo. Un ejemplo de esta estrategia es la síntesis de Bechmann (1940). Dichas descripciones no indican ningún detalle como los patrones de sustitución en el SM o los intermedios sintéticos ni derraman luz sobre detalles estereoquímicos. Estos detalles se discuten en los esquemas sintéticos.
Síntesis de Bechmann (1940) de Equilenina
Esta síntesis clásica explota la química del anillo de naftaleno. Se eligió ácido 1-naftilamina-2-sulfónico como anillo AB (Fig 11.2). El sulfónico
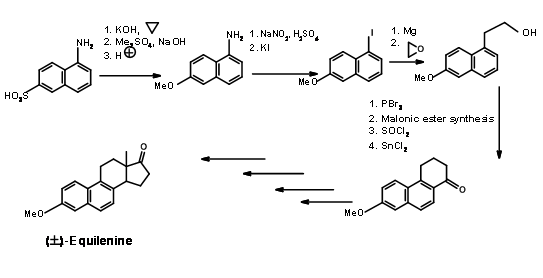
el resto ácido se convirtió en un fenol y se protegió como el éter metílico. El resto amina se convirtió en yoduro a través de la diazotización. Los anillos C y D se construyeron en los anillos AB
Síntesis de Woodward de Colesterol:
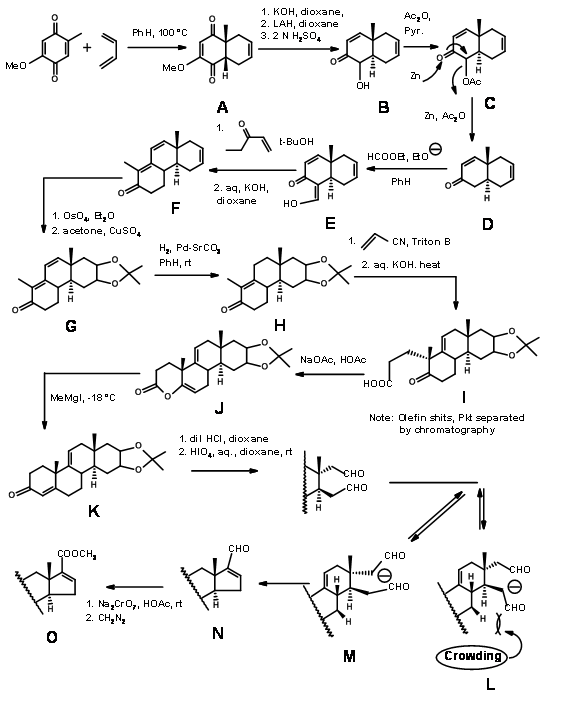
La síntesis de Woodward del Colesterol (J. Am. Chem. Soc., 73, 2403, 3547, 3548 (1951); ibid, 74, 4223 (1952) (Fig 11.3) podría describirse como\(C \rightarrow CD \rightarrow BCD \rightarrow ABCD\) Enfoque. Dado que el anillo D permanece D-homo hasta el último paso de la construcción del anillo y el anillo requerido de 5 miembros se obtuvo solo después de una contracción del anillo, también podría denominarse como\(C \rightarrow BC \rightarrow ABC \rightarrow ABCD\) Approach. Recuerde que esta molécula tiene 8 centros asimétricos y por lo tanto podría tener 28 (256) isómeros ópticos. Esta síntesis contempló la síntesis de un solo conjunto de diastereómeros. Esta síntesis estereoespecífica incorporó todos los estereopuntos de manera estéreo y regioespecífica. El anillo D proporciona un anclaje para variaciones en la cadena. El doble enlace en el anillo C permitió una apertura para la síntesis de cortisona. Las leyendas en las flechas muestran las reacciones.

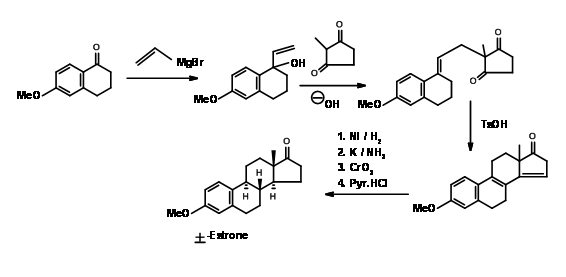
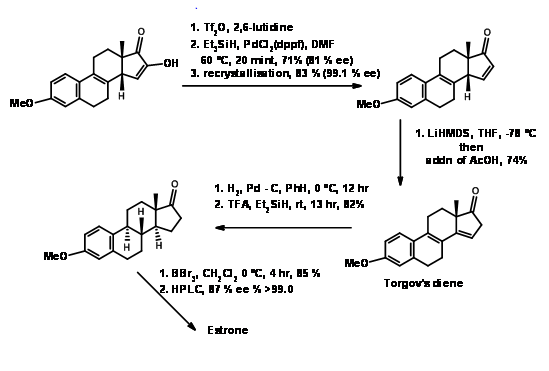
Síntesis de Estrona
La estrona ha atraído a varios químicos como objetivo para ejecutar nuevas metodologías en este esteroide complejo pero útil. Un método muy popular para la introducción del anillo D, seguido de la ciclación del anillo C en la síntesis de esteroides fue introducido por Torgov (1950, 63). Su síntesis de Estrona se muestra en la Figura 11.4. Su procedimiento para\(AB \rightarrow ABD \rightarrow ABCD\) Approach se hizo muy popular. Posteriormente se desarrollaron varias modificaciones para mejorar aún más esta metodología.
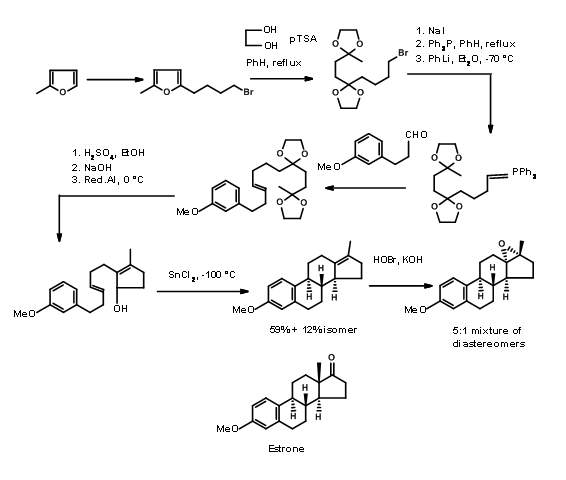
Bartlet utilizó una transformación mecanicista en su síntesis de Estrone. Aplicó una ciclación de tipo biogenética para su\(\ce{A -> AD -> ABCD}\) abordaje mostrado en la Figura 11.5. Un anillo de furano sirvió como una 1,4-dicetona enmascarada necesaria para el anillo D. También tenga en cuenta la transformación de reordenamiento utilizada para la introducción estereoespecífica del grupo metilo angular en la posición C13 en la última etapa de la síntesis.
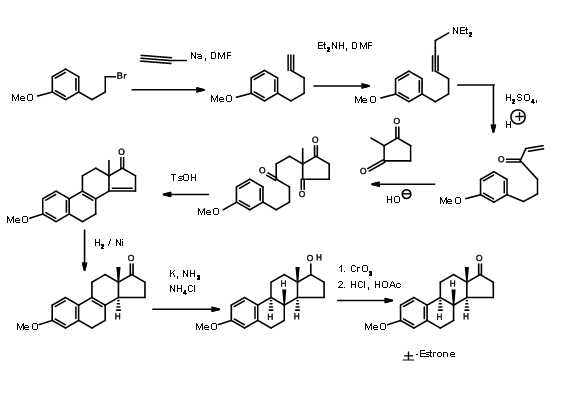
Hughes (1960) confió en las transformaciones aldol para su enfoque A AD ABCD. Aquí hizo uso de los protocolos de reducción confiables desarrollados por varios trabajadores para controlar la estereoquímica en uniones de anillo (Fig 11.6)
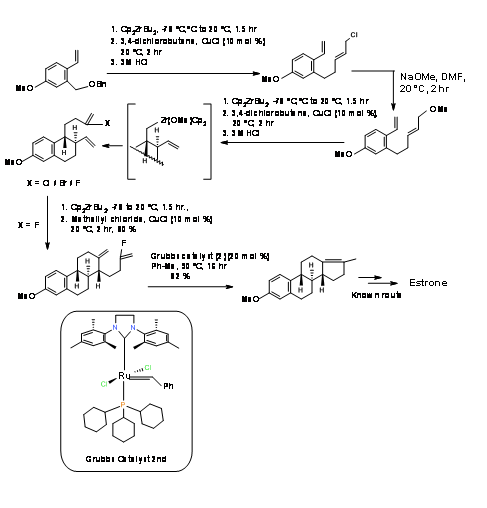
P. Hermann et al., (J. Org. Chem., 73, 6202 (2008)) habían intentado una estrategia secuencial de reacciones de cierre de anillos (RCR) para la síntesis estereoespecífica de Estrona. Estos trabajadores confiaron en el catalizador C P 2 ZrB U 2 estudiado extensamente en su laboratorio y desarrollaron una síntesis corta de 9 pasos a partir de dieno conocido (A AB ABC ABCD Approach) (Fig 11.7). La ciclación del anillo B procedió satisfactoriamente. La cilización del anillo C fue sensible al halógeno. Después de varios intentos, la ciclación procedió bien con el fluoruro de vinilo. La formación del anillo D usando catalizador de Zr no tuvo éxito. El cierre del anillo D finalmente se logró usando el catalizador de segunda generación Media:Grubbs. La modificación final del anillo D ya fue reportada por Bartlett P.A et.al., (J. Am. Chem. Soc., 95, 7501 (1973) completando así una síntesis formal de Estrone.
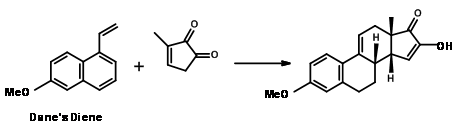
Marko Weimar et al., (J. Org. Chem., 75, 2718 (2010)) han reportado una Transformada DA muy exitosa para la formación de un anillo CD a partir del dieno de Dane como anillo AB y un anillo D como dienófilo (Fig 11.8) (Enfoque AB ABCD; ver referencias citadas para enfoques similares).
La clave para el éxito de esta estrategia fue el catalizador quiral libre de metales, el cual ellos diseñaron exitosamente mediante la introducción de tres sitios de unión H. El catalizador que funcionó eficientemente fue el medio:sal amidina axialmente quiral 11.9.
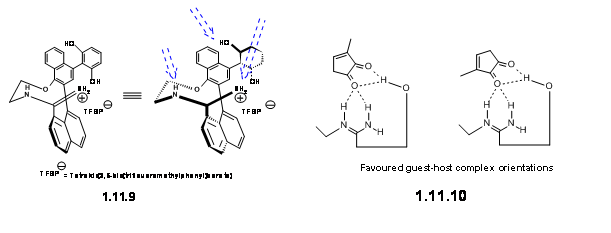
Han sugerido que este ligando formó un complejo hospedador-huésped con el dienófilo como se representa en 11.10.
Bajo estas condiciones, la reacción de Diels-Alder procedió con excelente rendimiento. Este compuesto se convirtió en Estrona como se muestra en la Figura 11.11.
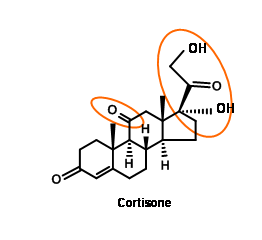
Síntesis de cortisona
La cortisona atrajo la atención de varios químicos sintéticos, debido a que esta droga maravilla solo estaba disponible en cantidades diminutas de fuentes animales. Dos características desafiantes en la estructura de la cortisona fueron el grupo ceto-C11 y el patrón de oxigenación 1,2,3- en la cadena lateral de dos carbonos en C17.
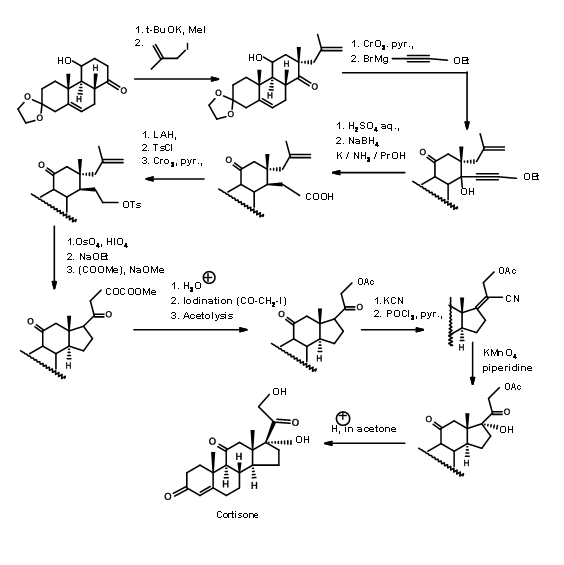
Sarrett (J. Am. Chem. Soc., 74, 4974 (1952); J. Am. Chem. Soc., 76, 5031 (1954)) utilizó un enfoque ABC ABCD. Su molécula inicial tenía todas las características necesarias para los anillos A, B y C de Cortisona. Tenía un grupo C11-OH y una cetona convenientemente colocada para construir el anillo D. Aprovecharon las restricciones estereoelectrónicas conocidas de las reacciones aniónicas en un anillo rígido de 6 miembros para construir la unión del anillo trans C/D (Fig 11.12). Esta ciclación tiene dos características destacables. La olefina sirvió como cetona enmascarada. A diferencia de la síntesis de colesterol de Woodward (Fig 11.3), que tuvo un sitio competitivo para la formación de aniones, en este esquema solo es factible un anión que conduce a un producto predecible.
Un nuevo enfoque interesante en la síntesis de esteroides vino de Y. Horiguchi (J. Org. Chem., 51, 4325 (1986)). Esto podría describirse como CD BCD ABCD Approach. Obsérvese que la oxigenación C11 y los carbonos necesarios para el anillo A llegaron a través de una sola etapa de oxidación, como se contempla en su retroanálisis mostrado en la Figura 11.13.
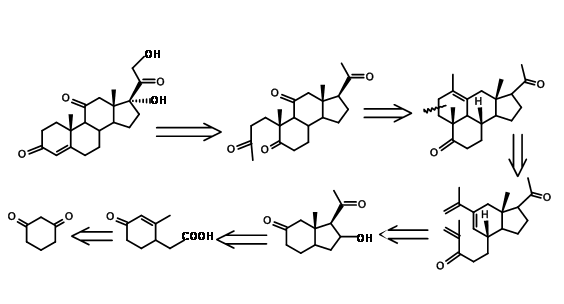
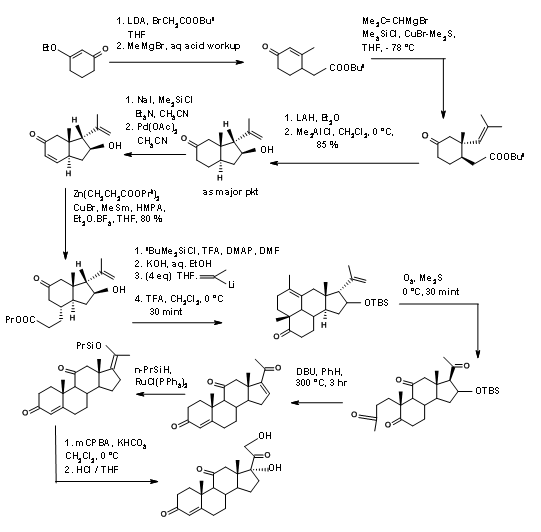
En la Figura 11.14 se muestra un esquema sintético detallado de Horiguchi. La estrategia para la formación de A así como del anillo D es de interés en esta síntesis.
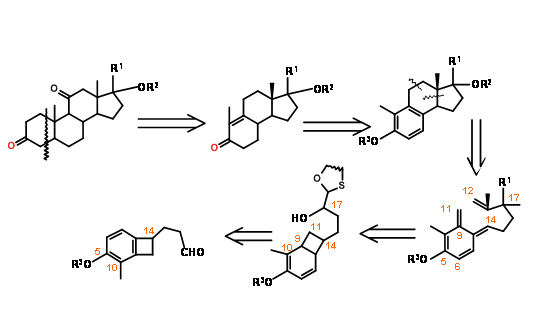
El retroanálisis de Nemoto (J. Org. Chem., 55, 5625 (1990)) proporcionó una interesante estrategia de apertura de anillo electrocíclico — cicloadición para un enfoque B BCD ABCD (Fig 11.15).
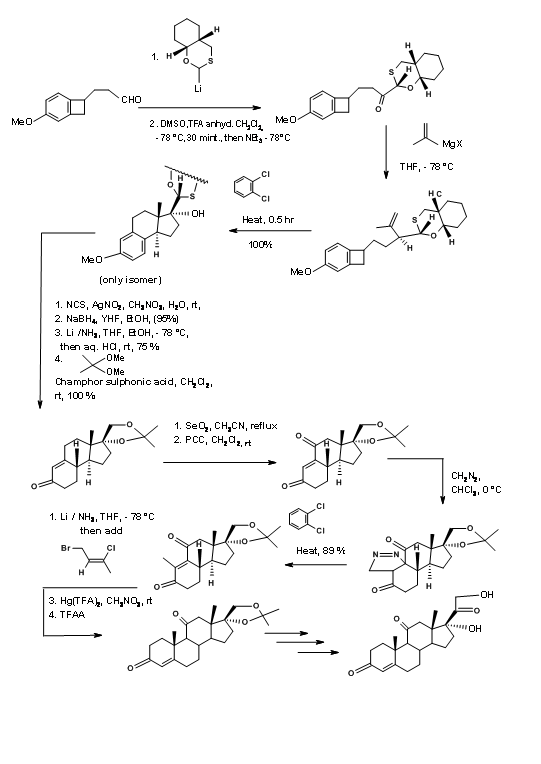
El esquema sintético se muestra en la Figura 11.16. Tenga en cuenta el versátil auxiliar quiral en el primer paso que sirve para varios propósitos útiles de formación de enlaces además de guiar tres centros asimétricos en anillos C/D.
La fascinación por dominar el esqueleto esteroideo aún continúa sin disminuir.

