12: Síntesis de la clorofila de Woodward
- Page ID
- 74255
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La clorofila, el más conspicuo de los productos naturales, ha mantenido la fantasía de los químicos orgánicos durante más de dos siglos, no sólo por su compleja estructura sino también por su rollo fotoquímico en la producción de alimentos que sustentan a todos los seres vivos de este planeta. Los trabajos de aislamiento y elucidación de la estructura comenzaron a finales del siglo XIX. Esta monumental actividad que comenzó con Willstätter, culminó en la elucidación de la estructura completa para la clorofila 'a' sólo a mediados del siglo XX. La mayoría de estas obras sobresalientes, extendidas a lo largo de medio siglo, tuvieron lugar cuando la química orgánica moderna estaba en su infancia. La síntesis de Clorofila 'a' de R. B. Woodward 1 es aclamada fue un logro sobresaliente en síntesis orgánica y se ubica entre las gemas resplandecientes en síntesis. El análisis preliminar para la síntesis, el persistente apego planificado sobre esta compleja y delicada química de su escuela y la lógica del famoso enfoque woodwardian son buenas lecciones para cualquier estudiante exigente de la Síntesis Orgánica.
Análisis antes de iniciar la síntesis
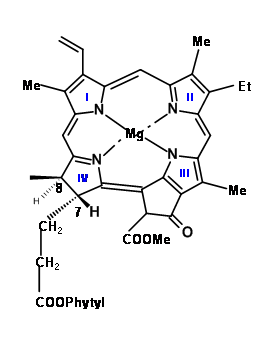
En la citada conferencia, Woodward inicia sus discusiones sobre síntesis con una serie de preguntas que delinean no sólo los rasgos críticos de la estructura bajo adjuntar, sino que también llega a un objetivo plausible y enfoque para la síntesis de esta compleja molécula. La estructura de la clorofila 'α' se muestra en (Fig 12.1).
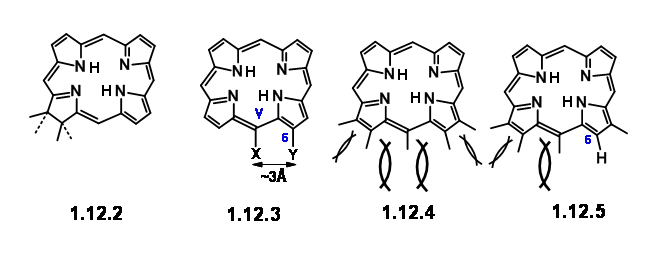
Trabajos anteriores habían establecido que el átomo de magnesio y el grupo fitílico eran fáciles de eliminar y poner en su lugar a través de una química bien establecida. La clorofila 'α' pertenece a la familia de pigmentos de color verde clorinas (12.2). Las clorinas simples se oxidan fácilmente (pierden sus hidrógenos 'extra') para dar las porfirinas más conjugadas (12.3). Pero algunos clorinos como la clorofila lo hacen solo bajo condiciones drásticas. La segunda característica que llamó su atención es el anillo carbocíclico condensado de cinco miembros unido al anillo III. Un estudio cercano de los modelos moleculares sugirió que una porfirina, que tenía una cadena de sustituyentes en las posiciones C5, C6, Cγ, C7 y C8, estaría altamente abarrotada como se muestra en (12.3) y (12.4). Señalaron que las clorinas y porfirinas que tuvieron una sustitución en Cγ y un grupo carboxilo en C6, sueltan C O 2 con facilidad, mientras que ausencia de sustitución de Cγ
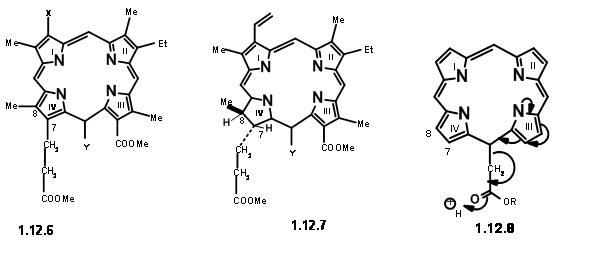
hizo que el carbonilo C6 aumentara la estabilidad. Todas estas características los llevaron a concluir que en las porfirinas, los espacios en C7/Cγ y Cγ/C6 son los más concurridos. La descarboxilación reduce parcialmente esta cepa (12.5). La presencia de sustituyente en Cγ también aumenta la cepa para el espacio C7/Cγ. Este hacinamiento es quizás parcialmente aliviado por la formación del anillo carbocíclico en Cγ/C6. Además, la cepa a C7/Cγ podría aliviarse mediante la introducción del hidrógeno 'extra' en C7 y C8. Los mismos factores de cepa influirían en la disposición trans de los sustituyentes en C7 y C8. Dicho análisis detallado de la estructura dada no solo les ayudó a comprender la estructura dada sino que también sugirió que el 'Objetivo' para la síntesis podría ser un tipo porfilina (12.6). Una vez que se sintetiza, tal estructura podría ser forzada a pasar a tomar los hidrógenos 'extra' y pasar a (12.7). Quedaron algunas preguntas. El grupo vinil del primer anillo fue considerado como muy sensible para soportar el rigor de la síntesis proyectada.
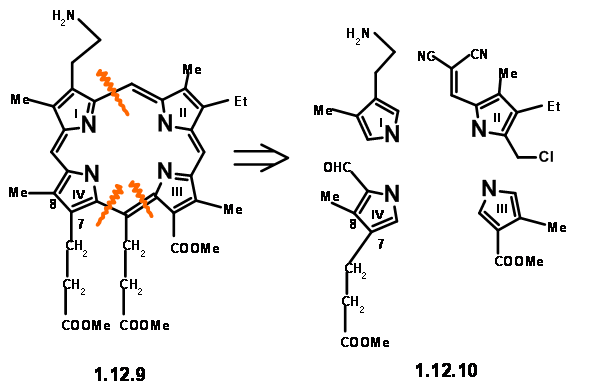
De ahí que se sustituyó por una cadena equivalente de aminopropano. Como se muestra en la estructura (12.7), el residuo necesario en Cγ es un grupo ácido acético. Sin embargo, el análisis mecanicista de tal porfirina (12.8) sugirió que tal unidad eliminaría fácilmente debido a un 'factor electrónico' esperado (en realidad, ahora diríamos 'actividad similar a la enamina'). Decidieron hacer de esta unidad un residuo de ácido propiónico para evitar esta inestabilidad. Ahora hemos llegado a una estructura objetivo (12.9). Con base en la conocida química pirrol, decidieron hacer el lado derecho y el lado izquierdo de la molécula de forma independiente y condensar estas unidades en un tetrámero. De esta manera, llegaron a las siguientes cuatro unidades monoméricas (12.10).
Unidad RHS: Las unidades pirrol II y III se combinaron para dar la unidad dímera esperada en buenos rendimientos. La acilación con cloruro de β-carbometoxipropionilo dio la unidad RHS (12.17).
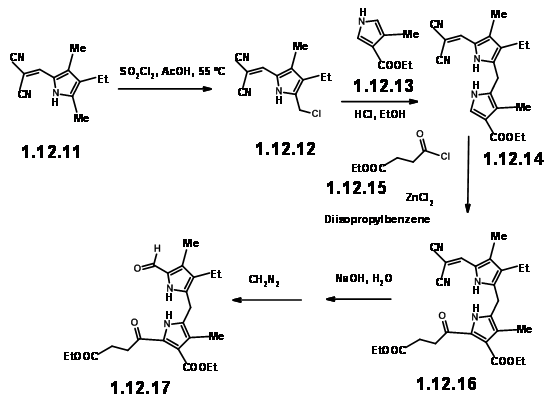
Con esta unidad RHS (12.17) a mano, intentaron la ciclación crucial con una unidad LHS modelo fácilmente disponible (12.18). Al condensarse en condiciones ácidas, seguida de oxidación con yodo, se pudo obtener la porfirina requerida (12.19) con un rendimiento aceptable del 25%.
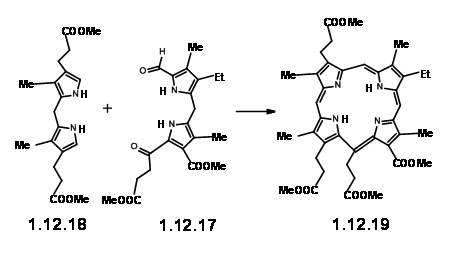
Animados con este resultado, siguieron adelante para sintetizar la unidad LHS real (12.26).
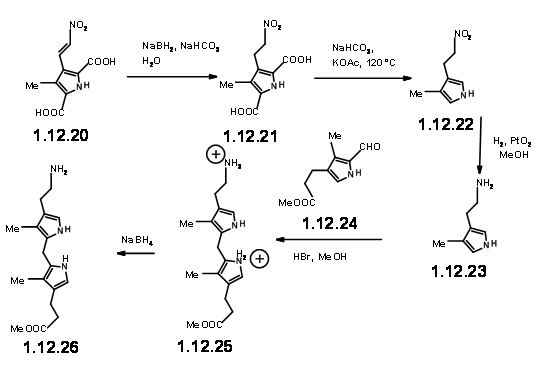
Con la unidad LHS lista a la mano, miraron la ciclación de estas dos unidades. Se dieron cuenta de que esta condensación podría dar dos productos debido a dos orientaciones diferentes de los reactivos. Aunque el rendimiento de este producto de condensación fue comparable a la condensación anterior, vieron algunos inconvenientes.
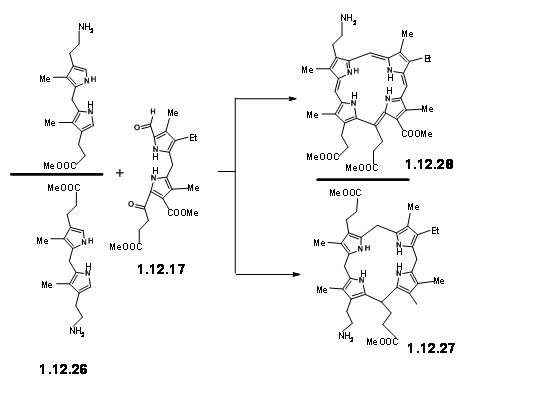
El rendimiento no fue aceptable para su propósito proyectado. Además, esta ruta dio como resultado la formación de productos isoméricos, cuya asignación de estructura planteó problemas. Tal 'inelegancia' (expresión utilizada por RBW en su conferencia) no era aceptable para su grupo. De ahí que decidieron congelar la movilidad de las dos unidades uniendo las unidades amina y aldehído en una base Schiff (12.29).
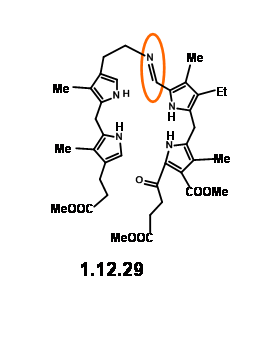
Esta artesanía magistralmente definida en ingeniería molecular no fue, sin embargo, fácil de lograr en la práctica. Los aldehídos de pirrol fueron generalmente no reactivos y solo se pudieron convertir en bases de Schiff bajo catálisis ácida o condiciones tamponadas. El problema surgió de la unidad LHS que demostró ser muy sensible a tales condiciones de reacción. No se observó rastro del producto de condensación esperado. Después de varios experimentos, la activación en la unidad de aldehído a través de bases de Schiff seguida de condensación con unidad LHS vía intercambio de bases se convirtió en un enfoque viable. Pero el descubrimiento de que tales bases Schiff podrían ser

convertido suavemente en tioaldehído (12.30) proporcionó un gran avance. Este tioaldehído se condensó suavemente con la unidad LHS en condiciones neutras con buen rendimiento. Esta base de Schiff 'extraordinariamente sensible', al tratamiento ácido dio el catión (12.31), el cual se aisló como el dibromuro. Esta dicación se oxidó inmediatamente con yodo a (12.32) y se aisló como la acetamida (12.33) en la acilación con anhídrido acético. A pesar de la sensibilidad de los intermedios y los rápidos pasos posteriores, la porfirina (12.33) se pudo obtener con buen rendimiento y se podría escalar hasta una escala de varios gramos.
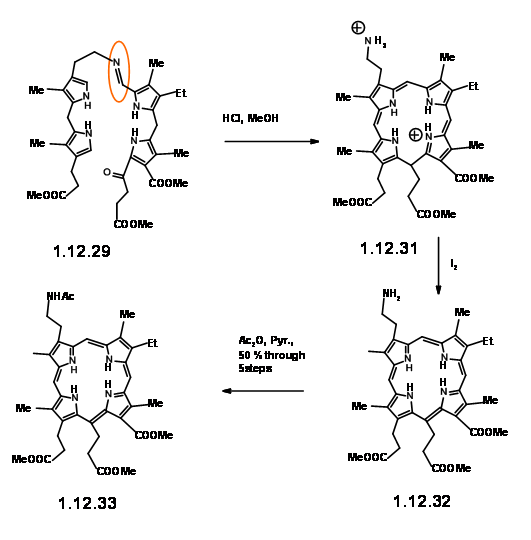
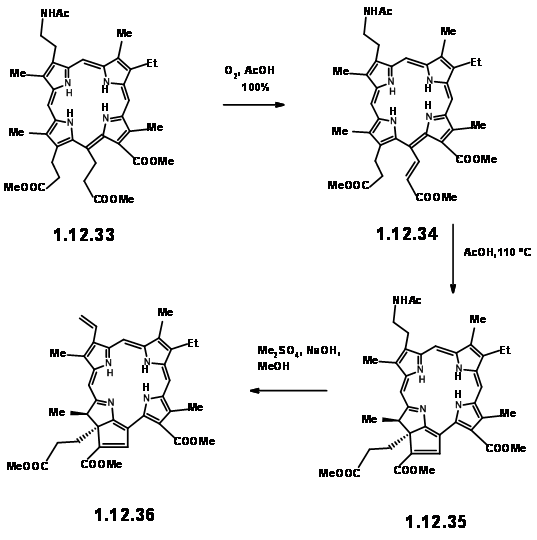
Cuando la porfirina (12.33) se calentó en ácido acético al aire, se produjo la migración del primer hidrógeno para dar (12.34). Al calentar en ácido acético a 110 0C, la cadena en Cγ cicló en C7 para dar la unidad de anillo reducido IV. Tenga en cuenta que la orientación de las dos cadenas en el anillo IV es trans como se esperaba. En esta etapa, la atención se desplazó hacia el grupo vinil en el anillo I. Esto se logró fácilmente mediante la secuencia exhaustiva de metilación-eliminación de Hoffmann mostrada anteriormente (12.36).
Al exponerse a la luz y al aire, el anillo extra se escindió fácilmente para dar un éster pirúvico y un grupo formilo (12.37). El grupo piruvilo extra se escindió fácilmente en KOH metanólico, lo que condujo a una metoxi lactona (12.380. El HCl seco dio el hamiacetal que se pudo resolver usando el método de la sal de quinina para dar (+) -Clorina-5 (12.39). La esterificación con diazometano expuso la unidad aldehído (12.40). El tratamiento del compuesto formílico (12.40) con HCN en trietil amina dio la cianolactona (12.41), que en la reducción, esterificación e hidrólisis con HCl metanólico dio (12.44), el precursor de un producto de ciclación de Dieckmann.
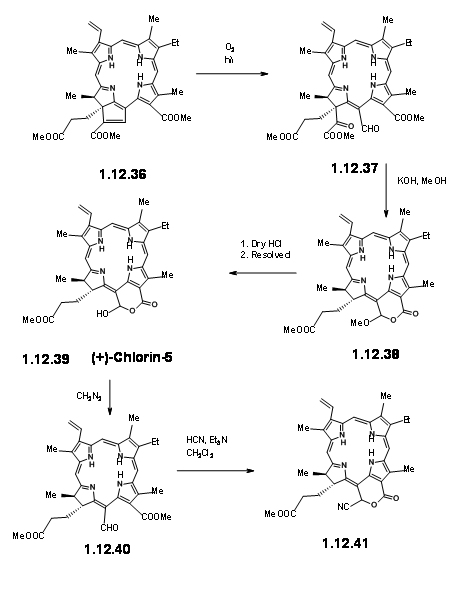
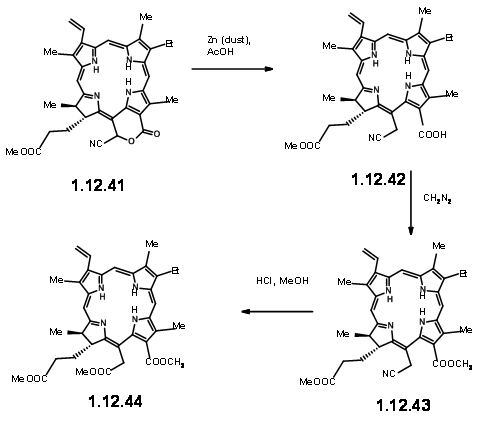
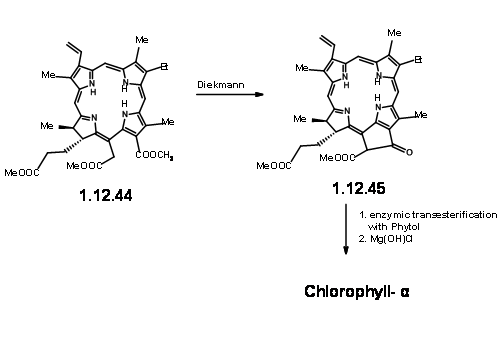
De aquí a (-) -Clorofila α ya se conocía. Un Diekmann seguido de la introducción del grupo fitilo por métodos enzimáticos completó la síntesis (Fortchr. Chem. Forsch., 2, 538 (1952)).
A día de hoy, esta obra maestra en síntesis orgánica tiene varias características que mantienen el interés para los amantes del Arte y la Lógica en la síntesis orgánica.

