10: Estrategias en la Síntesis de Prostaglandinas
( \newcommand{\kernel}{\mathrm{null}\,}\)
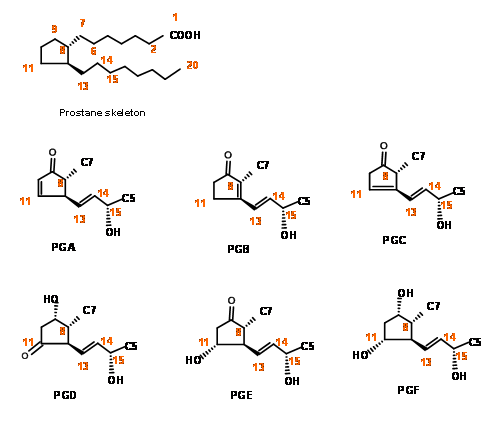
La síntesis química de prostaglandinas fue testigo de una actividad fenomenal durante los años 60 y 70; durante este período, la química orgánica vio un desarrollo intensivo en la 'desconexión' y 'Lógica' como herramientas primarias para la síntesis. Este periodo también vio el desarrollo de varios nuevos reactivos para la síntesis estereoselectiva. La complejidad de la estructura del esqueleto PG planteó un gran desafío para la síntesis. El hecho de que las moléculas pertenecientes a esta familia tuvieran un gran potencial como candidatos a fármacos pero estuvieran disponibles solo en cantidades diminutas de fuentes naturales fue la razón principal de la intensa actividad en la síntesis química y modificaciones esqueléticas para los estudios de SAR. El sistema de numeración en el esqueleto y las principales características estructurales de esta familia de moléculas se pueden observar en la Figura 10.1
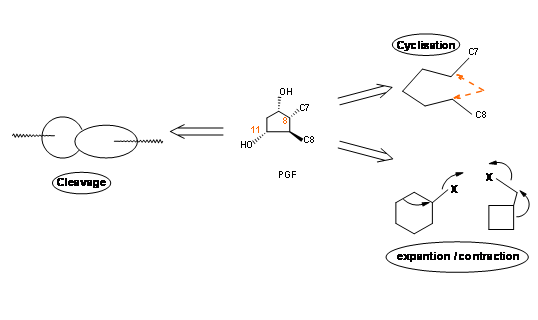
Colocar un grupo cetogénico en C9 es una operación delicada porque tales β- hidroxicetonas se deshidratarían fácilmente para dar un esqueleto de PGA. En un anillo de cinco miembros, el sistema PGA podría volver a someterse a una isomerización lista a PGB, un sistema de anillo estable, probablemente a través de un esqueleto PGC. En la reducción con borohidruro de sodio, el grupo ceto-en C9 se reduce a una mezcla 9α- y los epímeros no naturales 9β-. El esqueleto natural de PGF tiene una configuración 9α- para el grupo —OH. En el esqueleto natural de PGF tenemos cuatro centros asimétricos en un anillo de cinco miembros. Como bien sabéis, un anillo de cinco eslabones es conformacionalmente muy flexible. Por lo tanto, establecer una estereoquímica precisa en este anillo planteó un gran desafío durante los años 60; podría haber tres estrategias principales para la construcción de sistemas de anillos de cinco miembros (Fig 10.2).
- Una cadena abierta podría ser ciclada a un anillo.
- Un anillo de cicloalcano adecuado podría ser un anillo expandido o contraído a un anillo de cinco miembros.
- Se podría abrir un sistema de anillo biciclo [l, m, n] adecuado para dar un anillo de cinco eslabones.
Veamos algunos esfuerzos sintéticos sobresalientes que cumplieron con éxito estos desafíos en la química de las prostaglandinas.
Ciclización de precursores de cadena abierta
Establecer una serie de centros asimétricos en una cadena abierta es un desafío tan grande como colocarlos en un anillo de cinco miembros. El primer intento de Corey en 1968 fue diseñar un anillo adecuado de seis miembros, abrir el anillo a una cadena y luego ciclar la cadena regioespecíficamente al anillo requerido de cinco miembros (J. Am. Chem. Soc., 90, 3245 (1968)). Su retroanálisis y síntesis se muestran en la Figura 10.3. La primera reacción DA estableció dos estereocentros cruciales que guían los estereopuntos restantes en el anillo de cinco miembros formado por la reacción aldólica. Esta síntesis es un buen ejemplo de síntesis convergente. Los materiales de partida vienen por dos rutas diferentes que se muestran en la Figura 10.4.
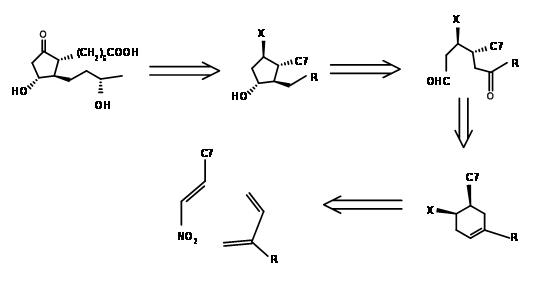
La desconexión de Kojima del anillo de ciclopentano en el enlace C8 — C12 proporcionó una cadena abierta. La cuidadosa planificación de los grupos funcionales de la cadena propuesta permitió a su grupo planificar los estereocentros de una manera más directa. Su retroanálisis y ruta sintética se muestran en la Figura 10.5.
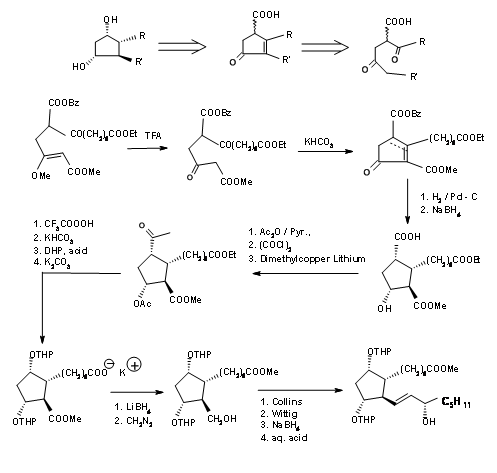
Precursor de anillo de ciclopentano
El difícil problema de la instalación de estereocentros en un anillo de cinco miembros fue resuelto elegantemente por Corey et al. , (Tet. Lett., 311 (1970)) (Fig 10.6). Observe la precisión artística con la que los sustituyentes se tejen en un anillo de cinco miembros con la ayuda de reacciones de yodolactonización y formación de anillos epóxidos. Un ejemplo de dominio en el Arte de la Síntesis.
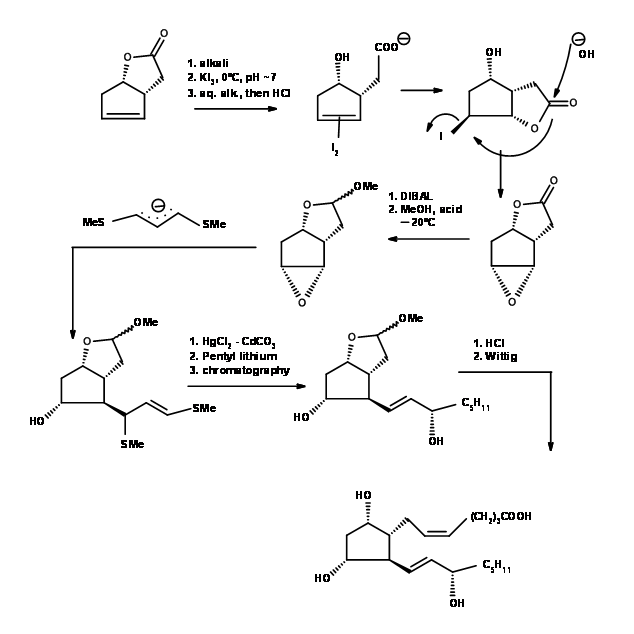
F.S. Alvarez et al., aprovecharon las limitaciones estéricas debido a eclipsar cepas en anillos de cinco miembros y tejieron tres centros asimétricos seguidos en un anillo de cinco miembros (J. Am. Chem. Soc., 94, 7823 (1972)) (Fig 10.6).
Anillo de ciclohexano Precursor
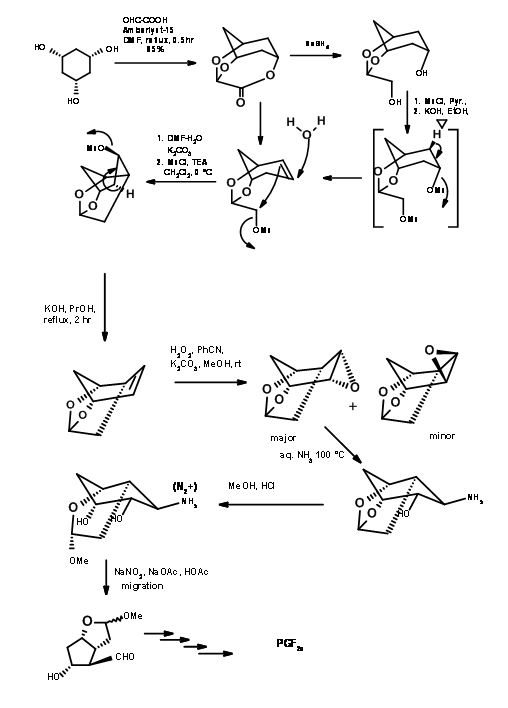
Partiendo de todo cis-ciclohexan1,3,5-triol, la escuela de Woodward demostró su excelencia en el Arte de la Síntesis Orgánica. El primer paso es la protección diferencial con ácido glioxálico (Fig 10.8). Tenga en cuenta un aspecto interesante del diseño arquitectónico. Esta cadena de dos grupos protectores de carbono se incorpora finalmente a la estructura principal. Tenga en cuenta que esto también logra otra tarea muy difícil a saber, colocar una cadena reactiva de 2 carbonos en la fase cóncava abarrotada. La solvolisis del mesilato es asistida por la olefina vecina. Tenga en cuenta la elegante planificación del paso de contracción del anillo.
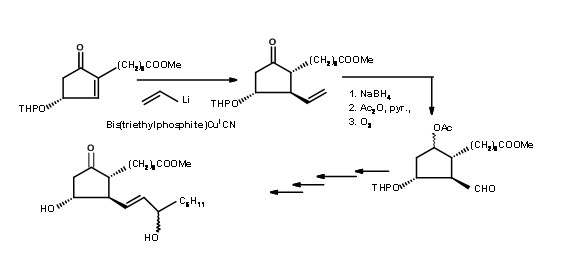
En 1973, Corey reveló una síntesis (Tet. Lett., 309 (1973)) basado en un anillo de seis miembros que implica una expansión del anillo y una contracción del anillo para lograr el objetivo (Fig 10.9).
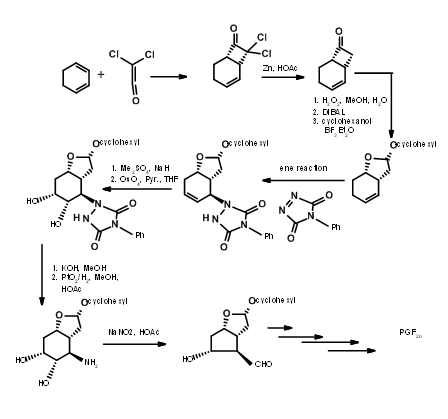
Enfoques de bicicloalcano
Existen varias síntesis basadas en dicha estrategia para derivar la ventaja estereoquímica de un sistema de anillos de bicicloalcano. Aquí discutiremos la estrategia de Bicycloheptano de Corey (J. Am. Chem. Soc., 91, 5675 (1969): Ann. N.Y. Acad. Sci., 180, 24 (1971)). Esta ruta proporciona entrada a todos los PG naturales y antinaturales. Proporciona facilidad para la separación de enantiómeros en una etapa muy temprana usando el procedimiento de sal de anfetamina en el primer ácido quiral alcohol. Este esquema ha sido escalado a escalas multigramáticas. El retroanálisis de Corey se muestra en la Figura 10.10. Este retroanálisis condujo a la reacción de DA.
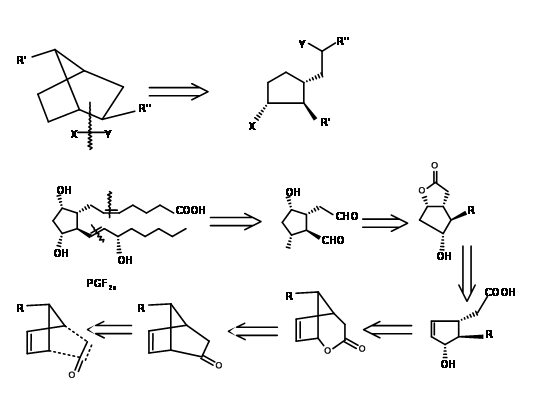
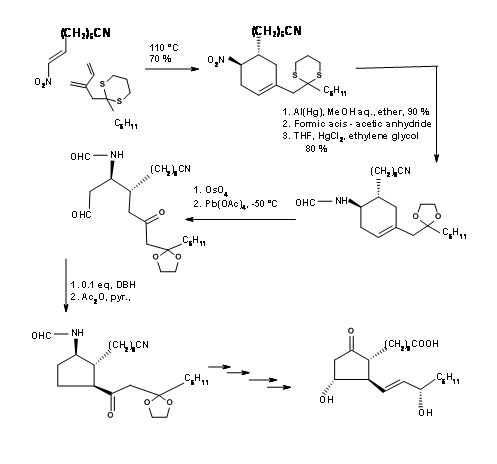
El primer problema fue la síntesis de un ciclopentadieno con el grupo alquilo en el carbono de metileno. Las rutas aniónicas para la alquilación de ciclopentadieno condujeron principalmente a una mezcla de ciclopentadienos, debido a la fácil isomerización de la olefina. El problema se resolvió por alquilación con anión talio (Fig 10.11). El ciclopentadieno deseado se obtuvo con un rendimiento de aproximadamente 97%. El siguiente reto fue en la reacción de DA.
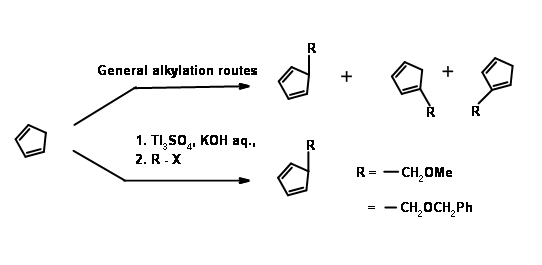
Las cetenas no se someten a cicloadición de Diels-Alder. Dan productos de ciclobutano incluso con dienos. Usando un 'precursor de cetena enmascarado' se resolvió este problema como se muestra en la Figura 10.12. El biciclo [2.2.1] heptano así formado sufrió oxidación de Baeyer-Villiger como se esperaba. La saponificación de la lactona dio un anillo de cinco miembros con tres centros asimétricos en su lugar. El cuarto centro se generó a través de una reacción de yodolactonización.
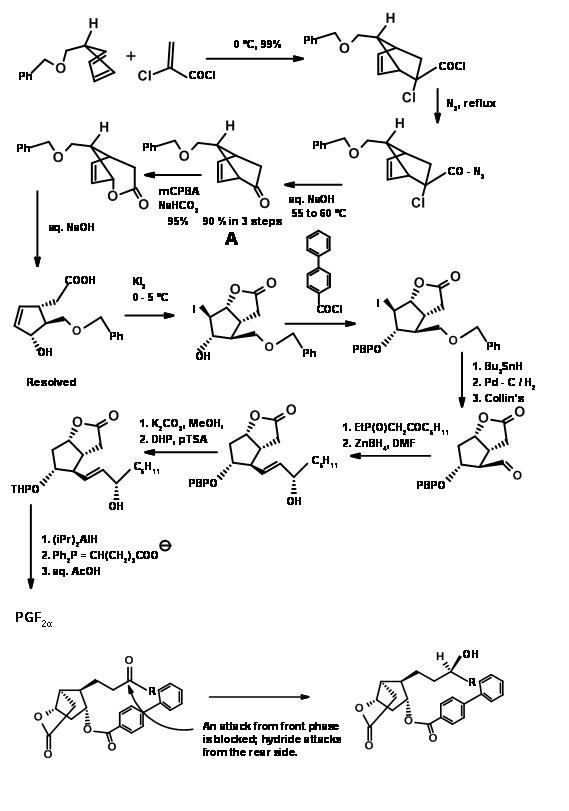
Obsérvese la estereoquímica de esta etapa de yodolactonización. Después de la eliminación del halógeno, el —OH en C11 se protegió como éster p-fenilbenzoílico. Este éster no solo dio un derivado cristalino para la purificación (una característica útil durante las reacciones a gran escala) sino que también sirvió como agente de blindaje para inducir C15- (S) — OH en una etapa posterior. La hidrogenólisis del C13 — OR a — OH seguida de la oxidación de Collins dio el aldehído C13 adecuado para una reacción de Wittig. La cetona α, β-insaturada se redujo selectivamente a C15- (S) — OH usando borohidruro de zinc. A esta selectividad se le ha atribuido el efecto de blindaje del grupo aroílo voluminoso desde la parte frontal, permitiendo que el hidruro entre estereoselectivamente. La reducción del grupo éster con hidruro de trialquilaluminio dio el hemiacetal para el Wittig final. Tenga en cuenta las protecciones diferenciales utilizadas en esta síntesis en diferentes etapas.

