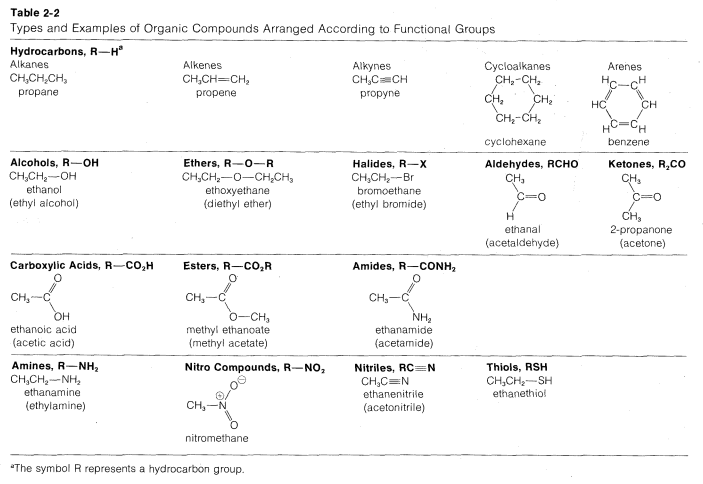
2.3: Clasificación por Grupos Funcionales
- Page ID
- 72489
Hay una serie de tipos recurrentes de características estructurales en compuestos orgánicos que comúnmente se conocen como grupos funcionales. De hecho, un enfoque tradicional del tema de la química orgánica implica la clasificación de los compuestos según sus grupos funcionales. Así, las características estructurales\(C = C\)\(C \equiv C\),\(C = O\),\(OH\),\(NH_2\), y\(C \equiv N\) son los grupos funcionales de alquenos, alquinos, compuestos carbonílicos, alcoholes, aminas y nitrilos, respectivamente. Será útil observar las características estructurales de algunos de los principales tipos de compuestos orgánicos aunque los detalles de su química no serán discutidos hasta capítulos posteriores. En la Tabla 2-2 se dan ejemplos de las estructuras dispuestas de acuerdo con sus grupos funcionales. Los ejemplos elegidos son representativos de compuestos que contienen carbono e hidrógeno (hidrocarburos) así como compuestos que contienen halógenos, oxígeno, nitrógeno y azufre. No esperamos que memorice esta tabla. Con el tiempo te familiarizarás con todos los tipos de estructuras que contiene.
En la Tabla 2-2 generalmente hemos utilizado nombres sistemáticos como nombres de primera elección porque estos nombres enfatizan las relaciones entre los compuestos y alivian la carga para el estudiante principiante en tener que recordar muchos nombres especiales. Tenemos pocas esperanzas de que nombres sistemáticos como metanal, 2-propanona y ácido etanoico pronto reemplacen a los nombres no sistemáticos comúnmente utilizados formaldehído, acetona y ácido acético. Pero no hay duda de que todo químico orgánico sabe qué compuestos representan los nombres metanal, 2-propanona y ácido etanoico, por lo que el principiante puede comunicarse con estos nombres y luego familiarizarse y usar los nombres especiales. Tendremos más que decir sobre este tema en el Capítulo 3.
¿Cómo son útiles las clasificaciones de grupos funcionales?
Una de las principales razones para clasificar los compuestos por sus grupos funcionales es que también clasifica su comportamiento químico. Con esto queremos decir que las reacciones de los compuestos y, en cierta medida, sus propiedades físicas están profundamente influenciadas por la naturaleza de los grupos funcionales presentes. De hecho, muchas reacciones orgánicas implican transformaciones del grupo funcional que no afectan al resto de la molécula. Por ejemplo, los alcoholes\(R-OH\),, se pueden transformar en una serie de otros compuestos, tales como haluros orgánicos,\(R-Cl\) o\(R-Br\); éteres,\(R-O-R\); y aminas,\(R-NH_2\) sin cambiar la estructura del grupo hidrocarbonado\(R\). Además, se puede esperar que cualquier compuesto que posea un grupo funcional particular presente reacciones características de ese grupo y, en cierta medida al menos, de compuestos inorgánicos con grupos funcionales similares.
Un buen ejemplo del uso del concepto de grupo funcional es para las propiedades ácido-base. Los alcoholes\(ROH\),, están estructuralmente relacionados con el agua\(HOH\),, en que ambos poseen una función hidroxilo. Entonces podemos esperar que la química de los alcoholes sea similar a la del agua. De hecho, ambos son ácidos débiles porque el\(OH\) grupo tiene un protón reactivo que puede donar a una sustancia suficientemente fuertemente básica, escrito como\(:B\) aquí:
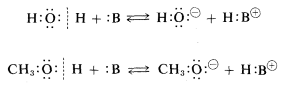
El agua y los alcoholes son bases débiles debido a que los oxígenos de sus\(OH\) grupos tienen pares de electrones no compartidos para usar en la unión con un protón donado por un ácido,\(HA\):
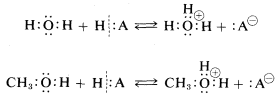
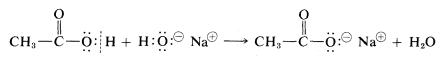
Podemos llevar la analogía más allá para incluir ácidos carboxílicos,\(RCO_2H\), que también tienen una función hidroxilo. También deben poseer propiedades ácidas y básicas. Tienen estas propiedades y son, de hecho, ácidos más fuertes que el agua o los alcoholes y forman sales con bases:
Las aminas\(RNH_2\),, están estructuralmente relacionadas con el amoníaco\(NH_3\), y por lo tanto podemos predecir que tendrán propiedades similares. Una propiedad del amoníaco que probablemente habrás encontrado antes es que actúa como base y forma sales con ácidos. Las aminas se comportan igual:
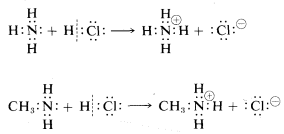
Es con lógica de este tipo -inferir el comportamiento químico a partir de analogías estructurales- que se puede entender gran parte de la química orgánica. Sin embargo, existen otros esquemas de clasificación lógica y uno de ellos depende más de los tipos de reacciones que de los grupos funcionales.
Clasificaciones por tipos de reacción
El fundamento de la clasificación por tipos de reacción es que diferentes grupos funcionales pueden mostrar los mismos tipos de reacciones. Así, como acabamos de ver, los alcoholes, los ácidos carboxílicos y las aminas pueden aceptar un protón de un ácido adecuadamente fuerte. Afortunadamente, hay muy pocos tipos diferentes de reacciones orgánicas, al menos en cuanto al resultado general que producen. Las más importantes son las reacciones ácido-base, sustitución, adición, eliminación y reordenamiento. A continuación se dan algunos ejemplos de estos, y debe comprender que estos son descriptivos del cambio químico general y no se implica nada en cuanto a cómo o por qué ocurre la reacción (ver también la Sección 1-1I).
Sustitución de un átomo o grupo de átomos por otro:
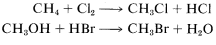
Adición, generalmente a un doble o triple enlace:
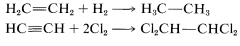
Eliminación, que es el reverso de la adición:
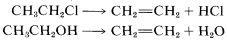
Reordenamiento donde una estructura se convierte en una estructura isomérica:
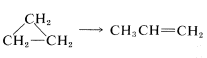
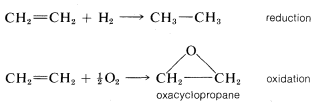
Ciertas reacciones comúnmente se describen como reacciones de oxidación o reducción y más simplemente se pueden considerar como reacciones que resultan en cambios en el contenido de oxígeno o hidrógeno de una molécula por reacciones directas o indirectas con oxígeno o hidrógeno, respectivamente. Con frecuencia caen dentro de una de las categorías ya mencionadas. La reducción del eteno a etano es claramente la adición, al igual que la oxidación del eteno a oxaciclopropano:
Las reacciones que conducen a una degradación sustancial de las moléculas en fragmentos más pequeños son más difíciles de clasificar. Un ejemplo es la combustión de etano a dióxido de carbono y agua. Todos los enlaces químicos en los reactivos se rompen en esta reacción. Parece inútil tratar de clasificar esto como cualquier cosa que no sea una reacción completa de combustión u oxidación:
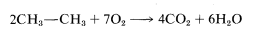
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


