2.4: Isomerización en Compuestos Orgánicos
- Page ID
- 72478
Más de una sustancia estable puede corresponder a una fórmula molecular dada. Ejemplos son butano y 2-metilpropano (isobutano), cada uno de los cuales tiene la fórmula molecular\(C_4H_{10}\). Del mismo modo, el metoximetano (dimetil éter) y el etanol tienen la misma fórmula\(C_2H_6O\):
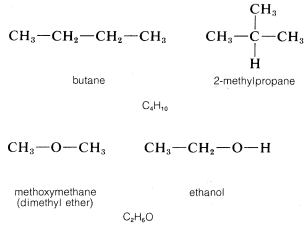
Los compuestos que tienen el mismo número y tipos de átomos se denominan isómeros. \(^2\)Mientras que solo se conoce una sustancia estable correspondiente a la fórmula\(CH_4\), se han preparado treinta y cinco isómeros estables de la fórmula\(C_9H_{20}\). A partir de esto se puede comenzar a sentir la rica variedad de la química orgánica, lo que lleva a muchos problemas: en distinguir un compuesto de otro, en determinar estructuras, y también en encontrar nombres adecuados para los compuestos. En el resto de este capítulo describiremos un tipo de isómero -el isómero de posición- y en capítulos posteriores discutiremos otro tipo de isómero -el estereoisómero- y los enfoques experimentales que se utilizan para establecer la pureza, identidad, estructura y estereoquímica de los compuestos orgánicos.
Isómeros de posición
Los compuestos que tienen el mismo número y tipo de átomos pero que tienen diferentes disposiciones de enlace entre los átomos se denominan isómeros de posición. Butano y 2-metilpropano son ejemplos de isómeros de posición. Los átomos están conectados de manera diferente en las dos estructuras porque la cadena carbonada en butano es una cadena lineal o continua, mientras que en el 2-metilpropano es ramificada:
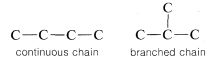
Por lo tanto, estas dos moléculas son estructuralmente diferentes y, en consecuencia, no tienen las mismas propiedades químicas y físicas. No se pueden convertir uno en otro sin romper y rehacer\(C-C\) y\(C-H\) ataduras. El metoximetano y el etanol también son isómeros de posición porque el oxígeno claramente está conectado de manera diferente en las dos moléculas:
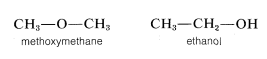
El término isómero de posición significa lo mismo que isómero constitucional. También se usa la designación isómero estructural, pero este término es tomado por algunos para incluir tanto los isómeros de posición como los estereoisómeros; es decir, “estructura” puede significar tanto la forma en que los átomos están conectados como sus diferentes disposiciones en el espacio.
El número de isómeros de posición posibles para una fórmula dada aumenta rápidamente con el número creciente de átomos de carbono, como puede verse a partir del número de estructuras teóricamente posibles de fórmula\(C_nH_{2n+2}\) hasta las\(n = 10\) dadas en la Tabla 2-3. En 1946, se informó que todos los 75 compuestos con valores de\(n = 1\) to\(n = 9\) habían sido preparados en el laboratorio. Antes de que podamos comenzar a discutir la química de estos compuestos es necesario saber cómo

para nombrarlos; sin reglas convenientes y sistemáticas para la nomenclatura que se adopten universalmente, se produciría una confusión catastrófica. Abordaremos este problema en el próximo capítulo.
\(^2\)El prefijo iso es de la palabra griega que significa lo mismo o similar.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


