8.3: Termoquímica de las reacciones de sustitución
- Page ID
- 73221
Las reacciones iónicas o polares de haluros de alquilo rara vez se observan en la fase vapor debido a que la energía requerida para disociar heterolíticamente un enlace carbono-halógeno es casi prohibitivamente alta. Por ejemplo, mientras que el calor de disociación del clorometano a un radical metilo y un átomo de cloro es\(84 \: \text{kcal mol}^{-1}\) (Tabla 4-6), la disociación a un catión metilo y un ion cloruro requiere aproximadamente\(227 \: \text{kcal mol}^{-1}\):
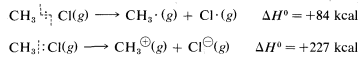
Sin embargo, se estima que el calor de disociación iónica del cloruro de metilo en solución acuosa es\(63 \: \text{kcal}\), y aunque esta reacción sigue siendo sustancialmente endotérmica, requiere aproximadamente\(227 - 63 = 164 \: \text{kcal}\) menos energía que en la fase gaseosa:
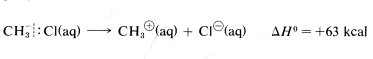
La razón es que los iones son mucho más estables en agua que en la fase gaseosa; por ejemplo, la transferencia de un ion cloruro del gas al agua es exotérmica por\(-85 \: \text{kcal}\). El\(\Delta H^\text{0}\) valor para la transferencia correspondiente de un catión metílico\(CH_3^\oplus\),, no se conoce con certeza, pero es sobre\(-80 \: \text{kcal}\). Estas energías de solvatación iónica son claramente grandes. En contraste, la solución\(\Delta H^\text{0}\) para cloruro de metilo en agua es pequeña (aproximadamente\(1 \: \text{kcal}\)). Podemos utilizar estos datos para calcular el calor de disociación iónica del clorometano en agua:
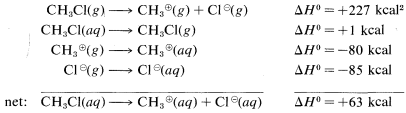
Los datos termoquímicos para la solvatación de iones tal como se utilizaron en los cálculos anteriores son difíciles de medir e incluso de estimar. Por lo tanto, este tipo de cálculo\(\Delta H^\text{0}\) de reacciones iónicas que involucran moléculas orgánicas en solución generalmente no se puede hacer. Como resultado, tenemos considerablemente menos posibilidades de evaluar la viabilidad termodinámica de las etapas individuales de las reacciones polares en solución que las de los procesos radicales en fase vapor. Las energías de enlace no son de gran utilidad para predecir o explicar la reactividad en reacciones iónicas a menos que tengamos alguna información que pueda usarse para traducir valores de fase gaseosa a\(\Delta H^\text{0}\) valores de solución\(\Delta H^\text{0}\).
\(^2\)Calculado a partir de los siguientes datos:
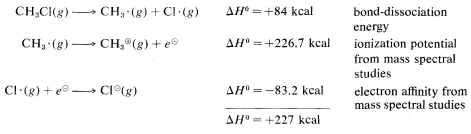
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


