8.4: Consideraciones generales de las reacciones de sustitución
- Page ID
- 73165
Ahora queremos discutir los desplazamientos por reactivos nucleofílicos (\(Y:\)) sobre derivados alquílicos (\(RX\)). Se trata de reacciones iónicas o polares que implican el ataque de un nucleófilo al carbono. Un ejemplo típico es la reacción del ion hidróxido con bromometano para desplazar el ion bromuro:
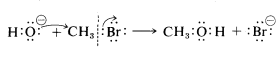
Se puede considerar que el par de electrones del\(C-O\) enlace ha sido donado por el ion hidróxido, mientras que el par de electrones del\(C-Br\) enlace se aparta con el ion bromuro de salida. Se abrevia el nombre para este tipo de reacción\(\text{S}_\text{N}\),\(\text{S}\) para sustitución y\(\text{N}\) para nucleofílica.
Las reacciones de este tipo son muy útiles. Pueden conducir a compuestos en los que el nuevo enlace al carbono en el grupo alquilo,\(R\) es al cloro, bromo, yodo, oxígeno, azufre, carbono, nitrógeno o fósforo, dependiendo de la naturaleza del nucleófilo utilizado.
Las sustituciones nucleofílicas son especialmente importantes para los haluros de alquilo, pero no deben considerarse confinadas a haluros de alquilo. Muchos otros derivados alquílicos como alcoholes, éteres, ésteres e “iones onio”\(^3\) también pueden sufrir\(\text{S}_\text{N}\) reacciones si las condiciones son apropiadas. El alcance de\(\text{S}_\text{N}\) las reacciones es tan amplio que es imposible incluir todos los diversos compuestos alquílicos y nucleófilos que reaccionan de esta manera. Más bien abordaremos el tema aquí a través de la consideración de los mecanismos de\(\text{S}_\text{N}\) las reacciones, para luego desarrollar el alcance de las reacciones en capítulos posteriores.
El mecanismo de una\(\text{S}_\text{N}\) reacción y la reactividad de un compuesto alquilo dado\(RX\) hacia un nucleófilo\(Y\) dependen de la naturaleza de\(R\)\(X\), y\(Y\), y de la naturaleza del disolvente. Para que una\(\text{S}_\text{N}\) reacción ocurra a una velocidad razonable, es muy importante seleccionar un disolvente que disuelva tanto el compuesto alquílico como el reactivo nucleófilo; puede requerirse una asistencia considerable tanto del disolvente como del nucleófilo para romper lo que generalmente es un\(C-X\) enlace ligeramente polar. Sin embargo, los disolventes que mejor disuelven compuestos orgánicos ligeramente polares rara vez disolverán los agentes nucleófilos comunes, bastante altamente polares, tales como\(NaBr\)\(NaCN\), y\(H_2O\). En la práctica, los disolventes relativamente polares, o mezclas de disolventes, como 2-propanona (acetona), 2-propanona acuosa, etanol, 1,4-dioxaciclohexano acuoso (dioxano), etc., proporcionan el mejor compromiso para las reacciones entre compuestos alquílicos y reactivos nucleófilos similares a sales. La importancia del disolvente en la estabilización de iones puede evaluarse a partir de la termoquímica estimada de las reacciones iónicas discutidas en la Sección 8-2.
\(^3\)Ejemplos de cationes -onio son

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


