8.E: Reacciones de Sustitución Nucleofílica y Eliminación (Ejercicios)
- Page ID
- 73234
Ejercicio 8-1 Escribir estructuras de Lewis para cada uno de los siguientes reactivos y clasificarlos como electrófilos, nucleofílicos, ambos, o ninguno evaluando si reaccionarán apreciablemente con el ion hidróxido,\(\ce{HO}^\ominus\), o ion hidronio,\(\ce{H_3O}^\oplus\). Escribir ecuaciones para cada una de las reacciones involucradas.
a.\(\ce{NH_3}\)
b.\(\ce{NH_2^-}\)
c.\(\ce{Na}^\oplus\)
d.\(\ce{Cl}^\ominus\)
e.\(\ce{Cl_2}\)
f.\(\ce{CH_4}\)
g.\(\ce{CN}^\ominus\)
h.\(\ce{CH_3OH}\)
i.\(\ce{CH_3} \overset{\oplus}{\ce{O}} \ce{H_2}\)
j.\(\ce{BF_4^-}\)
k.\(\ce{HBr}\)
l.\(\ce{HC \equiv C} \colon^\ominus\)
m.\(\colon \ce{CH_2}\)
n. \(\ce{FSO_3H}\)
o.\(\ce{SO_3}\)
Ejercicio 8-2 Identificar el electrófilo y el nucleófilo en cada una de las siguientes reacciones:
a.\(\ce{CH_3I} + \overset{\ominus}{\ce{O}} \ce{CH_3} \rightarrow \ce{CH_3-O-CH_3} + \ce{I}^\ominus\)
b.\(\ce{CH_2=CH_2} + \ce{Br_2} \rightarrow \overset{\oplus}{\ce{C}} \ce{H_2-CH_2-Br} + \ce{Br}^\ominus\)
c.\(\ce{CH_3NH_2} + \ce{CH_3I} \rightarrow \ce{(CH_3)_2NH} + \ce{HI}\)
Ejercicio 8-3 Calcular\(\Delta H^0\) para la reacción polar de un mol de bromometano con agua de acuerdo con la ecuación\(\ce{CH_3Br} + \ce{H_2O} \rightarrow \ce{CH_3OH} + \ce{HBr}\) (a) en fase gaseosa y (b) con todos los participantes en solución acuosa diluida. Para la Parte (a) necesitarás las energías de enlace de la Tabla 4-3 y para la Parte (b) necesitarás las energías de enlace y los siguientes\(\Delta H^0\) valores:
Ejercicio 8-4 El cloruro de etilo\(\left( 0.1 \: \text{M} \right)\) reacciona con yoduro de potasio\(\left( 0.1 \: \text{M} \right)\) en solución de 2-propanona (acetona)\(60^\text{o}\) a para formar yoduro de etilo y cloruro de potasio a una velocidad\(\left( v \right)\) de\(5.44 \times 10^{-7} \: \text{mol L}^{-1} \: \text{s}^{-1}\).
a. Si la reacción procediera por un\(S_\text{N}2\) mecanismo, ¿cuál es el valor de\(k\) (en unidades adecuadas) y cuál sería la velocidad de la reacción en moles por litro por segundo a\(0.01 \: \text{M}\) concentraciones de ambos reactivos? Muestra tu método de cálculo.
b. Supongamos que la tasa fue proporcional al cuadrado de la concentración de yoduro de potasio y al primer poder de la concentración de cloruro de etilo. ¿Cuál sería la tasa con\(0.01 \: \text{M}\) los reactivos?
c. Se inicia con soluciones inicialmente\(0.1 \: \text{M}\) en ambos reactivos, la velocidad de formación del yoduro de etilo inicialmente es\(5.44 \times 10^{-7} \: \text{mol L}^{-1} \: \text{s}^{-1}\), pero disminuye a medida que avanza la reacción y los reactivos se agotan. Trazar la velocidad de formación de yoduro de etilo frente a la concentración de cloruro de etilo a medida que avanza la reacción (recordando que una molécula de cloruro de etilo consume una molécula de yoduro de potasio). Supongamos que la velocidad de reacción es proporcional a la primera potencia de la concentración de cloruro de etilo; y a (1) la potencia cero, (2) la primera potencia y (3) la segunda potencia de la concentración de yoduro de potasio.
d. ¿Qué tipo de datos experimentales se necesitarían para determinar si la velocidad de reacción del cloruro de etilo con yoduro de potasio es de primer orden en cada reactivo o de segundo orden en cloruro de etilo y de orden cero en yoduro de potasio?
Ejercicio 8-5 La tasa de solvolisis del cloruro de terc- butilo en solución acuosa no se ve afectada por tener azida sódica\(\overset{\oplus}{\ce{Na}} \overset{\ominus}{\ce{N}} \ce{=} \overset{\oplus}{\ce{N}} \ce{=} \overset{\oplus}{\ce{N}}\),, en la solución, sin embargo los productos incluyen tanto 2-azido-2-metilpropano como alcohol terc - butílico:\(1\)

Mostrar cómo se puede utilizar esta información para determinar si se produce un\(S_\text{N}2\) mecanismo\(S_\text{N}1\) o un mecanismo en la solvolisis de cloruro de terc- butilo en solución acuosa.
Ejercicio 8-6 ¿Qué inferencia en cuanto al mecanismo de reacción podría hacer de la observación de que la velocidad de hidrólisis de cierto cloruro de alquilo en 2-propanona acuosa se retarda al tener una concentración moderada de cloruro de litio en la solución?
Ejercicio 8-7 Las ecuaciones 8-3 a 8-5 muestran cómo Kenyon y Phillips establecieron que la inversión de configuración acompaña a lo que ahora reconocemos como\(S_\text{N}2\) sustituciones. Para cada reacción, indicamos si\(\ce{R-O}\) o\(\ce{O-H}\) está roto por una línea vertical apropiadamente colocada. Explicar cómo la secuencia de pasos muestra que la inversión ocurre en la\(S_\text{N}2\) reacción de la Ecuación 8-5. Los símbolos\(\left( + \right)\) o\(\left( - \right)\) designan para cada compuesto el signo de la rotación\(\alpha\) del plano de luz polarizada que produce.
 \(\tag{8-3}\)
\(\tag{8-3}\)
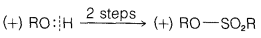 \(\tag{8-4}\)
\(\tag{8-4}\)
 \(\tag{8-5}\)
\(\tag{8-5}\)
Ejercicio 8-8 Explicar cómo, en presencia de ion bromuro, cualquiera de los enantiómeros de 2-bromobutano racemiza (Sección 5-1B) en solución de 2-propanona a una velocidad que es de primer orden en\(\ce{Br}^\ominus\) y primer orden en 2-bromobutano.
Ejercicio 8-9* Cuando cualquiera de los enantiómeros del 1-deuterio-1-bromobutano se calienta con ion bromuro en 2-propanona, se somete a una\(S_\text{N}2\) reacción que resulta en una lenta pérdida de su actividad óptica. Si el ion bromuro radiactivo\(\left( \ce{Br}^* \: ^\ominus \right)\) está presente en la solución, el 1-deuterio-1-bromobutano radiactivo se forma por el mismo\(S_\text{N}2\) mecanismo de acuerdo con la siguiente ecuación:
\[\ce{CH_3CH_2CH_2CHDBr} + \ce{Br}^* \: ^\ominus \overset{\text{2-propanone}}{\longrightarrow} \ce{CH_3CH_2CH_2CHDBr}^* + \ce{Br}^\ominus\]
Dentro del error experimental, el tiempo requerido para perder\(10\%\) la actividad óptica es igual al tiempo requerido para tener\(5\%\) de las\(\ce{CH_3CH_2CH_2CHDBr}\) moléculas convertidas\(\ce{CH_3CH_2CH_2CHDBr}^*\) con ión bromuro radiactivo. Explicar lo que podemos concluir de estos resultados en cuanto al grado en que la\(S_\text{N}2\) reacción produce inversión de configuración del carbono primario del 1-deuterio-1-bromobutano.
Ejercicio 8-10 ¿Qué se puede concluir sobre el mecanismo de la solvolisis de derivados 1-butílicos en ácido etanoico a partir de las fórmulas de proyección del material de partida y producto de la siguiente reacción?
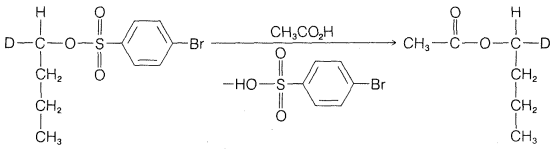
¿Llamarías a esto una\(S_\text{N}2\) reacción\(S_\text{N}1\) o?
Ejercicio 8-11 En la reacción del 1-feniletanol con concentrado\(\ce{HCl}\), se forma cloruro de 1-feniletilo:
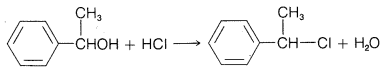
Si el alcohol originalmente tiene la\(D\) configuración, ¿qué configuración tendría el cloruro resultante si estuviera formado (a) por el\(S_\text{N}2\) mecanismo y (b) por el\(S_\text{N}1\) mecanismo?
Ejercicio 8-12 Predecir qué compuesto en cada uno de los siguientes grupos reacciona más rápidamente con yoduro de potasio en 2-propanona como solvente por el\(S_\text{N}2\) mecanismo. Da tu razonamiento y nombra el producto de sustitución por el sistema IUPAC.
a.\(\ce{(CH_3)_3CCH_2Cl}\)\(\ce{(CH_3)_3CCl}\)\(\ce{CH_3CH_2CH_2CH_2Cl}\)
b.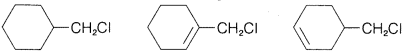
c.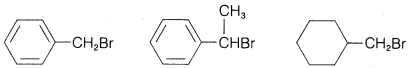
Ejercicio 8-13 ¿Cuál de los metilciclohexanos sustituidos con monobromina juzgarías que es el más reactivo en (a) desplazamiento\(S_\text{N}2\) tipo y (b) desplazamiento\(S_\text{N}1\) tipo (b)?
Ejercicio 8-14 Responde la pregunta en el ejercicio anterior, pero con los 1-metilciclohexenos sustituidos con monobromina.
Ejercicio 8-15 Seleccione los compuestos de la siguiente lista que se esperaría que se hidrolizaran más rápidamente que el cloruro de fenilmetilo (bencilo) por el\(S_\text{N}1\) mecanismo:
a. Cloruro de 2-fenilmetilo
b. cloruro de difenilmetilo
c. cloruro de 1-fenilmetilo
d. (clorometil) ciclohexano
e. 1-cloro-4-metilbenceno
Ejercicio 8-16 Explique las siguientes observaciones:
a. El cloruro terciario, el cloruro de apocanfílico, no es reactivo en\(S_\text{N}1\) cualquiera de\(S_\text{N}2\) las reacciones. Por ejemplo, no se produce ninguna reacción cuando su solución en etanol acuoso que contiene hidróxido de\(30\%\) potasio se somete a reflujo durante 20 horas.
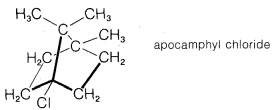
b. Los clorometil alquil (o aril) éteres\(\ce{ROCH_2Cl}\), son muy reactivos en las reacciones de\(S_\text{N}1\) solvolisis. En comparación con el clorometano, la tasa de hidrólisis de clorometil fenil éter es aproximadamente\(10^{14}\). Además, la velocidad de hidrólisis es retardada significativamente por el cloruro de litio.
Ejercicio 8-17 Los sulfuros de metilo se preparan convenientemente mediante la\(S_\text{N}2\) reacción de un\(\ce{CH_3X}\) derivado con un nucleófilo de azufre:\(\ce{RS}^\ominus + \ce{CH_3X} \rightarrow \ce{RSCH_3} + \ce{X}^\ominus\). La velocidad de la reacción con un dado\(\ce{RS}^\ominus\). Si no está seguro de la p\(K_a\) de los ácidos\(\ce{HX}\), búscalos en una referencia apropiada, como el Manual de Física y Química CRC.
a. sulfato de dimetilo,\(\ce{(CH_3O)_2SO_2}\)
b. nitrato de metilo,\(\ce{CH_3ONO_2}\)
c. cianuro de metilo (etanitrilo),\(\ce{CH_3CN}\)
d. fluoruro de metilo,\(\ce{CH_3F}\)
e. yoduro de metilo,\(\ce{CH_3I}\)
f. fluorosulfonato de metilo,
g. acetato de metilo (etanoato),
h. metanol,\(\ce{CH_3OH}\)
Ejercicio 8-18 Contabilizar las siguientes observaciones:
a. Los fluoruros de terc - alquilo no son reactivos en las reacciones de\(S_\text{N}1\) solvolisis a menos que esté presente un ácido fuerte.
b. El cloruro de\(D\) -1-feniletilo disuelto en 2-propanona acuosa que contiene cloruro mercúrico pierde gran parte de su actividad óptica antes de someterse a hidrólisis para dar 1-feniletanol racémico.
c. El 1-bromobutano se puede preparar calentando 1-butanol con una mezcla de bromuro de sodio y ácido sulfúrico. La reacción falla, sin embargo, si se omite el ácido sulfúrico.
d. El ion bencenóxido (fenóxido),\(\ce{C_6H_5O}^\ominus\), es un mejor grupo eliminable que el etóxido,\(\ce{C_2H_5O}^\ominus\).
Ejercicio 8-19 Utilizando la discusión en la Sección 8-7 de cómo la estructura\(\ce{R}\) e\(\ce{X}\) influencia en la\(S_\text{N}\) reactividad de\(\ce{RX}\), predecir el curso favorecido de cada una de las siguientes reacciones. Dale tu razonamiento.
a.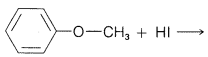
b.\(\ce{(CH_3)_3C-O-CH_3} + \ce{HI} \rightarrow\)
c.\(\ce{CF_3-O-CH_3} + \ce{HBr} \rightarrow\)
d.
Ejercicio 8-20 Los éteres metílicos del tipo\(\ce{R-O-CH_3}\) no se pueden preparar por la reacción del alcohol\(\ce{ROH}\) con\(\ce{CH_3I}\), pero si\(\ce{Ag_2O}\) está presente la siguiente reacción ocurre en condiciones suaves:
\[2 \ce{R-OH} + \ce{Ag_2O} + 2 \ce{CH_3I} \rightarrow 2 \ce{ROCH_3} + 2 \ce{AgI} + \ce{H_2O}\]
Explique cómo\(\ce{Ag_2O}\) promueve esta reacción.
Ejercicio 8-21 Explique cada una de las siguientes observaciones:
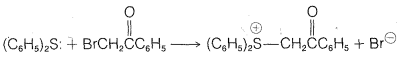
a.\(\ce{(CH_3)_2S}\) El sulfuro de metilo reacciona con\(\ce{C_6H_5COCH_2Cl}\) el benceno para dar la sal de sulfonio\(\ce{C_6H_5COCH_2} \overset{\oplus}{\ce{S}} \ce{(CH_3)_2Cl}^\ominus\), que precipita a medida que se forma. Los intentos de recristalizar el producto a partir de etanol dan como resultado la formación de sulfuro de metilo y\(\ce{C_6H_5COCH_2Cl}\).
b. Los\(S_\text{N}2\) desplazamientos de cloruros de alquilo\(\overset{\ominus}{\ce{O}} \ce{H}\) a menudo son catalizados por iones yoduro,\(\ce{RCl} + \colon \overset{\ominus}{\ce{O}} \ce{H} \overset{\ce{I}^\ominus}{\longrightarrow} \ce{ROH} + \ce{Cl}^\ominus\) y pueden dar como resultado un producto con configuración inferior a\(100\%\) la invertida en el carbono que porta el cloro.
c.* Tris (trifluorometil) amina,\(\ce{(CF_3)_3N}\), es completamente no nucleofílica, mientras que la trimetilamina es un buen nucleófilo.
Ejercicio 8-22 Clasificar los siguientes disolventes según la efectividad para la solvatación de (i) cationes y (ii) aniones:
a. 2-propanona,\(\ce{CH_3COCH_3}\)
b. tetraclorometano,\(\ce{CCl_4}\)
c. fluoruro de hidrógeno anhidro,\(\ce{HF}\)
d. triclorometano,\(\ce{CHCl_3}\)
e. trimetilamina,\(\ce{(CH_3)_3N}\)
f. óxido de trimetilamina,\(\ce{(CH_3)_3} \overset{\oplus}{\ce{N}} - \overset{\ominus}{\ce{O}}\)
Ejercicio 8-23* ¿Esperaría que la\(S_\text{N}2\) reacción del cianuro de sodio con bromuro de metilo sea más rápida, más lenta, o aproximadamente la misma con\(\ce{(CH_3)_2S=O}\) o etanol como disolvente? Explicar.
Ejercicio 8-24 Un mecanismo alternativo de\(E2\) eliminación es el siguiente:
\[\ce{CH_3CH_2Cl} + \ce{OH}^\ominus \overset{\text{fast}}{\rightleftharpoons} \: ^\ominus \colon \ce{CH_2CH_2Cl} + \ce{H_2O} \overset{\text{slow}}{\longrightarrow} \ce{CH_2=CH_2} + \ce{Cl}^\ominus\]
a. ¿Este mecanismo conduciría a una cinética general de segundo orden con respecto a las concentraciones\(\ce{OH}^\ominus\) de cloruro de etilo? Explicar.
b. Este mecanismo tal como está escrito ha sido excluido para varios haluros al llevar a cabo la reacción en disolventes deuterados como\(\ce{D_2O}\) y\(\ce{C_2H_5OD}\). Explicar cómo tales experimentos podrían ser relevantes para el mecanismo de reacción.
c. ¿También descarta la prueba de la Parte b\(\ce{CH_3CH_2Cl} + \overset{\ominus}{\ce{O}} \ce{H} \overset{\text{slow}}{\longrightarrow} \colon \overset{\ominus}{\ce{C}} \ce{H_2CH_2Cl} + \ce{H_2O} \overset{\text{fast}}{\longrightarrow} \ce{CH_2=CH_2} + \ce{Cl}^\ominus\)? Explicar.
Ejercicio 8-25 Escribir ecuaciones y mecanismos para todos los productos que razonablemente pudieran esperarse de la reacción del 2-clorobutano con una solución de hidróxido de potasio en etanol.
Ejercicio 8-26
a. ¿Por qué es el terc- butóxido de potasio\(\overset{\oplus}{\ce{K}} \overset{\ominus}{\ce{O}} \ce{C(CH_3)_3}\), una base excelente para promover reacciones de eliminación de haluros de alquilo, mientras que la etilamina\(\ce{CH_3CH_2NH_2}\), es relativamente pobre para el mismo propósito?
b. El terc- butóxido de potasio es muchos poderes de diez más efectivos un reactivo para lograr\(E2\) eliminaciones en metilsulfinilmetano (dimetilsulfóxido) que en alcohol terc - butílico. Explicar.
Ejercicio 8-27 ¿Cuál de los siguientes grupos de compuestos eliminaría\(\ce{HCl}\) más fácilmente al reaccionar con hidróxido de potasio? Dibuja la estructura del producto y nombra.
a.\(\ce{(CH_3)_3CCl}\)\(\ce{CH_3CH_2CH_2CH_2Cl}\)\(\ce{CH_3CH(Cl)CH_2CH_3}\)
b.\(\ce{(CH_3)_3CCH_2Cl}\)\(\ce{(CH_3)_2CHCH_2Cl}\)
c.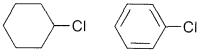
Ejercicio 8-28 ¿Cuál de cada uno de los siguientes pares de compuestos reaccionaría más rápidamente con hidróxido de potasio en una eliminación\(E2\) tipo? Dibuja la estructura del producto y nombra.
a.\(\ce{(CH_3)_3COH}\)\(\ce{(CH_3)_3CCl}\)
b.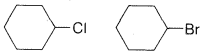
c.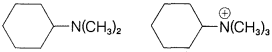
Ejercicio 8-29 Escribe todas las conformaciones escalonadas posibles para cada uno de los isómeros del 2,3-dibromobutano,\(8\) y\(9\):
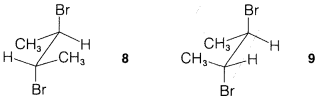
Mostrar las estructuras de los alquenos que podrían formarse a partir de cada uno por\(E2\) eliminación antarafacial de un mol de bromuro de hidrógeno con ión hidróxido. ¿Qué alqueno debería eliminar más fácilmente para formar 2-butino? Explicar.
Ejercicio 8-30 Para la reacción de la Ecuación 8-7, ¿esperaría que la relación entre el alcohol terc - butílico y el 2-metilpropeno cambiara significativamente con los cambios en la naturaleza del grupo de salida [es decir\(\ce{Cl}\)\(\ce{Br}\),\(\ce{I}\),, o\(\overset{\oplus}{\ce{S}} \ce{(CH_3)_2}\)]? Dale tu razonamiento.
¿Esperarías el mismo o diferente comportamiento que\(\ce{X}\) se cambia, si la eliminación se estuviera produciendo por un \(E2\)mecanismo con el solvente actuando como base? Explicar.
Ejercicio 8-31 La reacción del cloruro de terc- butilo con el agua es acelerada fuertemente por el hidróxido de sodio. ¿Cómo se vería afectada con ello la relación entre los productos de eliminación y sustitución? Explicar.
Ejercicio 8-32 Explicar cómo\(\ce{(CH_3)_2CDCHBrCH_3}\) (dónde\(\ce{D}\) está el isótopo de hidrógeno de la masa 2) podría usarse para determinar si el 2-metil-2-buteno se forma directamente a partir del bromuro en una\(E1\) reacción, o por reordenamiento y eliminación como se muestra en las ecuaciones anteriores.
Ejercicio 8-33 Predecir los productos de las siguientes reacciones:
a.\(\ce{CH_3CH_2CBr(CH_3)CH_2CH_3} \underset{S_\text{N}1, \: E1}{\overset{\ce{H_2O}}{\longrightarrow}}\)
b.\(\ce{(CH_3)_3CCH(CH_3)Cl} \underset{S_\text{N}1, \: E1}{\overset{\ce{H_2O}}{\longrightarrow}}\)
c.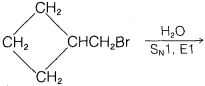
Ejercicio 8-34 Escribir secuencias de reacción, utilizando compuestos específicos y apropiados, que ilustren las siguientes conversiones:
a. alcohol\(\rightarrow\) éter
b. alcohol\(\rightarrow\) alqueno
c. alcohol\(\rightarrow\) alquil cloruro
d. alcohol\(\rightarrow\) nitrilo\(\left( \ce{ROH} \rightarrow \ce{RCN} \right)\)
e. cloruro de alquilo\(\rightarrow\) sal de sulfonio\(\rightarrow\) alqueno
Ejercicio 8-35\(\ce{S}\) -La adenosilmetionina es un compuesto biológicamente importante que reacciona de la\(S_\text{N}2\) manera con el grupo amino del 2-aminoetanol fosforilado,\(\ce{NH_2CH_2CH_2OPO_3H_2}\). ¿Qué carbono de\(\ce{S}\) -adenosilmetionina tendría más probabilidades de sufrir una\(S_\text{N}2\) reacción con un\(\ce{RNH_2}\) compuesto? Da tu razonamiento y escribe las estructuras de los productos esperados.

Ejercicio 8-36 Los nitrilos,\(\ce{RCN}\), se pueden preparar por\(S_\text{N}2\) desplazamiento de derivados alquílicos,\(\ce{RX}\), mediante el uso de cianuro de sodio o potasio:
\[\ce{RX} + \ce{NaCN} \rightarrow \ce{RCN} + \ce{NaX}\]
a. ¿Cuál de los siguientes disolventes sería el más adecuado para esta reacción: agua, 2-propanona, etanol\(\ce{(CH_3)_2S=O}\), benceno o pentano? Da razones para tu elección.
b. ¿Cuál de los seis monobromoderadores isoméricos del 1-metilciclohexano esperaría que reaccionara más rápidamente con el cianuro de sodio? ¿Por qué?
c. Si deseara hacer 2-feniletanitrilo\(\ce{C_6H_5CH_2CN}\), ¿cuál de los siguientes compuestos de fenilmetilo\(\ce{RCH_2X}\), seleccionaría convertir al nitrilo? \(\ce{X} = \ce{-F}\),\(\ce{-OH}\),\(\ce{-OCOCH_3}\),\(\ce{-H}\),\(\ce{-NH_2}\),\(\ce{-O_3SCH_3}\),\(\ce{-SO_3-CH_3}\). ¿Por qué?
Ejercicio 8-37 Dar una explicación plausible para cada una de las siguientes observaciones:
a. El cloruro de sodio acuoso no convertirá el alcohol terc - butílico en cloruro de terc- butilo, pero el ácido clorhídrico concentrado lo hará.
b. Se obtienen mejores rendimientos en la síntesis de éter isopropílico metílico partiendo de yoduro de metilo en lugar de metóxido de sodio:
\[\ce{CH_3I} + \ce{(CH_3)_2CHO}^\ominus \ce{Na}^\oplus \rightarrow \ce{(CH_3)_2CHOCH_3} + \ce{Na}^\oplus \ce{I}^\ominus\]
\[\ce{(CH_3)_2CHI} + \ce{CH_3O}^\ominus \ce{Na}^\oplus \rightarrow \ce{(CH_3)_2CHOCH_3} + \ce{Na}^\oplus \ce{I}^\ominus\]
c. La siguiente reacción procede únicamente si se añade a la mezcla de reacción una cantidad equivalente de fluoroborato de plata:\(\ce{Ag}^\oplus \ce{BF_4} \: ^\ominus\)
d. 1-bromo-2-buteno reacciona con agua para dar una mezcla de 2-buten-1-ol, 3-buten-2-ol y algo de 1,3-butadieno.
Ejercicio 8-38 ¿Qué compuesto en los siguientes pares reaccionaría más rápido bajo las condiciones de reacción? Dibujar las estructuras de los principales productos esperados.
a.\(\ce{C_6H_5CH_2CH_2Br}\) o\(\ce{C_6H_5C(CH_3)(Br)CH_3}\) en solución etanol-agua.
b. Igual que en la Parte a, pero con yoduro de potasio en acetona.
c. Igual que en la Parte a, pero con hidróxido de potasio en etanol.
d.\(\ce{CH_3CH_2} \overset{\oplus}{\ce{N}} \ce{(CH_3)_3} \: \overset{\ominus}{\ce{B}} \ce{F_4}\) o\(\ce{CH_3CH_2} \overset{\oplus}{\ce{N}} \ce{(CH_3)_3} \: \overset{\ominus}{\ce{O}} \ce{CH_3}\) al calentar en solución de metanol.
Ejercicio 8-39 Mostrar los productos de las siguientes reacciones e indicar la estereoquímica donde es importante.
a. trans -1-bromo-3-metilciclopentano\(\underset{\text{acetone}}{\overset{\ce{KI}}{\longrightarrow}}\)
b. trans -1-cloro-2-metilciclopentano\(\underset{\textit{tert} \text{-butyl alcohol}}{\overset{^\oplus \ce{K} ^\ominus \ce{O} \ce{C(CH_3)_3}}{\longrightarrow}}\)
c.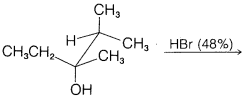
d.\(D\) -2-butanol sal\(\overset{\text{potassium metal}}{\longrightarrow}\) potásica\(\overset{L \text{-2-chlorobutane}}{\longrightarrow}\)
e.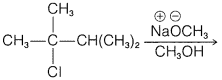
f. meso-1,2-dibromo-1,2-difeniletano\(\overset{^\oplus \ce{K} ^\ominus \ce{O} \ce{C(CH_3)_3}}{\longrightarrow}\)
Ejercicio 8-40 Las\(S_\text{N}1\) reacciones de muchos\(\ce{RX}\) derivados que forman carbocationes moderadamente estables se retrasan sustancialmente al agregar\(\ce{X}^\ominus\) iones. Sin embargo, dicho retraso disminuye, a\(\ce{X}^\ominus\) concentraciones dadas, al agregar otro nucleófilo como\(\ce{N_3} \: ^\ominus\). Explicar.
Ejercicio 8-41 La reacción del 1-clorobutano con hidróxido de sodio para dar 1-butanol es catalizada por yoduro de sodio.
a. Elaborar la estereoquímica que se espera tanto para las reacciones catalizadas como para las no catalizadas si se utilizó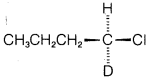 (ópticamente activa) como material de partida. Muestra tu razonamiento.
(ópticamente activa) como material de partida. Muestra tu razonamiento.
b. ¿La retención de la configuración, como resultado global de una\(S_\text{N}2\), excluye automáticamente el funcionamiento del mecanismo habitual? Explicar.
Ejercicio 8-42* Supongamos que una solución acuosa se conformó inicialmente para estar\(0.01 \: \text{M}\) en bromuro de metilo y\(1.0 \: \text{M}\) en etanoato de sodio en\(50^\text{o}\). En agua, la constante\(S_\text{N}2\) de velocidad para la reacción del ion hidróxido con bromuro de metilo a\(50^\text{o}\) es\(30 \times 10^{-4} \: \text{L mol}^{-1} \: \text{sec}^{-1}\), mientras que la del ion etanoato a\(50^\text{o}\) es\(1.0 \times 10^{-4} \: \text{L mol}^{-1} \: \text{sec}^{-1}\). La constante de ionización del ácido etanoico a\(50^\text{o}\) es\(1.8 \times 10^{-5}\). A continuación, descuida las tasas de las reacciones del bromuro de metilo con agua o ácido etanoico y cualquier reacción posterior del etanoato:
a. Calcular la concentración de iones hidróxidos en la solución inicial.
b. Calcular las tasas iniciales de formación de etanoato de metilo y metanol.
c. Calcular las concentraciones de los productos orgánicos cuando la reacción esté completa. Muestre su razonamiento y justifique cualquier suposición.
d. ¿Qué tipo de información se necesitaría para predecir qué productos se esperarían de una solución de bromuro de metilo e hidróxido de sodio en metanol? Explicar.
Ejercicio 8-43 Indica cómo sintetizarías cada una de las siguientes sustancias a partir de los materiales de partida orgánicos dados y cualquier otro reactivo orgánico o inorgánico necesario. Especificar reactivos y condiciones. (Es posible que tenga que usar las reacciones discutidas en el Capítulo 4.)
a.\(\ce{CH_2=CH-CH_2OCOCH_3}\) del propeno
b.\(\ce{CH_3-O-CH_2CH_3}\) del etanol
c.\(\ce{CH_3-O-C(CH_3)_3}\) del alcohol terc- butílico
d. ciclohexeno del ciclohexano
Ejercicio 8-44 ¿Qué compuesto en cada uno de los siguientes pares esperaría reaccionar más fácilmente con (A) yoduro de potasio en 2-propanona, (B) hidróxido de sodio concentrado en etanol y (C) nitrato de plata en etanol acuoso? Escribe ecuaciones para todas las reacciones involucradas y da tu razonamiento con respecto a los órdenes de reactividad predichos.
a. cloruro de metilo y cloruro de isobutilo con A, B y C
b. cloruro de metilo y cloruro de terc- butilo con A, B y
C c. cloruro de terc- butilo y 1-fluoro-2-cloro-2-metilpropano con B y C
d. 1-cloro-2-buteno y 4-cloro-1-buteno con A, B y C
Ejercicio 8-45 Clasificar cada una de las siguientes reacciones desde el punto de vista de rendimiento, reacciones secundarias y velocidad de reacción como procedimientos sintéticos buenos, justos o malos para la preparación de los productos indicados en las condiciones dadas. Muestre su razonamiento y designe cualquier reacción secundaria importante.
a.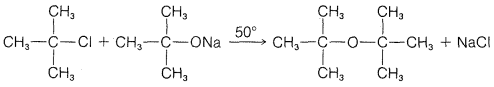
b.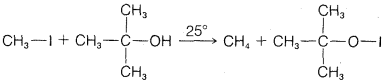
c.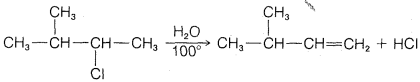
d.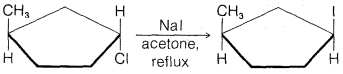
e.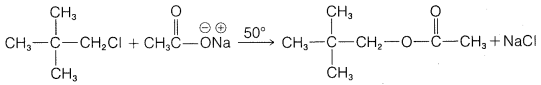
f.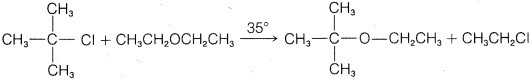
g.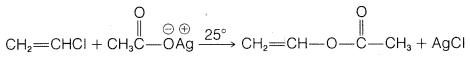
h.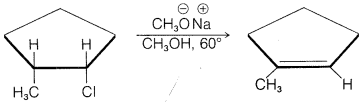
Ejercicio 8-46 Considera que cada uno de los siguientes compuestos está en botellas sin etiquetar en pares como se indica. Para cada par dar una prueba química (preferiblemente una reacción en tubo de ensayo) que distinguirá entre las dos sustancias. Escribir ecuaciones para las reacciones involucradas.
\[\begin{array}{lll} & \textit{Bottle A} & \textit{Bottle B} \\ \textbf{a.} & \ce{(CH_3)_3CCH_2Cl} & \ce{CH_3CH_2CH_2CH_2Cl} \\ \textbf{b.} & \ce{BrCH=CHCH_2Cl} & \ce{ClCH=CHCH_2Br} \\ \textbf{c.} & \ce{(CH_3)_3CCl} & \ce{(CH_3)_2CHCH_2Cl} \\ \textbf{d.} & \ce{CH_3CH=CHCl} & \ce{CH_2=CHCH_2Cl} \\ \textbf{e.} & \ce{(CH_3)_2C=CHCl} & \ce{CH_3CH_2CH=CHCl} \\ \textbf{f.} & \ce{CH_3CH_2CH=CHCl} & \ce{CH_2=CHCH_2CH_2Cl} \end{array}\]
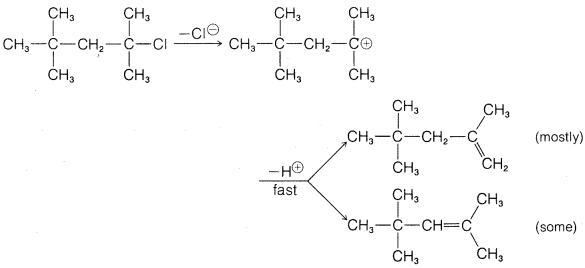
Ejercicio 8-47 ¿Por qué la siguiente\(E1\) reacción da más del alqueno menos sustituido? (Utilice modelos.)
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


