10.5: Orientación Además de Alquenos
- Page ID
- 73463
Adición de\(\ce{HX}\)
La adición de una sustancia asimétrica tal como\(\ce{HX}\) a un alqueno asimétrico teóricamente puede dar dos productos:
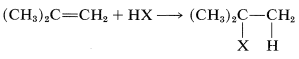 y
y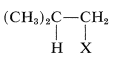
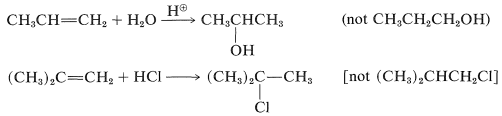
Ambos productos rara vez se forman en cantidades iguales; de hecho, un isómero generalmente se forma con exclusión del otro. Por ejemplo, la hidratación del propeno da 2-propanol (no 1-propanol), y el cloruro de hidrógeno se añade al 2-metilpropeno para dar cloruro de terc- butilo (no cloruro de isobutilo):
Para entender la razón de la pronunciada selectividad en la orientación de adición de electrófilos, ayudará a considerar un ejemplo, la adición de bromuro de hidrógeno al 2-metilpropeno. Se podrían formar dos intermedios de carbocatión diferentes mediante la unión de un protón a uno u otro de los carbonos de doble enlace:
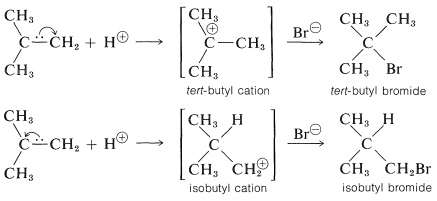
Las reacciones posteriores de los cationes con ion bromuro dan bromuro de terc- butilo y bromuro de isobutilo. En la forma habitual de ejecutar estas adiciones, el producto es bromuro de terc- butilo muy puro.
¿Cómo se podría haber predicho qué producto se vería favorecido? El primer paso es decidir si la predicción va a basarse en (1) cuál de los dos productos es el más estable, o (2) cuál de los dos productos si se forma más rápidamente. Si tomamos una decisión sobre la base de las estabilidades del producto, tomamos en cuenta\(\Delta H^0\) valores, efectos de entropía, etc., para estimar las constantes de equilibrio\(K_\text{eq}\) para los reactivos y cada producto. Cuando la relación de los productos está determinada por la relación de sus constantes de equilibrio, decimos que la reacción global está sujeta a control de equilibrio (o termodinámica). El control del equilibrio requiere que la reacción sea reversible.
Cuando se lleva a cabo una reacción en condiciones en las que no es reversible, la relación de los productos se determina por las velocidades relativas de formación de los diversos productos. Se dice que tales reacciones están bajo control cinético.
Los productos obtenidos en una reacción sometida a control cinético no son necesariamente los mismos que los obtenidos bajo control de equilibrio. De hecho, la constante de equilibrio para la interconversión de bromuro de terc - butilo y bromuro de isobutilo at\(25^\text{o}\) es 4.5, y si la adición de bromuro de hidrógeno a 2-metilpropeno estuviera bajo control de equilibrio, los productos se formarían en esta relación:
\[K_\text{eq} = \dfrac{\left[ \text{tert-butyl bromide} \right]}{\left[ \text{isobutyl bromide} \right]} = 4.5\]
Pero el producto de adición es bromuro de\(99+\%\) terc- butilo, por lo que la reacción está claramente controlada cinéticamente, formándose el terc- butilo considerablemente más rápido que el bromuro de isobutilo. La etapa lenta, o determinante de la velocidad, en esta reacción es la formación del catión intermedio en lugar de la reacción del catión con el ión bromuro. Entonces, para dar cuenta de la formación de bromuro de terc- butilo tenemos que considerar por qué el catión terc- butilo se forma más rápidamente que el catión isobutilo:
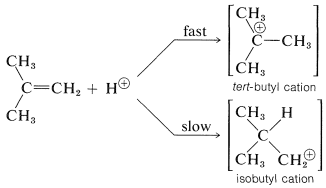
Como hemos visto en la Sección 8-7B, los grupos alquilo son más donadores de electrones que hidrógeno. Esto significa que cuantos más grupos alquilo haya en el carbono positivo del catión, más estable y más fácilmente formado será el catión. La razón es que los grupos donadores de electrones pueden compensar parcialmente la deficiencia de electrones del carbono positivo. Como resultado, podemos predecir que el catión terc- butilo con tres grupos alquilo unidos al centro positivo se formará más fácilmente que el catión isobutilo primario con un grupo alquilo unido al centro positivo.
Así, el problema de predecir cuál de los dos posibles productos se verá favorecido en la adición de reactivos asimétricos a alquenos bajo control cinético reduce a predecir cuál de los dos posibles intermedios de carbocatión se formará más fácilmente. Con alquenos simples, esperaremos que la preferencia de formación de los carbocationes esté en el orden:
terciario > secundario > primario.
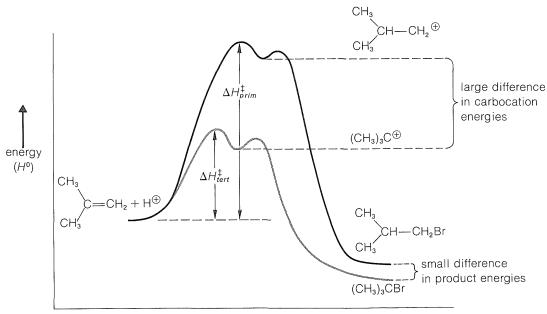
El esquema de reacción se puede representar convenientemente en forma de un diagrama de energía (Figura 10-10). La energía de activación,\(\Delta H^1_\text{tert}\) para la formación del catión terc- butilo es menor que\(\Delta H^1_\text{prim}\) para la formación del catión isobutilo debido a que el ion terciario es mucho más estable (relativo a los reactivos) que el ion primario, y por lo tanto se forma a una velocidad más rápida. El segundo paso, para formar el producto a partir del catión intermedio, es muy rápido y requiere poca energía de activación. Siempre que la reacción sea irreversible, tomará el camino de menor energía y formará exclusivamente bromuro de terc- butilo. Sin embargo, si la mezcla de reacción se deja reposar durante mucho tiempo, comienza a formarse bromuro de isobutilo. Durante un largo período, los productos se equilibran y, en equilibrio, la distribución del producto refleja las estabilidades relativas de los productos más que la estabilidad de los estados de transición para la formación de los intermedios.
Una regla bastante simple, formulada en 1870 y conocida como regla de Markownikoff, correlaciona la dirección de adiciones cinéticamente controladas de\(\ce{HX}\) alquenos asimétricos. Esta regla, una importante generalización temprana de reacciones orgánicas, se puede afirmar de la siguiente manera: Además de\(\ce{HX}\) un doble enlace asimétrico carbono-carbono, el hidrógeno de\(\ce{HX}\) va a ese carbono del doble enlace que porta el mayor número de hidrógenos. Debe quedar claro que la regla de Markownikoff predice que la adición de bromuro de hidrógeno al 2-metilpropeno dará bromuro de terc- butilo.
Adición de Otros Reactivos a Alquenos Simétricos. La Carta de Electronegatividad
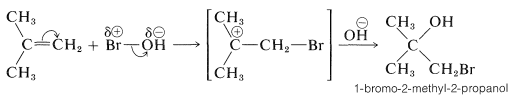
Podemos extender la regla de Markownikoff para cubrir las adiciones de sustancias de tipo general\(\ce{X-Y}\) a alquenos sustituidos asimétricamente cuando es posible una decisión clara sobre si\(\ce{X}\) o\(\ce{Y}\) es el átomo más electrófilo de\(\ce{X-Y}\). Si la polarización del\(\ce{X-Y}\) enlace es tal que\(\ce{X}\) es positiva\(^{\delta \oplus} \ce{X-Y} ^{\delta \ominus}\), entonces se\(\ce{X}\) esperará que se agregue en cuanto\(\ce{X}^\oplus\) al alqueno para formar el carbocatión más estable. Este paso determinará la dirección de la suma. Por ejemplo, si sabemos que el\(\ce{O-Br}\) enlace de\(\ce{HOBr}\) está polarizado como\(\overset{\delta \ominus}{\ce{HO}} - \overset{\delta \oplus}{\ce{Br}}\), entonces podemos predecir que la adición de\(\ce{HOBr}\) a 2-metilpropeno dará 1-bromo-2-metil-2-propanol:
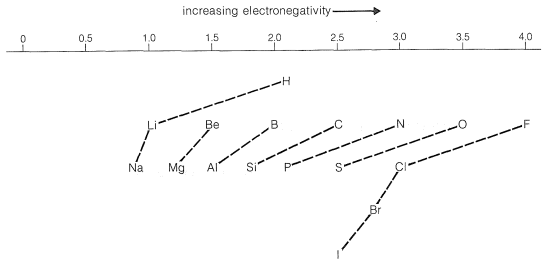
El valor de Pauling para la electronegatividad del carbono lo hace un poco más atrayente de electrones que el hidrógeno. Sin embargo, esperamos que el poder de atracción de electrones de un átomo de carbono (o de otros elementos) dependa también de las electronegatividades de los grupos a los que está unido. De hecho, muchas observaciones experimentales indican que el carbono en los grupos metilo u otros grupos alquilo es significativamente menos atrayente de electrones que el hidrógeno. Por el contrario, el\(\ce{CF_3}-\) grupo es, como se esperaba, mucho más atrayente de electrones que el hidrógeno.
La dirección de polarización de los enlaces entre varios elementos puede predecirse a partir de la Figura 10-11. Por ejemplo, un\(\ce{O-Cl}\) enlace debe polarizarse de manera que el oxígeno sea negativo; un\(\ce{C-N}\) enlace debe polarizarse de manera que el nitrógeno sea negativo:
\[\overset{\delta \ominus}{\ce{O}}---\overset{\delta \oplus}{\ce{Cl}} \: \: \: \: \: \overset{\delta \oplus}{\ce{C}}---\overset{\delta \ominus}{\ce{N}}\]
Entonces podemos predecir que, en la adición de\(\ce{HOCl}\) un alqueno, el cloro se sumará preferentemente para formar el más estable de dos posibles cationes de carbono. Generalmente, esto significa que el cloro se unirá al carbono que lleva el mayor número de hidrógenos:
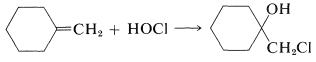
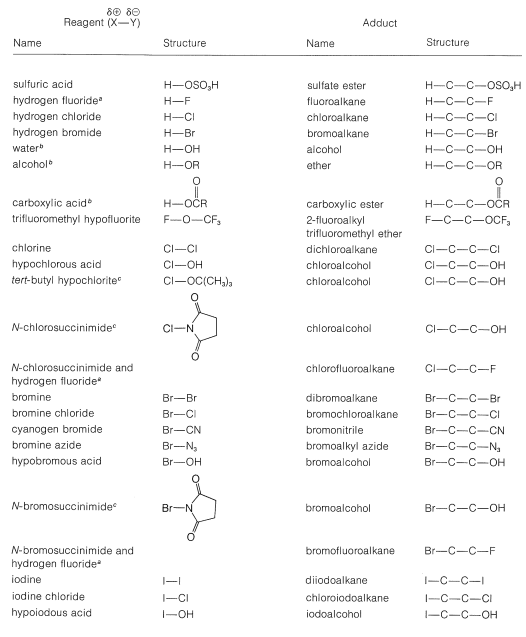
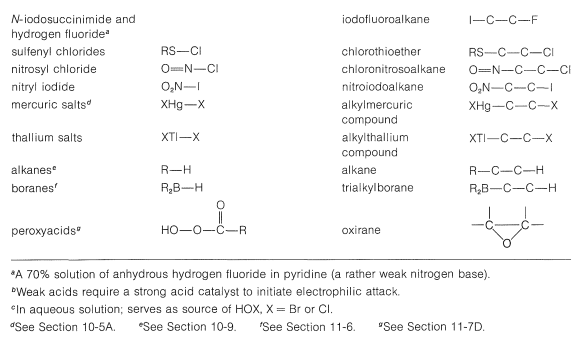
En la Tabla 10-2 se incluyen varios reactivos que son fuentes útiles de halógeno electrofílico. Algunos de estos reactivos, especialmente aquellos con enlaces\(\ce{O}-\)\(\ce{N}-\) halógenos o halógenos, en realidad son fuentes de ácidos hipohalosos\(\ce{HOX}\), y funcionan para introducir grupos halógeno e hidroxilo en el carbono. Hay muy pocos buenos agentes fluorantes por los que el flúor se agrega como\(\ce{F}^\oplus\).
Tabla 10-2: Reactivos que se suman a Alquenos por Ataque Electrofílico:
Adiciones a Alquenos sustituidos
Para los alquenos que tienen halógeno o sustituyentes similares en los carbonos doblemente unidos, se aplican los mismos principios que con los alquenos simples. Es decir, bajo control cinético el producto preferido será el derivado del más estable de los dos posibles cationes de carbono intermedios. Considera un compuesto del tipo\(\ce{Y-CH=CH_2}\). Si\(\ce{Y}\) es más atrayente de electrones que hidrógeno, entonces el haluro de hidrógeno debe agregar de tal manera que ponga el\(\ce{HX}\) protón de en el\(\ce{YCH=}\) extremo y\(\ce{X}\) en el\(\ce{=CH_2}\) extremo. La razón es que se espera que el carbono positivo se localice de manera más favorable si no está unido directamente a un sustituyente atrayente de electrones:
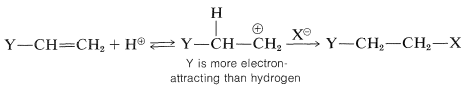
La adición va como se predijo, siempre que el átomo unido directamente al carbono del doble enlace no lleve pares de electrones no compartidos (no enlazantes). Por ejemplo,
\[\ce{CF_3-CH=CH_2} + \ce{HCl} \rightarrow \ce{CF_3-CH_2-H_2-Cl}\]
Tales sustituyentes son relativamente poco comunes, y la mayoría de las\(\ce{H-X}\) adiciones reportadas se han llevado a cabo con\(\ce{Y}\) grupos que tienen pares de electrones no compartidos en un átomo conectado directamente a un carbono del doble enlace:
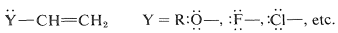
Estos sustituyentes suelen ser fuertemente electronegativos con respecto al hidrógeno, y esto a menudo causa una reactividad disminuida del doble enlace hacia los electrófilos. No obstante, la orientación preferida de\(\ce{HX}\) las adiciones sitúa la carga positiva del carbocatión intermedio junto al sustituyente:
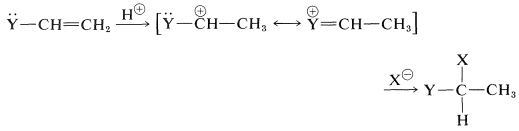
El poder de atracción de electrones del sustituyente está más que compensado por la estabilización del catión intermedio por la capacidad de los sustituyentes para deslocalizar sus electrones no compartidos al carbono positivo adyacente (ver Sección 6-6).
Referencias
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


