11.1: Oxidación-Reducción de Compuestos Orgánicos
- Page ID
- 73674
Un compuesto orgánico comúnmente se dice que se “reduce” si la reacción conduce a un aumento en su contenido de hidrógeno o una disminución en su contenido de oxígeno. El compuesto se “oxida” si se produce el cambio inverso:
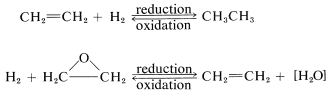
Esta es una definición muy insatisfactoria porque muchas reacciones de oxidación-reducción o redox no implican cambios en el contenido de hidrógeno u oxígeno, como ilustra el siguiente ejemplo:

Las reacciones redox se definen mejor en términos del concepto de transferencia de electrones. Así se dice que un átomo se oxida si, como resultado de una reacción, experimenta una pérdida neta de electrones; y se reduce si experimenta una ganancia neta de electrones. Esta definición simple puede ser utilizada para identificar procesos de oxidación o reducción en el carbono en términos de una escala de estados de oxidación para el carbono basada en las electronegatividades de los átomos unidos al carbono. La idea es averiguar si en una reacción dada el carbono se vuelve más, o menos, rico en electrones. Usaremos las siguientes reglas algo arbitrarias:
- Al carbono elemental se le asigna el estado de oxidación cero.
- El estado de oxidación de cualquier carbono unido químicamente se puede asignar añadiendo\(-1\) por cada átomo más electropositivo y\(+1\) por cada átomo más electronegativo, y\(0\) para cada átomo de carbono unido directamente al carbono de interés (ver Figura 10-11) para la escala de electronegatividad de Pauling ). Es decir,
\(-1\) para átomos electropositivos,\(\ce{H}\),\(\ce{B}\),\(\ce{Na}\),\(\ce{Li}\),\(\ce{Mg}\),
\(+1\) para átomos electronegativos, halógenos\(\ce{O}\),\(\ce{N}\),\(\ce{S}\), y
\(0\) para carbono.
El fundamento de este modo de operación se puede ver si miramos más de cerca el ejemplo de\(\ce{CH_3Cl} + \ce{Mg} \rightarrow \ce{CH_3-Mg-Cl}\). El cloro es más electronegativo que el carbono o el magnesio. El carbono es más electronegativo que el magnesio. Así\(\ce{CH_3Cl}\) se escribe correctamente con un enlace polar como\(\overset{\delta \oplus}{\ce{CH_3}} --- \overset{\delta \ominus}{\ce{Cl}}\), mientras que el\(\ce{C-Mg}\) vínculo está polarizado de manera opuesta,\(\overset{\delta \ominus}{\ce{CH_3}} --- \overset{\delta \oplus}{\ce{Mg}}\). Si todos los enlaces estuvieran completamente ionizados, podríamos escribir
\[\ce{CH_3^+} + \ce{Cl}^\ominus + \ce{Mg}^0 \rightarrow \ce{CH_3} :^\ominus + \ce{Mg}^{2 \oplus} + \ce{Cl}^\ominus\]
y quedaría completamente claro que el carbono gana dos electrones (se reduce), mientras que el magnesio pierde dos electrones (se oxida). Pero debido a que los enlaces covalentes, o a lo sumo polares, realmente están involucrados, es mucho más difícil determinar si se produce oxidación o reducción. - En compuestos con múltiples enlaces (
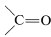 ,
,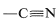 ), el heteroátomo unido se cuenta dos o tres veces, dependiendo de si el enlace es doble o triple.
), el heteroátomo unido se cuenta dos o tres veces, dependiendo de si el enlace es doble o triple. - Una carga positiva formal sobre carbono cambia el estado de oxidación por\(+1\), y una carga negativa formal por\(-1\); un electrón impar sobre carbono deja el estado de oxidación sin cambios.
Para ilustrar, el estado de oxidación del carbono en cuatro ejemplos representativos se determina de la siguiente manera:
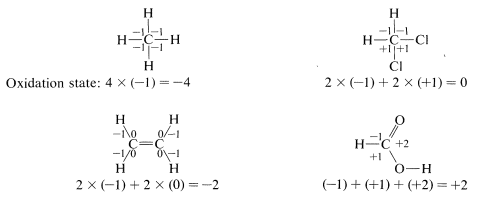
Con este enfoque, podemos construir una escala de oxidación de carbono, como en el Cuadro 11-1. Cualquier reacción que incremente el grado de oxidación del carbono corresponde a una pérdida de electrones (oxidación), y una reacción que disminuye el nivel de oxidación corresponde a una ganancia de electrones (reducción). A continuación se presentan dos ejemplos:

Cuadro 11-1: Estados de oxidación de carbono de compuestos orgánicos representativos (\(\ce{R} =\)alquilo)
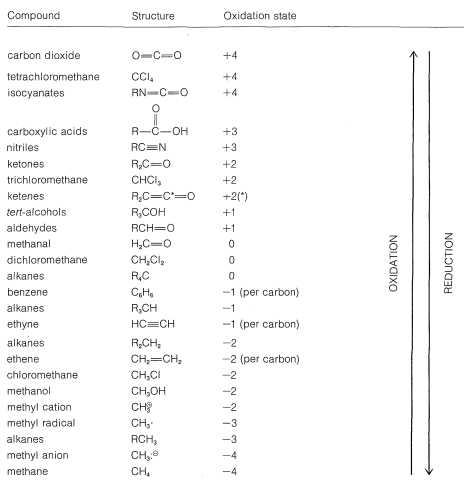
Recomendamos este esquema de estados de oxidación solo como una ayuda para identificar y equilibrar las reacciones redox. Además, la terminología “redox” no debe confundirse con el mecanismo de una reacción, ya que no hay conexión entre ellos. La reflexión de un momento también mostrará que prácticamente todas las reacciones teóricamente pueden considerarse como reacciones redox, porque en casi todas las reacciones los átomos que reaccionan experimentan algún cambio en sus entornos electrónicos. Tradicionalmente, sin embargo, las reacciones se describen como reacciones redox de carbono solo cuando hay un cambio neto en el estado de oxidación de los átomos de carbono involucrados. Un indicio de lo arbitrario que es esto se puede ver con el ejemplo de adición de agua al eteno. Esta reacción generalmente no se considera una reacción de oxidación-reducción porque no hay ningún cambio neto en el estado de oxidación de los carbonos del eteno, a pesar de que, según nuestras reglas, un carbono se oxida y el otro se reduce:
\[\overset{-2}{\ce{CH_2}} = \overset{-2}{\ce{CH_2}} + \ce{H_2O} \rightarrow \overset{-3}{\ce{CH_3}} \overset{-1}{\ce{CH_2}} \ce{OH}\]
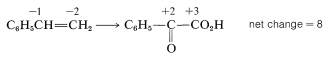
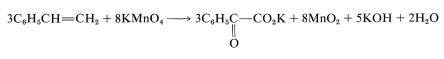
Además de indicar cuándo ocurre la oxidación o reducción, las escalas de oxidación son útiles para equilibrar ecuaciones redox. Por ejemplo, considere la siguiente oxidación del etenilbenceno (estireno) con permanganato de potasio:

Para determinar cuántos moles de ion permanganato se requieren para oxidar un mol de estireno en esta reacción, primero determinar el cambio neto en el estado de oxidación de los carbonos que reaccionan:
Segundo, determinar el cambio neto en el estado de oxidación del manganeso para\(\ce{MnO_4^-} \rightarrow \ce{MnO_2}\):

Por lo tanto, necesitamos tres moles de estireno por cada ocho moles de permanganato:
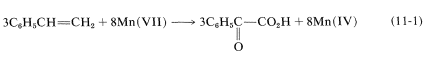
Para obtener el átomo general y el balance eléctrico para la Ecuación 11-1, se\(\ce{H_2O}\) deben agregar las cantidades requeridas de, pero la relación 3:8 permanecerá sin cambios:
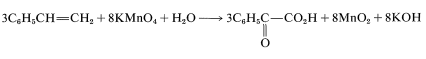
Debido a que\(\ce{KOH}\) reacciona de manera no oxidativa con ácidos carboxílicos para formar sales carboxilato\ (\ left (\ ce {RCO_2H} +\ ce {KOH}\ right tarrow\ ce {RCO_2K} +\ ce {H_2O}\ right), la ecuación final es
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


