11.2: Hidrogenación con catalizadores heterogéneos
- Page ID
- 73676
La adición de hidrógeno a un enlace múltiple es hidrogenación. Es aplicable a casi todos los tipos de enlaces múltiples y es de gran importancia en la química sintética, particularmente en la industria química. Probablemente el ejemplo técnico más importante es la producción de amoníaco por hidrogenación de nitrógeno:

Esto puede parecer un proceso sencillo, pero de hecho es difícil de llevar a cabo porque el equilibrio no es muy favorable. Se requieren altas presiones (\(150\)-\(200 \: \text{atm}\)) para obtener una conversión razonable, y altas temperaturas (\(430\)-\(510^\text{o}\)) son necesarias para obtener velocidades de reacción razonables. También se requiere un catalizador, generalmente óxido de hierro. La reacción es muy importante porque el amoníaco se usa en cantidades cada vez mayores como fertilizante ya sea directamente o a través de la conversión a urea o sales de amonio.
La producción de amoníaco requiere grandes cantidades de hidrógeno, la mayor parte del cual proviene de la oxidación parcial de hidrocarburos con agua u oxígeno. Un ejemplo sencillo e importante es la llamada reacción de “metano-vapor de agua”, que es favorable solo a temperaturas muy altas debido al efecto de entropía en la formación de\(\ce{H_2}\) (ver Sección 4-4B):

Por lo tanto, la industria de fertilizantes está estrechamente aliada con las industrias del gas natural y del petróleo, y por razones obvias el amoníaco y el hidrógeno a menudo se producen en los mismos lugares. ,
Los alquenos y alquinos agregan hidrógeno mucho más fácilmente que el nitrógeno. Por ejemplo, el eteno reacciona rápida y completamente con hidrógeno a presiones y temperaturas ordinarias en presencia de catalizadores metálicos como níquel, platino, paladio, cobre y cromo:

Estas reacciones son distintas a ninguna que hayamos encontrado hasta ahora. Son reacciones heterogéneas, lo que significa que el sistema de reacción consta de dos o más fases. Por lo general, el catalizador metálico está presente como una suspensión sólida finamente dividida en el líquido o solución a reducir. Alternativamente, el metal se deposita sobre un soporte sólido inerte tal como carbono, sulfato de bario\(\left( \ce{Al_2O_3} \right)\), alúmina o carbonato de calcio. Después, la mezcla del sustrato líquido y el catalizador sólido se agita o se agita en una atmósfera de hidrógeno. Sin embargo, entonces la reacción real tiene lugar en la superficie del catalizador metálico y es un ejemplo de catálisis heterogénea o superficial.
Mecanismo de Hidrogenación
Los mecanismos exactos de las reacciones heterogéneas son difíciles de determinar, pero se ha obtenido mucha información interesante y útil para la hidrogenación catalítica. Se cree que el catalizador metálico actúa uniendo los reactivos en la superficie de una red cristalina. Como ejemplo, considere la superficie de un cristal de níquel (Figura 11-1). Los átomos de níquel en la superficie tienen menos vecinos (menor covalencia) que los átomos en el interior del cristal. Por lo tanto, los átomos superficiales tienen capacidad de enlace residual y se puede esperar que se combinen con una variedad de sustancias.

Se ha demostrado experimentalmente que el eteno combina exotérmica\(\left( \Delta H^0 = -60 \: \text{kcal/mol} \right)\) y reversiblemente con una superficie metálica. Aunque se desconoce la estructura precisa del complejo eteno-níquel, la unión al níquel debe involucrar a los electrones del doble enlace porque los hidrocarburos saturados, como el etano, se combinan solo débilmente con la superficie del níquel. Una posible estructura con\(\sigma\) enlaces carbono-níquel se muestra en la Figura 11-1.
El gas hidrógeno se combina con el níquel bastante fácilmente con la disociación de los\(\ce{H-H}\) enlaces y la formación de\(\ce{Ni-H}\) enlaces (enlaces hidruro de níquel). El proceso de hidrogenación global se ve como una serie de etapas reversibles y secuenciales, como se resume en la Figura 11-2. Primero los reactivos, hidrógeno y eteno, se adsorben en la superficie del catalizador metálico. Las energías de los enlaces metal-hidrógeno y metal-carbono son tales que, en una segunda etapa, un hidrógeno se transfiere a carbono para dar un etilo unido al níquel. Este es el punto medio. En el siguiente paso, se rompe el enlace níquel-carbono y se forma el segundo enlace carbono-hidrógeno. La hidrogenación ya está completa y el producto se desorbe de la superficie del catalizador.

El etano tiene una baja afinidad por la superficie metálica y, cuando se desorbe, crea un espacio vacío para la adsorción de nuevas moléculas de eteno e hidrógeno. El ciclo continúa hasta que se consume uno de los reactivos o se adsorbe algún material que “envenena” la superficie y la hace incapaz de una mayor actividad catalítica. Debido a que la reacción ocurre solo en la superficie, pequeñas cantidades de un veneno catalizador pueden detener completamente la reacción.
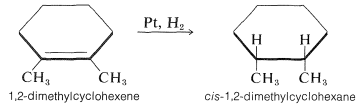
Como podría esperarse para el mecanismo postulado, los espaciamientos de los átomos metálicos en la red cristalina son bastante importantes para determinar las velocidades de hidrogenación. El mecanismo también explica la observación de que el hidrógeno generalmente se suma a un alqueno de manera suprafacial. Para ilustrar, el 1,2-dimetilciclohexeno se reduce a cis-1,2-dimetilciclohexano:
Actividad y selectividad del catalizador
Para una máxima actividad catalítica, el metal generalmente se prepara en un estado finamente dividido. Esto se logra para platino y paladio reduciendo los óxidos metálicos con hidrógeno antes de la hidrogenación del alqueno. Una forma especialmente activa de níquel (“níquel Raney”) se prepara a partir de una aleación de níquel-aluminio. Se agrega hidróxido de sodio a la aleación para disolver el aluminio. El níquel permanece como un polvo negro que es pirofórico (se quema en el aire) si no se mantiene húmedo:
\[2 \ce{Ni-Al} + 2 \ce{OH}^\ominus + 2 \ce{H_2O} \rightarrow 2 \ce{Ni} + 2 \ce{AlO_2^-} + 3 \ce{H_2}\]
También se pueden obtener catalizadores de platino, paladio y níquel altamente activos por reducción de sales metálicas con borohidruro de sodio\(\left( \ce{NaBH_4} \right)\).
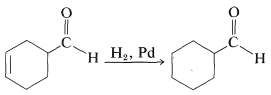
Como se mencionó anteriormente, los enlaces múltiples no se hidrogenan con igual facilidad. Este hecho puede ser aprovechado para llevar a cabo reacciones selectivas. Por ejemplo, la hidrogenación de un doble enlace carbono-carbono se puede lograr sin reducir simultáneamente un enlace carbonilo en la misma molécula. Por ejemplo, el doble enlace carbono-carbono del siguiente aldehído se puede reducir selectivamente:
Los alquinos se hidrogenan más fácilmente que los alquenos principalmente porque los alquinos se adsorben más fácilmente en la superficie del catalizador. La hidrogenación procede por etapas, primero al cis-alqueno y luego al alcano. Por ejemplo,

Normalmente, no es posible detener la hidrogenación de un alquino en la etapa de alqueno, pero si el catalizador se desactiva adecuadamente, se puede lograr la adición al triple enlace sin que se produzca una adición adicional al doble enlace resultante. El catalizador preferido para la hidrogenación selectiva de alquinos es el paladio parcialmente “envenenado” con una sal de plomo (catalizador Lindlar). Este catalizador muestra poca afinidad por adsorber alquenos y, por lo tanto, es ineficaz para llevar a cabo la hidrogenación a la etapa de alcano:

Los hidrocarburos aromáticos se hidrogenan con considerable dificultad, requiriendo temperaturas más altas, presiones más altas y tiempos de reacción más largos que para alquenos o alquinos:

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


