12.6: Los cicloalcanos más grandes y sus conformaciones
- Page ID
- 73081
La teoría de la deformación de Baeyer sugirió que los anillos de cicloalcanos más grandes son difíciles de sintetizar debido a la deformación angular asociada con anillos planos, como se calcula en la Tabla 12-3. Ahora sabemos que, a excepción del ciclopropano, ninguno de los cicloalcanos tiene anillos de carbono planos y que los cicloalcanos superiores tienen ángulos de enlace normales o casi normales. La razón de que los cicloalcanos superiores son generalmente difíciles de sintetizar a partir de compuestos de cadena abierta no es tanto la deformación angular, como planteó la hipótesis de Baeyer, sino la baja probabilidad de tener grupos reactivos en los dos extremos bastante remotos de una larga cadena hidrocarbonada que se unen para efectuar la ciclación. Por lo general, el acoplamiento de grupos reactivos en los extremos de diferentes moléculas ocurre con preferencia a la ciclación, a menos que las reacciones se lleven a cabo en soluciones muy diluidas. Esto se llama la técnica de alta dilución para lograr la formación de anillos cuando la reacción de formación de anillo tiene que competir con reacciones intermoleculares rápidas.
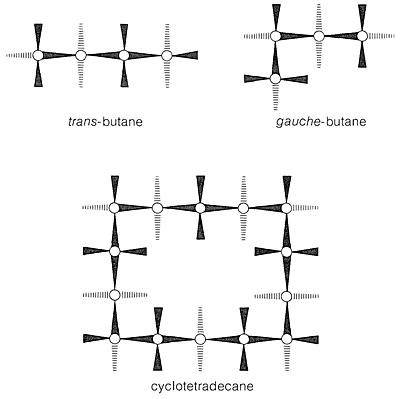
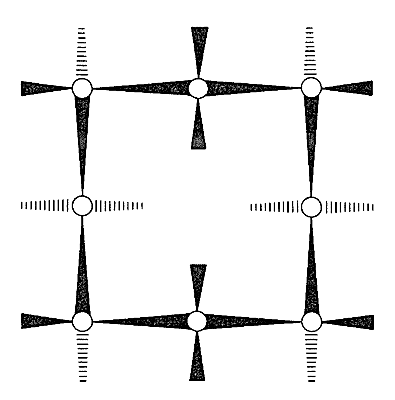
Con respecto a las conformaciones de los cicloalcanos más grandes, primero observamos que la forma silla del ciclohexano es una conformación “perfecta” para un cicloalcano. Los ángulos de\(\ce{C-C-C}\) unión están cerca de sus valores normales, todos los hidrógenos adyacentes están escalonados entre sí, y los hidrógenos 1,3-axiales no están lo suficientemente cerca como para experimentar repulsiones no unidas. Acerca de la única calificación que se podría poner a la idealidad de la forma de silla es que la conformación trans del butano es algo más estable que la conformación gauche (Sección 5-2), y que todos los\(\ce{C-C-C-C}\) segmentos de ciclohexano tienen la disposición gauche. Argumentando a partir de esto, J. Dale\(^6\) ha sugerido que los anillos grandes de cicloalcano tenderían a tener\(\ce{C-C-C-C}\) segmentos trans en la medida de lo posible y, de hecho, el ciclotetradecano parece ser más estable en una conformación rectangular con segmentos de\(\ce{C-C-C-C}\) enlace trans (Figura 12-16). Esta conformación tiene varias posiciones de sustituyentes posibles, pero debido a que solo se han aislado isómeros individuales de ciclotetradecanes monosustituidos, debe producirse un rápido equilibrio de los diversos isómeros conformacionales. Otras evidencias indican que la barrera a la interconversión de estas conformaciones está a punto\(7 \: \text{kcal mol}^{-1}\).
Con los cicloalcanos que tienen de 7 a 10 carbonos, hay problemas en tratar de hacer\(\ce{C-C-C-C}\) segmentos trans o gauche, ya que los tamaños de estos anillos no permiten los ángulos de unión o ángulos de torsión adecuados, o bien hay repulsiones no unidas más o menos serias. En consecuencia, cada uno de estos anillos asume una conformación de compromiso con algunos eclipses, algunas repulsiones no unidas y algunas distorsiones angulares. A continuación se presentan breves comentarios sobre algunas de estas conformaciones. Será útil utilizar modelos moleculares para ver las interacciones involucradas.
Cicloheptano
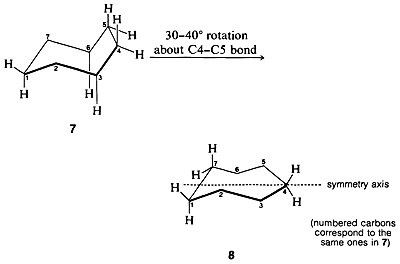
Las posibles conformaciones para el cicloheptano incluyen la forma de silla que aparece “cómoda”,\(7\). sin embargo, esta forma ha eclipsado los hidrógenos en\(\ce{C_4}\) y, así\(\ce{C_5}\) como las interacciones no unidas entre los hidrógenos axiales en\(\ce{C_3}\) y\(\ce{C_6}\). La mejor conformación de compromiso se logra mediante una\(30^\text{o}\)\(40^\text{o}\) rotación alrededor del\(\ce{C_4-C_5}\) enlace para aliviar la eclipsación de los hidrógenos. Esto extiende los hidrógenos interferentes en\(\ce{C_3}\)\(\ce{C_6}\) y resulta en una conformación algo menos tensa llamada silla giratoria. La silla giratoria,\(8\), es muy flexible y probablemente solo se requiere aproximadamente\(3 \: \text{kcal mol}^{-1}\) de activación para interconvertir las diversas conformaciones posibles de cicloheptano monosustituido.
Ciclooctano
Hay varias conformaciones de ciclooctano de aspecto más o menos razonable. Después de mucha investigación ahora es claro que la conformación favorecida es la silla de barco\(9\), que está en equilibrio con unas pocas décimas por ciento de la conformación de la corona,\(10\):
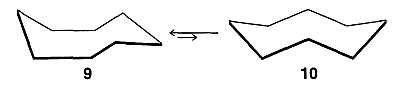
La energía de activación para la interconversión de estas dos formas es aproximadamente\(10 \: \text{kcal mol}^{-1}\). La conformación de barco-silla\(9\) es bastante flexible y el movimiento de sus\(\ce{CH_2}\) grupos entre las diversas posiciones posibles ocurre con una energía de activación de solo aproximadamente\(5 \: \text{kcal mol}^{-1}\).
Ciclononano
También se pueden desarrollar varias conformaciones más o menos razonables de ciclononano, pero la más favorable se llama torsión-barco-silla, que tiene simetría triple (Figura 12-17). La energía de activación para la inversión del anillo es de aproximadamente\(6 \: \text{kcal mol}^{-1}\).
Ciclodecano
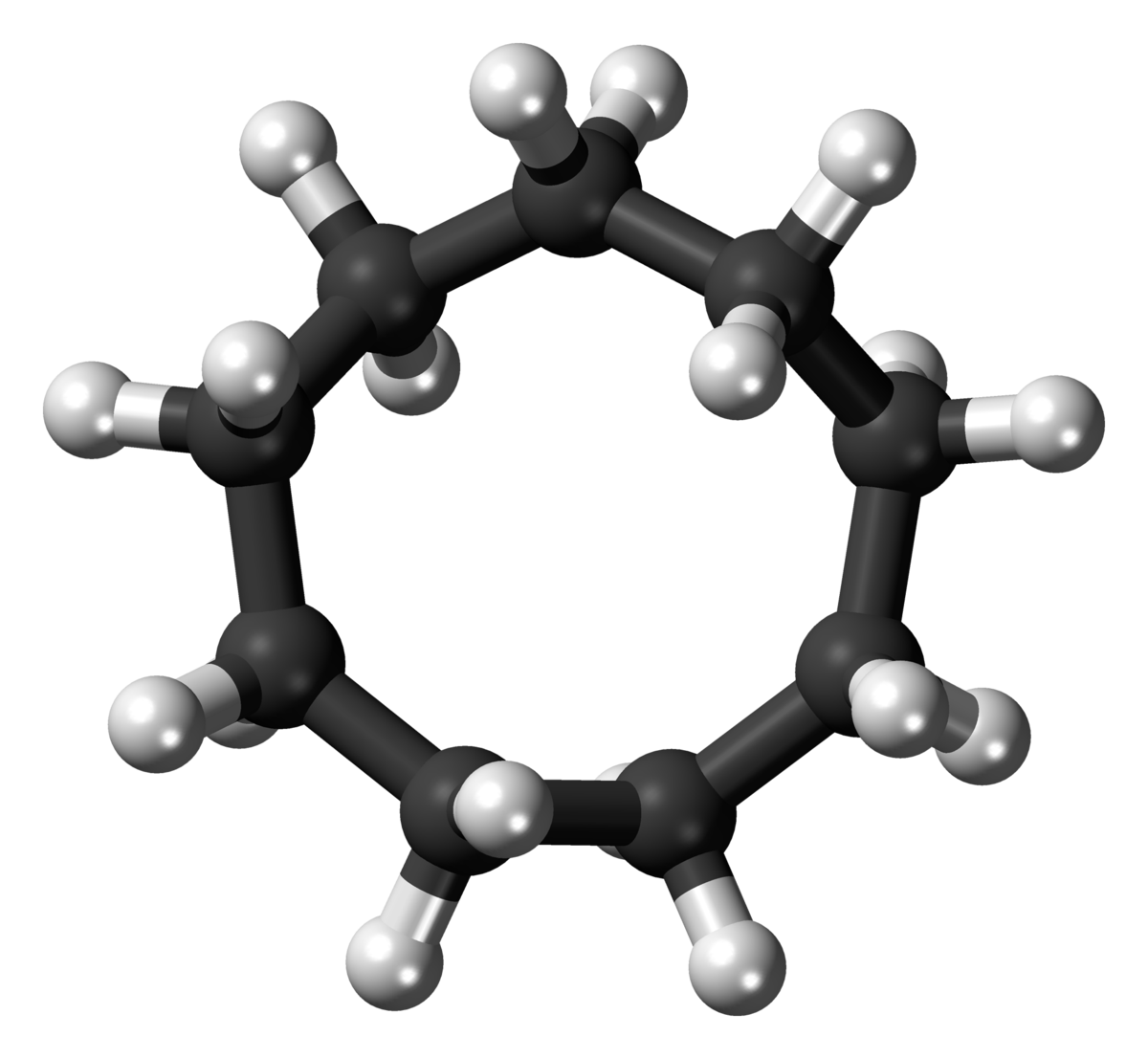
La conformación estable del ciclodecano (Figura 12-18) es similar a la del ciclotetradecano (Figura 12-16). Sin embargo, hay\(\ce{H} \cdot \cdot \cdot \cdot \ce{H}\) distancias relativamente cortas y los ángulos de\(\ce{C-C-C}\) enlace están algo distorsionados debido a las repulsiones de hidrógeno e hidrógeno en anillos cruzados. La posición más estable para un sustituyente en el anillo de ciclodecano es la indicada en la Figura 12-18. Las posiciones menos estables son aquellas en las que un sustituyente reemplaza a cualquiera de los seis hidrógenos mostrados, debido a que las interacciones no enlazadas son particularmente fuertes en estas posiciones. La energía de activación para la interconversión de las posiciones de los sustituyentes es aproximadamente\(6 \: \text{kcal mol}^{-1}\).
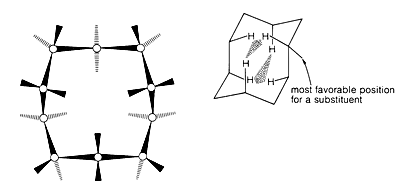
Conformación más estable de ciclodecano; representaciones de Dale y caballete. El área sombreada en la convención de caballete indica\(\ce{H} \cdot \cdot \cdot \cdot \ce{H}\) interacciones sustanciales no enlazadas.
\(^6\)Se pronuncia Dalluh.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


