13.2:1,3- o Dienos Conjugados. Adición Electrofílica y Radical
- Page ID
- 73410
Las reacciones de 1,3-butadieno son razonablemente típicas de los dienos conjugados. El compuesto sufre las reacciones habituales de alquenos, como hidrogenación catalítica o adiciones radicales y polares, pero lo hace más fácilmente que la mayoría de los alquenos o dienos que tienen dobles enlaces aislados. Además, los productos frecuentemente son los de adición 1,2 y 1,4:
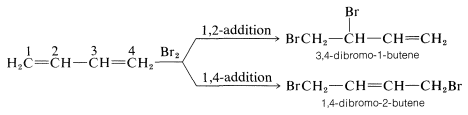
La formación de productos de adición 1,2 y 1,4 ocurre no solo con halógenos, sino también con otros electrófilos como los haluros de hidrógeno. El curso mecanicista de la reacción del 1,3-butadieno con cloruro de hidrógeno se muestra en la Ecuación 13-1. El primer paso, como ocurre con los alquenos, es la formación de un carbocatión. Sin embargo, con 1,3-butadieno, si el protón se agrega a\(\ce{C_1}\) (pero no\(\ce{C_2}\)), el catión resultante tiene una energía de deslocalización sustancial, con la carga distribuida sobre dos carbonos (revise las Secciones 6-5 y 6-5C si esto no es claro para usted). El ataque\(\ce{Cl}^\ominus\) como nucleófilo a uno u otro de los carbonos positivos produce el producto de adición 1,2 o 1,4:
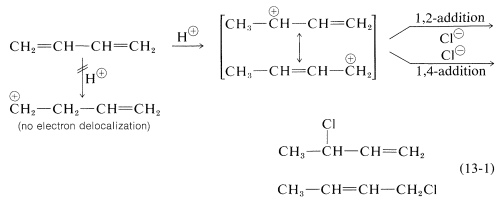
Una característica importante de las reacciones en las que las adiciones 1,2 y 1,4 ocurren en competencia entre sí es que la relación de los productos puede depender de la temperatura, el disolvente, y también del tiempo total de reacción. La razón de la dependencia del tiempo de reacción es que la formación del carbocatión es reversible, y la relación de productos en equilibrio no necesita ser la misma que la relación de las tasas de ataque de\(\ce{Cl}^\ominus\) at\(\ce{C_1}\) y\(\ce{C_3}\) del carbocatión. Este es otro ejemplo de una diferencia en las relaciones de producto resultante del control cinético versus el control de equilibrio.
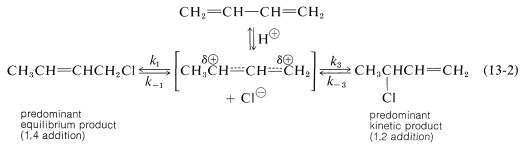
El hecho es que a bajas temperaturas predomina el producto 1,2 porque se forma más rápidamente, y las reacciones posteriores, correspondientes a\(k_{-1}\) o\(k_{-3}\), son lentas (Ecuación 13-2). Sin embargo, en equilibrio se favorece\(^1\) el producto 1,4 porque es más estable, no porque se forma más rápidamente.
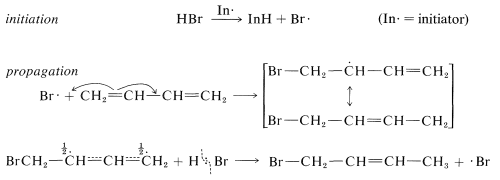
Los dienos conjugados también experimentan reacciones de adición por mecanismos de cadena radical. Aquí, el producto de adición casi siempre es el aducto 1,4. Así, la adición radical de bromuro de hidrógeno a 1,3-butadieno da l-bromo-2-buteno, presumiblemente por el siguiente mecanismo:
\(^1\)La relación de equilibrio se obtiene de la siguiente manera. En equilibrio\(k_1/k_{-1} = \left[ \ce{CH_3CH=CHCH_2Cl} \right]/\left[ \ce{R}^\oplus \right] \left[ \ce{Cl}^\ominus \right]\) y\(k_{-3}/k_3 = \left[ \ce{R}^\oplus \right] \left[ \ce{Cl}^\ominus \right]/\left[ \ce{CH_3CHClCH=CH_2} \right]\), en el que\(\ce{R}^\oplus\) se encuentra la concentración de carbocatión deslocalizado. La multiplicación de estas ecuaciones da\(k_1k_{-3}/k_{-1}k_3 = \left[ \ce{CH_3CH=CHCH_2Cl} \right]/\left[ \ce{CH_3CHClCH=CH_2} \right] = K_\text{eq}\).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


