13.3: Reacciones de cicloadición
- Page ID
- 73421
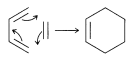
Hay una variedad de reacciones mediante las cuales los anillos se forman a través de la adición de dobles o triples enlaces. Un ejemplo especialmente sencillo es la adición de eteno a 1,3-butadieno para dar ciclohexeno:
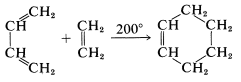
Se trata del prototipo de reacción de Diels-Alder, que ha demostrado ser tan valiosa en síntesis que ganó a sus descubridores, O. Diels y K. Alder, el Premio Nobel de Química en 1950.
La reacción de Diels-Alder es tanto una adición 1,4 o eteno a 1,3-butadieno como una adición 1,2 de butadieno al eteno. Se le puede llamar cicloadición [4 + 2] y como tal da como resultado la formación de un anillo de seis miembros. Se conocen muchas otras cicloadiciones, como [2 + 2], otros tipos de [4 + 2], y [2 + 2 + 2], que dan diferentes tamaños de anillos. A continuación se presentan algunos ejemplos específicos:
La importancia sintética de estas reacciones es muy grande y, debido a que muchas de ellas suelen involucrar dienos, discutiremos sus características generales en este capítulo. La reacción de cicloadición más valiosa es casi con certeza la reacción [4 + 2], o Diels-Alder, y se discutirá en detalle.
[4 + 2] Cicloadiciones
Hay un punto muy importante que debes recordar sobre la reacción de Diels-Alder: La reacción suele ocurrir bien solo cuando el componente [2] está sustituido con grupos atrayentes de electrones y el componente [4] está sustituido con grupos donadores de electrones, o al revés. La disposición más común es tener el alqueno (generalmente referido como el dienófilo) sustituido con grupos atrayentes de electrones como\(\ce{-CO_2H}\),\(\ce{-COR}\), o\(\ce{-C \equiv N}\). Por ejemplo,
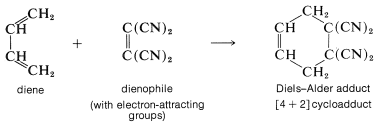
En la Tabla 13-1 se da una lista de los dienófilos más reactivos que portan grupos atrayentes de electrones. El eteno y otros alquenos simples generalmente son dienófilos pobres y reaccionan con 1,3-butadieno solo en condiciones bastante extremas y con bajo rendimiento.
Sin embargo, cuando el dieno está sustituido con varios grupos que atraen electrones como cloro o bromo, los grupos donadores de electrones en el dienófilo facilitan la reacción. Muchas sustancias, como el 2-metilpropeno, que actúan como dienófilos con hexaclorociclopentadieno simplemente no sufrirán [4 + 2] adición con el propio ciclopentadieno:

Cuadro 13-1: Dienófilos Reactivos con 1,3-Butadieno y Dienos Similares

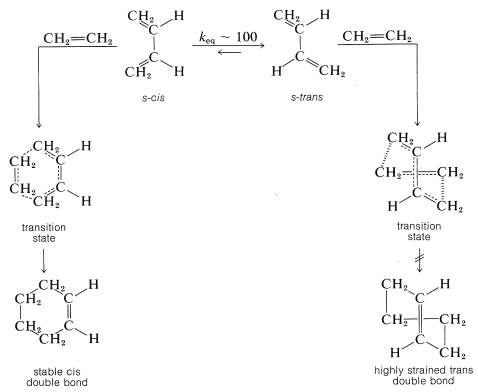
La reacción de Diels-Alder es altamente estereoespecífica. El dieno reacciona en una conformación desfavorable en la que sus dobles enlaces se encuentran en un plano en el mismo lado (cis) del enlace sencillo que los conecta. Esta conformación s-cis (o cisoide) es necesaria para dar un producto estable con un doble enlace cis. La adición de eteno a la conformación alternativa y más estable (transoide) daría un anillo trans-ciclohexeno imposiblemente tensado. Siguen posibles estados de transición para la reacción en cada conformación, y se verá que tendría que producirse una enorme distorsión molecular para permitir la adición de eteno a la conformación transoide:
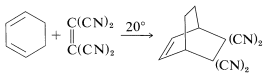
Los dienos cíclicos suelen reaccionar más fácilmente que los dienos de cadena abierta, probablemente porque tienen sus dobles enlaces fijados en la conformación adecuada para [4 + 2] cicloadición, en consecuencia ya se ha pagado el precio en energía de lograr la configuración s-cis:
Otra evidencia de estereoespecificidad en adiciones [4 + 2] es que las configuraciones del dieno y el dienófilo se retienen en el aducto. Esto significa que los reactivos (o agregados) se unen para dar adición suprafacial. A continuación se presentan dos ejemplos, los cuales se dibujan para enfatizar cómo ocurre la adición suprafacial. En el primer ejemplo, el cis-butadioato de dimetilo se añade al 1,3-butadieno para dar un ciclohexeno cis-sustituido:
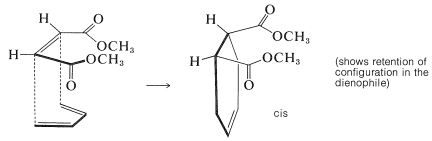
En el segundo ejemplo, se observa que la aproximación suprafacial de un dienófilo a los 2,5 carbonos del trans, trans-2,4-hexadieno conduce a un producto con dos grupos metilo en el mismo lado del anillo ciclohexeno:
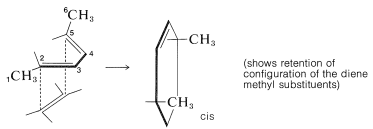
(El uso de modelos te ayudará a visualizar estas reacciones y su estereoquímica).
Hay otra característica de la reacción de Diels-Alder que se refiere a la orientación estereoquímica de los agregados. En la adición del anhídrido cis-butanodioico (anhídrido maleico) al ciclopentadieno hay dos formas posibles en que el dieno y el dienófilo podrían unirse para producir diferentes productos. Estas se muestran en las Ecuaciones 13-3 y 13-4:
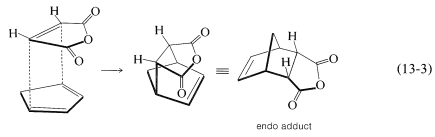
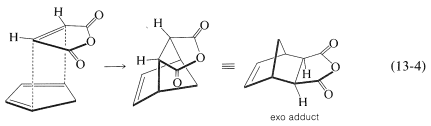
En la práctica, el aducto con la\(^2\) configuración endo suele ser el producto principal. Como regla general, las adiciones de Diels-Alder tienden a proceder a favorecer esa orientación que corresponde a tener los dobles enlaces de dieno y los sustituyentes insaturados del dienófilo más cercanos entre sí. Esto significa que la adición por la Ecuación 13-3 es más favorable que por la Ecuación 13-4, pero el grado de estereoespecialidad endo-exo no es tan alto como el grado de estereoespecialidad de adición suprafacial al dieno y dienófilo.
Hay excepciones a la estereoquímica de endo favorecida de las adiciones de Diels-Alder. Algunas de estas excepciones surgen porque la reacción de adición es reversible, siendo la disociación particularmente importante a alta temperatura. La configuración exo es generalmente más estable que la endo y, dado el tiempo para alcanzar el equilibrio (ver Sección 10-4A), el isómero exo puede ser el aducto principal. Así, solo se puede esperar la estereoespecificidad endo cuando las adiciones están sujetas a control cinético.
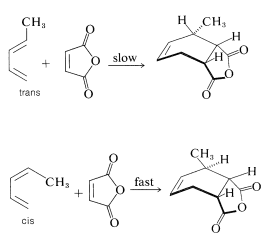
Las reactividades de los dienos en la reacción de Diels-Alder dependen del número y tipo de sustituyentes que poseen. Cuanto más grandes sean los sustituyentes, o más de ellos, en los extremos del sistema conjugado, más lenta es probable que sea la reacción. También hay una marcada diferencia en la reactividad con la configuración de dieno. Así, el trans-1,3-pentadieno es sustancialmente menos reactivo hacia un dienófilo dado (tal como anhídrido maleico) que el cis-1,3-pentadieno. De hecho, una mezcla de los isómeros cis y trans se puede separar aprovechando la diferencia en sus reactividades en la cicloadición:
Mecanismo de la Reacción Diels-Aliso
Hay poca evidencia que apoye mecanismos radicales o polares simples (como los que hemos discutido anteriormente) para la reacción de Diels-Alder. Como resultado de muchos estudios la reacción parece mejor formulada como un proceso en el que los enlaces entre el dieno y el dienófilo se forman esencialmente simultáneamente:
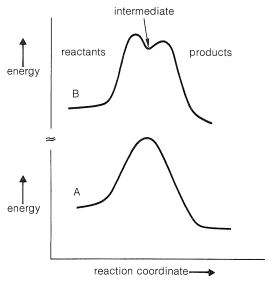
Ya hemos discutido algunas reacciones de adición que parecen ocurrir de manera concertada. Estos incluyen la adición de diimida, ozono e hidruros de boro a alquenos (Secciones 11-5, 11-7A y 11-6B). Las reacciones concertadas que tienen estados de transición cíclicos a menudo se denominan reacciones pericíclicas. Otros ejemplos serán considerados en capítulos posteriores.
A [4 + 2] Cicloadición
Se indicó previamente que el dióxido de azufre\(\left( \ce{SO_2} \right)\) y el 1,3-butadieno forman un producto de cicloadición [4 + 1]:
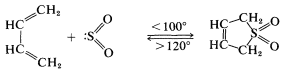
Esta reacción es más fácilmente reversible que la mayoría de las reacciones de Diels-Alder, y el producto se disocia en gran medida a los materiales de partida al calentarlo\(120^\text{o}\). El cicloaducto es una sulfona cíclica insaturada, que puede hidrogenarse para dar la sulfona cíclica saturada conocida como “sulfolano”:
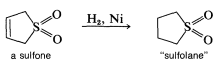
Este compuesto es ampliamente utilizado en la industria petroquímica como solvente selectivo.
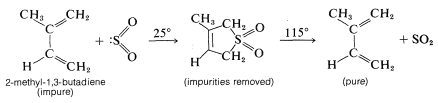
La reversibilidad de la\(\ce{SO_2}\) cicloadición de dieno lo hace útil en la purificación de dienos reactivos. El 2-metil-1,3-butadieno (isopreno) se purifica comercialmente de esta manera antes de ser polimerizado a caucho (Sección 13-4):
Ni el 1,3-ciclopentadieno ni el 1,3-ciclohexadieno reaccionan con el dióxido de azufre, probablemente porque los aductos estarían muy tensos:
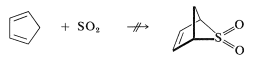
Algunas [2 + 2] Cicloadiciones
Muchos compuestos orgánicos naturales contienen anillos de carbono de seis miembros, pero hay relativamente pocos con anillos de carbono de cuatro miembros. Después de encontrar la considerable facilidad con la que se forman anillos de seis miembros por la cicloadición [4 + 2], podríamos esperar que las cicloadiciones [2 + 2] más simples para dar anillos de cuatro miembros también deberían ir bien, siempre que esa cepa no sea demasiado severa en los productos. De hecho, la dimerización del eteno es termodinámicamente favorable:

Sin embargo, esta y muchas otras reacciones de cicloadición [2 + 2] no ocurren con un simple calentamiento.
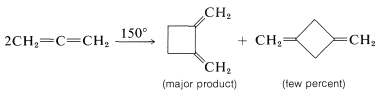
No obstante, hay algunas excepciones. Una es la dimerización del tetrafluoroeteno, lo que quizás no sea sorprendente, considerando los parámetros termodinámicos favorables:
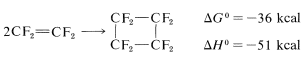
Lo sorprendente es que la adición de\(\ce{CF_2=CF_2}\) 1,3-butadieno da un ciclobutano y no un ciclohexano, aunque el producto [2 + 2] probablemente sea aproximadamente\(25 \: \text{kcal mol}^{-1}\) menos estable que el producto [4 + 2]:
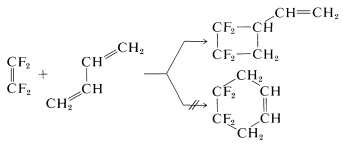
Dichas adiciones térmicas [2 + 2] generalmente se limitan a polihaloetenos y algunas sustancias con dobles enlaces acumulados, como 1,2-propadieno\(\left( \ce{CH_2=C=CH_2} \right)\) y cetenos\(\left( \ce{R_2C=C=O} \right)\). A continuación se presentan algunos ejemplos:

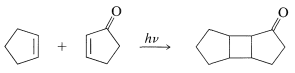
Muchas [2 + 2] cicloadiciones que no ocurren simplemente calentando los posibles reactivos se pueden lograr por irradiación con luz ultravioleta. El siguiente ejemplo, la adición de [2 + 2] de 2-ciclopentenona a ciclopenteno, ocurre fotoquímicamente pero no térmicamente:
En todas esas cicloadiciones fotoquímicas la energía requerida para lograr un estado de transición de cicloadición, que puede ascender a\(100 \: \text{kcal mol}^{-1}\) o más, se adquiere por absorción de luz.
Los productos de cicloadición termodinámicamente desfavorables se pueden formar fotoquímicamente. Un ejemplo llamativo es la conversión fotoquímica del norbornadieno en cuadricicleno. Lo contrario de esta reacción puede ocurrir con violencia casi explosiva en presencia de catalizadores metálicos apropiados o en simple calentamiento:

¿Por qué algunas [2 + 2] cicloadiciones ocurren térmicamente y otras fotoquímicamente? ¿Qué tienen de especial los fluoroalquenos y los dienos acumulados? Las respuestas son complejas, pero parece que la mayoría de las cicloadiciones térmicas [2 + 2], a diferencia de las cicloadiciones Diels-Alder [4 + 2], van por rutas escalonadas (ver Sección 21-11). Por qué los dos tipos de cicloadición térmica tienen diferentes mecanismos se discutirá en las Secciones 21-10A y B.
\(^2\)En general, la designación endo o exo se refiere a la configuración en sistemas de anillos puenteados o policíclicos como los mostrados en las Ecuaciones 13-3 y 13-4. Con referencia a los átomos puente, un sustituyente es exo si está en el mismo lado que el puente, o endo si está en el lado opuesto. Otros ejemplos son:
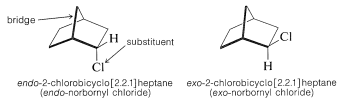
Al dibujar los isómeros endo y exo, es mejor representar las relaciones espaciales reales de los átomos lo más cerca posible. El anillo de ciclohexano se muestra aquí en forma de barco (Sección 12-3A) porque se mantiene en esta configuración por el grupo metileno que une las posiciones 1,4. Si no ve esto, le recomendamos encarecidamente que construya modelos.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."
- Layne A. Morsch (Universidad de Illinois Springfield)


