13.10: Grupos protectores en síntesis orgánica
- Page ID
- 73358
Uno de los principales problemas en la síntesis orgánica es la supresión de reacciones secundarias no deseadas. Frecuentemente la reacción deseada va acompañada de reacción en otras partes de la molécula, especialmente cuando está presente más de un grupo funcional. Los grupos funcionales suelen ser los sitios más reactivos en la molécula, y puede ser difícil o incluso imposible aislar un grupo funcional de una reacción que ocurre en otro. Por lo tanto, cualquier síntesis propuesta debe evaluarse en cada etapa para detectar posibles reacciones secundarias que puedan degradar o modificar la estructura de manera no deseada. Para ello se requerirá una comprensión de cómo las variaciones en la estructura afectan la reactividad química. Dicha comprensión se adquiere a través de la experiencia y conocimiento del mecanismo de reacción y la estereoquímica de la reacción.
Para ilustrar el propósito y la práctica de los grupos protectores en la síntesis orgánica, supongamos que la síntesis de cis-2-octeno, que esbozamos en la Sección 13-7, tiene que adaptarse para la síntesis de 5-octin-1-ol. Podríamos escribir lo siguiente:
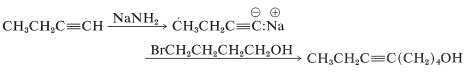

Sin embargo, la síntesis tal como está escrita fallaría porque el alquino es un ácido más débil que el alcohol (Sección 11-8), y el anión alquínido reaccionaría mucho más rápidamente con el protón ácido del alcohol de lo que desplazaría el ion bromuro del carbono:
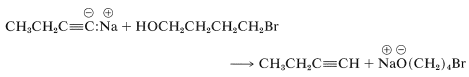

Por lo tanto, el grupo hidroxilo del 4-bromo-1-butanol debe protegerse antes de permitir que reaccione con la sal alquínida. Existen varias formas de proteger los grupos hidroxilo, pero un método, que es simple y efectivo, se basa en el hecho de que los éteres insaturados del tipo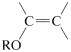
 son muy reactivos en las reacciones de adición electrófilas (Sección 10-4). Un alcohol se añade fácilmente al doble enlace de dicho éter en presencia de un catalizador ácido:
son muy reactivos en las reacciones de adición electrófilas (Sección 10-4). Un alcohol se añade fácilmente al doble enlace de dicho éter en presencia de un catalizador ácido:


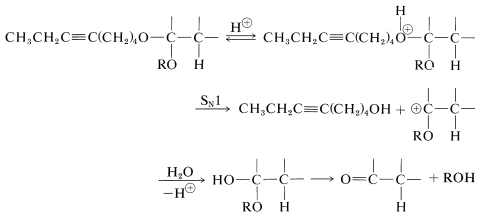
El compuesto protegido es un ácido mucho más débil que el alquino, y la reacción de desplazamiento se puede llevar a cabo con la sal alquínida sin dificultad. Para obtener el producto final, se debe eliminar el grupo protector, y esto se puede hacer en solución ácida acuosa diluida por un\(S_\text{N}1\) tipo de sustitución (Secciones 8-7D y 8-7E):

Algunos grupos protectores comunes en la síntesis orgánica
Grupos\(\left( \ce{OH} \right)\) protectores de hidroxilo en síntesis orgánica
Protección de alcoholes:
Acetilo\(\left( \ce{Ac} \right)\) — Eliminado por ácido o base.
Benzoilo\(\left( \ce{Bz} \right)\) — Eliminado por ácido o base, más estable que el\(\ce{Ac}\) grupo.
Bencilo (\(\ce{Bn}\),\(\ce{Bnl}\)) — Eliminado por hidrogenólisis. \(\ce{Bn}\)es ampliamente utilizado en la química del azúcar y de los nucleósidos.
\(\beta\)-Éter metoxietoximetílico (MEM) — Eliminado por ácido.
Dimetoxitritilo, [bis- (4-metoxifenil) fenilmetil] (DMT) — Eliminado por ácido débil. El grupo DMT es ampliamente utilizado para la protección del grupo 5'-hidroxi en nucleósidos, particularmente en la síntesis de oligonucleótidos.
Éter metoximetílico (MOM) — Eliminado por ácido.
Metoxitritilo [(4-metoxifenil) difenilmetilo, MMT) — Eliminado por ácido e hidrogenólisis.
Éter p-metoxibencílico (PMB) — Eliminado por ácido, hidrogenólisis u oxidación.
Metiltiometil éter — Eliminado por ácido.
Pivaloilo\(\left( \ce{Piv} \right)\) — Eliminado por ácido, base o agentes reductores. Es sustancialmente más estable que otros grupos protectores de acilo.
Tetrahidropiranilo (THP) — Eliminado por ácido.
Tritilo (trifenilmetilo,\(\ce{Tr}\)) — Eliminado por ácido e hidrogenólisis.
Éter de sililo (los más populares incluyen trimetilsililo (TMS), terc-butildimetilsililo (TBDMS), tri-iso-propilsililoximetilo (TOM) y éteres de triisopropilsililo (TIPS)) — Eliminado por iones ácido o fluoruro. (como\(\ce{NaF}\), TBAF (fluoruro de tetra-n-butilamonio, HF-Py o HF-net3)). Los grupos TBDMS y TOM se utilizan para la protección de la función 2'-hidroxi en nucleósidos, particularmente en la síntesis de oligonucleótidos.
Éteres metílicos — La escisión es por TMSI en DCM o MeCN o cloroformo. Un método alternativo para escindir éteres metílicos es BBr3 en DCM
Éteres etoxietílicos (EE): escisión más trivial que los éteres simples, por ejemplo, ácido clorhídrico 1N
Grupos protectores de amina en síntesis orgánica
Protección de aminas:
Grupo Carbobenciloxi (Cbz) — Eliminado por hidrogenólisis
Grupo P-metoxibencil carbonilo (Moz o MeOz) — Eliminado por hidrogenolisis, más lábil que Cbz
Grupo terc-butiloxicarbonilo (BOC) (Común en la síntesis de péptidos en fase sólida) — Eliminado por ácido fuerte concentrado. (como HCl o CF3COOH)
Grupo 9-Fluorenilmetiloxicarbonilo (FMOC) (Común en la síntesis de péptidos en fase sólida) - Eliminado por base, como piperidina
El grupo acetilo (Ac) es común en la síntesis de oligonucleótidos para la protección de N4 en citosina y N6 en bases nucleicas de adenina y se elimina por tratamiento con una base, la mayoría de las veces, con amoníaco o metilamina acuosa o gaseosa. El Ac es demasiado estable para ser eliminado fácilmente de las amidas alifáticas.
El grupo benzoílo (Bz) es común en la síntesis de oligonucleótidos para la protección de N4 en citosina y N6 en bases nucleicas de adenina y se elimina por tratamiento con una base, la mayoría de las veces con amoníaco o metilamina acuosa o gaseosa. Bz es demasiado estable para ser eliminado fácilmente de las amidas alifáticas.
Grupo bencilo (Bn) — Eliminado por hidrogenólisis
Grupo carbamato — Eliminado por ácido y calentamiento suave.
P-metoxibencilo (PMB) — Eliminado por hidrogenolisis, más lábil que el bencilo
3,4-Dimetoxibencilo (DMPM) — Eliminado por hidrogenolisis, más lábil que el p-metoxibencilo
grupo p-metoxifenilo (PMP) — Eliminado por nitrato de cerio amónico (IV) (CAN)
Grupo Tosyl (Ts) — Eliminado por ácido concentrado (HBr, H2SO4) y agentes reductores fuertes (sodio en amoníaco líquido o naftalenuro de sodio)
Otros grupos de sulfonamidas (Nosyl & Nps) — Eliminados por yoduro de samario, hidruro de tributilestaño
Grupos protectores de carbonilo en síntesis orgánica
Protección de grupos carbonilo:
Acetales y Cetales — Eliminados por ácido. Normalmente, la escisión de los acetales acíclicos es más fácil que de los acetales cíclicos.
Acilos — Eliminados por los ácidos de Lewis.
Dithianos — Eliminados por sales metálicas o agentes oxidantes.
Grupos protectores de ácido carboxílico en síntesis orgánica
Protección de ácidos carboxílicos:
Ésteres metílicos — Eliminados por ácido o base.
Ésteres bencílicos — Eliminados por hidrogenólisis.
Ésteres terc-butílicos — Eliminados por ácido, base y algunos reductores.
Ésteres de sililo — Eliminados por reactivos ácidos, bases y organometálicos.
Ortoésteres — Eliminados por ácido acuoso suave para formar éster, el cual se elimina de acuerdo con las propiedades del éster.
Oxazolina — Eliminada por ácido fuerte caliente (pH < 1, T > 100 °C) o álcali (pH > 12, T > 100 °C), pero no por ejemplo LiAlH4, reactivos de organolitio o reactivos de Grignard (organomagnesio)
Grupos protectores de fosfato en síntesis orgánica
2-cianoetilo — removido por base suave. El grupo es ampliamente utilizado en la síntesis de oligonucleótidos.
Metilo (Me) — eliminado por nucleófilos fuertes e.c. tiofenolo/TEA.
Grupos protectores de alquinos terminales en síntesis orgánica
alcoholes propargílicos en la reacción de Favorskii,
grupos sililo, especialmente en la protección del propio acetileno
Protección ortogonal en síntesis orgánica
La protección ortogonal es una estrategia que permite la desprotección de múltiples grupos protectores uno a la vez cada uno con un conjunto dedicado de condiciones de reacción sin afectar al otro. Fue introducido en el campo de la síntesis de péptidos por Robert Bruce Merrifield en 1977. Como prueba de concepto se demuestra la desprotección ortogonal en una transesterificación fotoquímica por trimetilsilildiazometano utilizando el efecto isótopo cinético:
Debido a este efecto, el rendimiento cuántico para la desprotección del grupo éster del lado derecho se reduce y se mantiene intacto. Significativamente al colocar los átomos de deuterio junto al grupo éster del lado izquierdo o al cambiar la longitud de onda a 254 nm se obtiene el otro monoareno.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."



