15.5: Reacciones Químicas de Alcoholes. Reacciones que involucran el enlace O-H
- Page ID
- 72972
Propiedades ácidas
Varias reacciones químicas importantes de los alcoholes involucran solo el enlace oxígeno-hidrógeno y dejan intacto el enlace carbono-oxígeno. Un ejemplo importante es la formación de sal con ácidos y bases. Los alcoholes, como el agua, son tanto bases débiles como ácidos débiles. La constante\(\left( K_\text{a} \right)\) de ionización ácida del etanol es aproximadamente\(10^{-18}\), ligeramente menor que la del agua. El etanol se puede convertir en su base conjugada por la base conjugada de un ácido más débil tal como amoníaco\(\left( K_\text{a} \sim 10^{-35} \right)\) o hidrógeno\(\left( K_\text{a} \sim 10^{-38} \right)\). Es conveniente emplear metal de sodio o hidruro de sodio, que reaccionan vigorosamente pero de manera controlable con alcoholes:
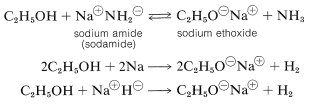
El orden de acidez de diversos alcoholes líquidos generalmente es agua\(>\) primaria\(>\) secundaria | (>\) terciaria\(\ce{ROH}\). Con esto queremos decir que la posición de equilibrio para la reacción de transferencia de protones (Ecuación 15-1) se encuentra más en el lado de\(\ce{ROH}\) y\(\ce{OH}^\ominus\) como\(\ce{R}\) se cambia de primaria a secundaria a terciaria; por lo tanto, el alcohol terc - butílico es considerado menos ácido que el etanol:
\[\ce{ROH} + \ce{OH}^\ominus \rightleftharpoons \ce{RO}^\ominus + \ce{HOH} \tag{15-1}\]
Sin embargo, en la fase gaseosa se invierte el orden de acidez, y la posición de equilibrio para la Ecuación 15-1 se encuentra cada vez más en el lado de\(\ce{RO}^\ominus\) como\(\ce{R}\) se cambia de primaria a secundaria a terciaria. Por lo tanto, el alcohol terc - butílico es más ácido que el etanol en la fase gaseosa. Esta aparente contradicción parece más razonable cuando se considera qué efecto tiene la solvatación (o la falta de ella) sobre los equilibrios expresados por la Ecuación 15-1. En solución, los aniones más grandes de los alcoholes, conocidos como iones alcóxido, probablemente están menos bien solvatados que los iones más pequeños, porque se pueden acomodar menos moléculas de disolvente alrededor del oxígeno cargado negativamente en los iones más grandes:
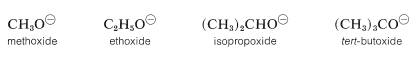
La acidez de los alcoholes disminuye a medida que aumenta el tamaño de la base conjugada. Sin embargo, los iones gaseosos “desnudos” son más estables cuanto más grandes son\(\ce{R}\) los grupos asociados, probablemente porque los\(\ce{R}\) grupos más grandes pueden estabilizar la carga en el átomo de oxígeno mejor que los\(\ce{R}\) grupos más pequeños. Lo hacen por polarización de sus electrones de unión, y cuanto más grande es el grupo, más polarizable es. (Véase también la Sección 11-8A, que trata de la situación algo similar que se encontró con respecto a las acideces relativas del etino y el agua.)
Propiedades Básicas
Los alcoholes son bases similares en fuerza al agua y aceptan protones de ácidos fuertes. Un ejemplo es la reacción de metanol con bromuro de hidrógeno para dar bromuro de metiloxonio, que es análogo a la formación de bromuro de hidroxonio con bromuro de hidrógeno y agua:
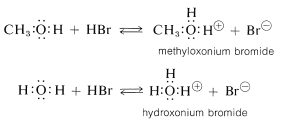
Propiedades Nucleofílicas - Formación de Éter
La formación de iones alcóxido es importante como medio para generar un nucleófilo fuerte que formará fácilmente\(\ce{C-O}\) enlaces en\(S_\text{N}2\) las reacciones. Así, el etanol reacciona muy lentamente con yoduro de metilo para dar metil etil éter, pero el etóxido de sodio en solución de etanol reacciona bastante rápidamente:
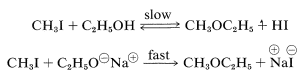
De hecho, la reacción de alcóxidos con haluros de alquilo o sulfatos de alquilo es un método general importante para la preparación de éteres, y se conoce como la síntesis de Williamson. Las complicaciones pueden ocurrir porque el aumento de la nucleofilia asociada a la conversión de un alcohol en un ion alcóxido siempre va acompañado de un aumento aún mayor en la potencia de eliminación por el\(E2\) mecanismo. La reacción de un haluro de alquilo con alcóxido puede ser entonces de eliminación en lugar de sustitución, dependiendo de la temperatura, la estructura del haluro y el alcóxido (Sección 8-8). Por ejemplo, si deseamos preparar éter isopropílico metílico, se obtendrían mejores rendimientos si usáramos yoduro de metilo e ión isopropóxido en lugar de yoduro de isopropilo e ion metóxido debido a la prevalencia de\(E2\) eliminación con esta última combinación:
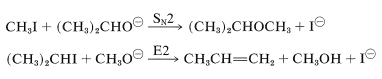
El terc - butóxido de potasio es un excelente reactivo para lograr\(E2\) la eliminación porque es fuertemente básico y tan voluminoso que no sufre\(S_\text{N}2\) reacciones fácilmente.
Propiedades Nucleofílicas. Formación de Ester
Un éster puede considerarse como un ácido carboxílico en el que el protón ácido ha sido reemplazado por algún grupo orgánico\(\ce{R}\),
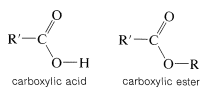
Los ésteres se pueden preparar a partir de ácidos carboxílicos y alcoholes siempre que esté presente un catalizador ácido.
o pueden prepararse a partir de haluros y alcoholes de acilo o de anhidridos y alcoholes carboxílicos:

Estas reacciones generalmente se pueden expresar por la ecuación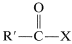 \(+ \ce{ROH} \rightarrow\)
\(+ \ce{ROH} \rightarrow\)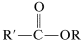 \(+ \ce{HX}\) que en general es un desplazamiento nucleofílico del\(\ce{X}\) grupo por el nucleófilo\(\ce{ROH}\). Sin embargo, el mecanismo de desplazamiento es bastante diferente de los\(S_\text{N}2\) desplazamientos de derivados de alquilo\(\ce{R'X} + \ce{ROH} \rightarrow \ce{R'OR} + \ce{HX}\), y se asemeja mucho a los desplazamientos nucleofílicos de haluros de arilo activados (Sección 14-6B) en ser un proceso de adición-eliminación.
\(+ \ce{HX}\) que en general es un desplazamiento nucleofílico del\(\ce{X}\) grupo por el nucleófilo\(\ce{ROH}\). Sin embargo, el mecanismo de desplazamiento es bastante diferente de los\(S_\text{N}2\) desplazamientos de derivados de alquilo\(\ce{R'X} + \ce{ROH} \rightarrow \ce{R'OR} + \ce{HX}\), y se asemeja mucho a los desplazamientos nucleofílicos de haluros de arilo activados (Sección 14-6B) en ser un proceso de adición-eliminación.
Los haluros de acilo tienen un carbono carbonílico bastante positivo debido a la polarización de los enlaces carbono-oxígeno y carbono-halógeno. La adición de un grupo nucleofílico como el oxígeno de un alcohol ocurre con bastante facilidad.
adición
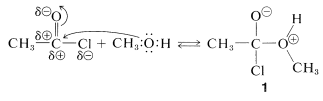
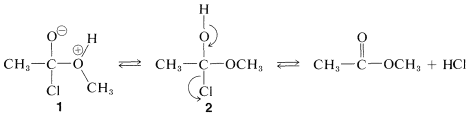
El complejo\(1\) contiene tanto un grupo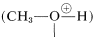 ácido como un grupo básico
ácido como un grupo básico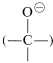 , de manera que un protón se desplaza de un oxígeno a otro para dar\(2\), que luego pierde rápidamente cloruro de hidrógeno ya sea por una eliminación\(E1\) - o\(E2\) tipo para formar el éster.
, de manera que un protón se desplaza de un oxígeno a otro para dar\(2\), que luego pierde rápidamente cloruro de hidrógeno ya sea por una eliminación\(E1\) - o\(E2\) tipo para formar el éster.
eliminación
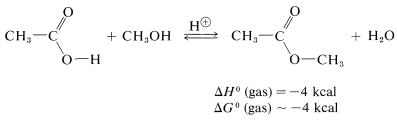
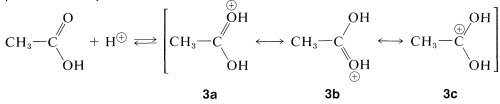
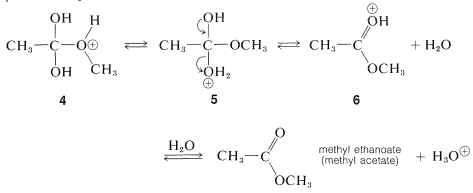
Una reacción similar pero fácilmente reversible ocurre entre alcoholes y ácidos carboxílicos, que es lenta en cualquier dirección en ausencia de un ácido mineral fuerte. El efecto catalítico de los ácidos, tales como\(\ce{H_2SO_4}\)\(\ce{HCl}\),, y\(\ce{H_3PO_4}\) se produce por protonación del oxígeno carbonílico del ácido carboxílico, dando así\(3\). Esta protonación mejora en gran medida la afinidad del carbono carbonilo por un par de electrones sobre el oxígeno del alcohol (i.e.,\(3 \rightarrow 4\)).
paso de protonación
paso de adición
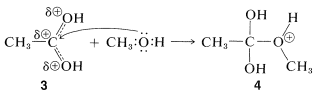
Posteriormente, se transfiere un protón de la\(\ce{OCH_3}\) a un\(\ce{OH}\) grupo de\(4\) para dar\(5\). Este proceso\(\ce{OH}\) convierte al en un buen grupo de salida\(\left( \ce{H_2O} \right)\). Cuando\(\ce{H_2O}\) sale, el producto,\(6\), es el ácido conjugado del éster. Transferencia de un protón de\(6\) a una base tal como\(\ce{H_2O}\) o\(\ce{HSO_4^-}\) completa la reacción, dando el éster neutro y regenerando el catalizador ácido.
transferencia y eliminación de protones
Aunque una pequeña cantidad de catalizador ácido fuerte es esencial en la preparación de ésteres a partir de ácidos y alcoholes, la cantidad de catalizador ácido añadido no debe ser demasiado grande. La razón del comportamiento “demasiado de algo bueno” del catalizador se puede entender a partir de las propiedades básicas de los alcoholes (Sección 15-4B). Si hay demasiado ácido presente, entonces demasiado del alcohol se convierte en la sal de oxonio:
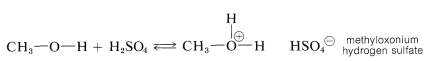
Claramente, la formación del ion metiloxonio puede operar solo para reducir la reactividad nucleofílica del metanol hacia el carbono carbonilo del ácido carboxílico.
Otra limitación práctica de las reacciones de esterificación es el impedimento estérico. Si bien el ácido o el alcohol participantes poseen grupos altamente ramificados, las posiciones de equilibrio son menos favorables y las tasas de esterificación son lentas. En general, la facilidad de esterificación para alcoholes\(\ce{ROH}\), por el mecanismo descrito es primario\(\ce{R}\)\(>\) secundario\(\ce{R}\)\(>\) terciario\(\ce{R}\) con un ácido carboxílico dado.
Como se mencionó, la esterificación es reversible, y con etanol y ácido etanoico la constante de equilibrio para la fase líquida es de aproximadamente 4\(\left( \Delta G^0 = -0.8 \: \text{kcal} \right)\) a temperatura ambiente, lo que corresponde a la\(66\%\) conversión a éster:
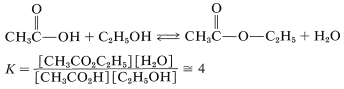
La reacción puede ser conducida hasta su finalización eliminando el éster o el agua o ambos a medida que se forman.
Propiedades Nucleofílicas - Formación de Hemiacetal, Hemicetal y Acetal
La unidad estructural,
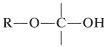
posee tanto un grupo alcoxilo\(\left( \ce{OR} \right)\) como un\(\left( \ce{OH} \right)\) grupo hidroxilo en el mismo carbono. Este arreglo, aunque a menudo inestable, es una característica importante de los carbohidratos como la glucosa, la fructosa y la ribosa. Cuando la agrupación es del tipo
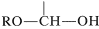 ,
,
se le llama hemiacetal, y si es
 ,
,
sin hidrógeno unido al carbono, se llama hemicetal:
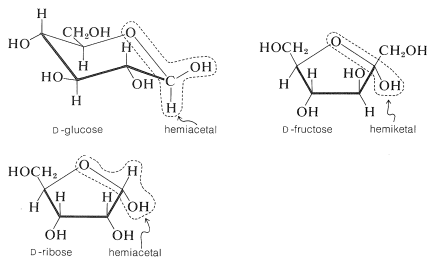
Cada uno de estos compuestos tiene varios otros grupos hidroxilo, pero solo uno de ellos es un hidroxilo hemiacetal o hemicetal. Asegúrate de poder identificar cuál.
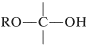
La función acetal tiene dos\(\left( \ce{OR} \right)\) grupos alcoxi y un hidrógeno en el mismo carbono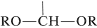 , mientras que la función cetal tiene la misma estructura pero sin hidrógeno en el carbono. Estas agrupaciones también se encuentran en carbohidratos y en derivados de carbohidratos, y se denominan funciones glicosido (ver Capítulo 20).
, mientras que la función cetal tiene la misma estructura pero sin hidrógeno en el carbono. Estas agrupaciones también se encuentran en carbohidratos y en derivados de carbohidratos, y se denominan funciones glicosido (ver Capítulo 20).
Para nuestros propósitos actuales, nos interesan las formas en que se forman hemiacetales, acetales, hemicetales y cetales. Los hemiacetales y hemicetales pueden considerarse como productos de la adición de alcoholes a los grupos carbonilo de aldehídos y cetonas. Así, el metanol se añade al etanal para dar un hemiacetal, 1-metoxietanol:

Los acetales y cetales resultan de la sustitución de un grupo alcoxi por el\(\ce{OH}\) grupo de un hemiacetal o hemicetal. Así, el metanol puede reaccionar con 1-metoxietanol para formar el acetal, 1,1-dimetoxietano y agua:

Las reacciones de alcoholes con aldehídos y cetonas están relacionadas con las reacciones de alcoholes con ácidos (esterificación) discutidas en la sección anterior. Ambos tipos implican la adición de alcoholes a grupos carbonilo, y ambos son catalizados por ácido.
La catálisis ácida de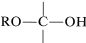 formación, como la formación de éster, depende de la formación del ácido conjugado del compuesto carbonilo. Se espera que esto mejore el carácter positivo (electrófilo) del carbono carbonílico para que el alcohol nucleofílico pueda agregarle fácilmente:
formación, como la formación de éster, depende de la formación del ácido conjugado del compuesto carbonilo. Se espera que esto mejore el carácter positivo (electrófilo) del carbono carbonílico para que el alcohol nucleofílico pueda agregarle fácilmente:
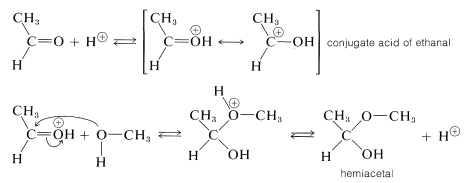
El hemiacetal puede reaccionar adicionalmente, también con la ayuda de un catalizador ácido. La adición de un protón puede ocurrir de dos maneras, para dar\(7\) o\(8\):
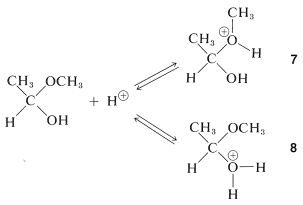
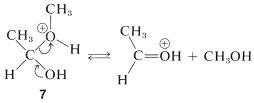
El primero de estos\(7\),, tiene\(\ce{CH_3OH}\) como grupo saliente y vuelve al ácido conjugado del etanal. Esto es lo contrario de la formación de hemiacetales catalizados por ácido:
El segundo de estos,\(8\), tiene\(\ce{H_2O}\) como grupo lábil y puede formar una nueva entidad, el catión metoxietilo,\(9\):
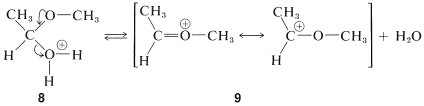
El ion\(9\) se asemeja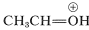 y se puede esperar que se comporte de manera similar añadiendo una segunda molécula de alcohol al carbono electrófilo. El producto,\(10\), es entonces el ácido conjugado del acetal y pierde un protón para dar el acetal:
y se puede esperar que se comporte de manera similar añadiendo una segunda molécula de alcohol al carbono electrófilo. El producto,\(10\), es entonces el ácido conjugado del acetal y pierde un protón para dar el acetal:

La formación de hemiacetales y acetales, así como de hemicetales y cetales, es reversible en condiciones ácidas, como ya hemos señalado para la esterificación catalizada por ácido. La reacción inversa es hidrólisis y el equilibrio para esta reacción se puede hacer favorable al tener un exceso de agua presente:
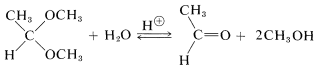
La posición de equilibrio en la formación de acetal y hemiacetal es bastante sensible al impedimento estérico. Los grupos grandes tanto en el aldehído como en el alcohol tienden a hacer que la reacción sea menos favorable. El Cuadro 15-3 muestra algunas conversiones típicas en la formación de acetal cuando se permite que 1 mol de aldehído llegue al equilibrio con 5 moles de alcohol. Para las cetonas, los equilibrios son aún menos favorables que para los aldehídos, y para obtener una conversión razonable se debe eliminar el agua a medida que se forma.
| Porcentaje de Conversión a Acetal | ||||
|---|---|---|---|---|
| aldehído | Etanol | Ciclohexano | 2-Propoanol | Alcohol terc-butílico |
| \(CH_3CHO\) | 78% | 56% | 43% | 23% |
| \((CH_3)_2CHCHO\) | 71% | - | 23% | - |
| \((CH_3)_3CCHO\) | 56% | 16% | 11% | - |
| \(C_6H_5CHO\) | 39% | 235 | 13% | - |
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


