15.7: Oxidación de Alcoholes
- Page ID
- 72994
De acuerdo con la escala de niveles de oxidación establecida para el carbono (ver Cuadro 11-1),\(\left( \ce{RCH_2OH} \right)\) los alcoholes primarios se encuentran en un nivel de oxidación menor que cualquiera de los aldehídos\(\left( \ce{RCHO} \right)\) o ácidos carboxílicos\(\left( \ce{RCO_2H} \right)\). Con agentes oxidantes adecuados, los alcoholes primarios de hecho se pueden oxidar primero a aldehídos y luego a ácidos carboxílicos.
alcoholes primarios
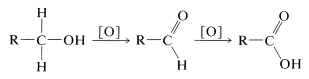
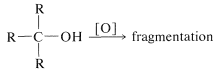
A diferencia de las reacciones discutidas anteriormente en este capítulo, la oxidación de alcoholes involucra la porción alquílica de la molécula, o más específicamente, los\(\ce{C-H}\) enlaces del carbono portador de hidroxilos (el\(\alpha\) carbono). Los alcoholes secundarios, que solo tienen uno de esos\(\ce{C-H}\) enlaces, se oxidan a cetonas, mientras que los alcoholes terciarios, que no tienen\(\ce{C-H}\) enlaces al carbono hidroxílico, se oxidan solo con la degradación acompañante en fragmentos más pequeños por escisión de enlaces carbono-carbono.
alcoholes secundarios
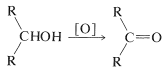
alcoholes terciarios
Oxidación Industrial de Alcoholes
La conversión de etanol en etanal se lleva a cabo a escala comercial haciendo pasar etanol gaseoso sobre un catalizador de cobre en\(300^\text{o}\):

A temperatura ambiente esta reacción es endotérmica con una constante de equilibrio de aproximadamente\(10^{22}\). A\(300^\text{o}\) conversiones de\(20\%\) -\(50\%\) por pasada se pueden realizar y, reciclando el alcohol sin reaccionar, el rendimiento puede ser mayor que\(90\%\).
Otro proceso comercial utiliza un catalizador de plata y oxígeno para combinar con el hidrógeno, lo que hace que la reacción neta sea sustancialmente exotérmica:
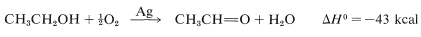
En efecto, esta es una reacción de combustión parcial y requiere un control muy cuidadoso para evitar la sobreoxidación. De hecho, modificando las condiciones de reacción (relación alcohol-oxígeno, temperatura, presión y tiempo de reacción), la oxidación procede suavemente a ácido etanoico:
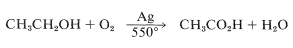
Las reacciones de este tipo son particularmente adecuadas como procesos industriales porque generalmente se pueden ejecutar en reactores de flujo continuo, y pueden utilizar un agente oxidante barato, generalmente suministrado directamente como aire.
Oxidación de Alcoholes
Oxidación de ácido crómico
La oxidación de laboratorio de alcoholes con mayor frecuencia se lleva a cabo con ácido crómico\(\left( \ce{H_2CrO_4} \right)\), que generalmente se prepara según se requiera a partir de óxido crómico\(\left( \ce{CrO_3} \right)\) o a partir de dicromato de sodio\(\left( \ce{Na_2Cr_2O_7} \right)\) en combinación con ácido sulfúrico. El ácido etanoico (acético) es un disolvente útil para tales reacciones:
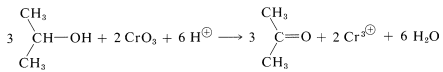
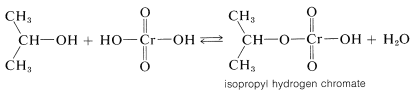
El mecanismo de la oxidación del ácido crómico del 2-propanol a 2-propanona (acetona) ha sido investigado muy a fondo. Es una reacción muy interesante ya que revela cómo pueden ocurrir cambios de estado de oxidación en una reacción que involucra un compuesto inorgánico típico y uno orgánico típico. La etapa inicial es la formación reversible de un éster isopropílico de ácido crómico. Este éster es inestable y no está aislado:
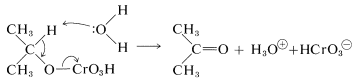
El paso posterior es el más lento en la secuencia y parece implicar el ataque de una base (agua) al hidrógeno alfa del éster de cromato concurrente con la eliminación del\(\ce{HCrO_3^-}\) grupo. Existe una analogía obvia entre esta etapa y una\(E2\) reacción (Sección 8-8A):
La transformación de ácido crómico en\(\ce{H_2CrO_3}\) cantidades\(\left( \ce{H_2CrO_4} \right)\) a la reducción de cromo de un estado de oxidación de\(+6\) a\(+4\). La desproporción de Cr (IV) ocurre rápidamente para dar compuestos de Cr (III) y Cr (VI):
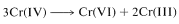
o
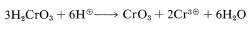
El\(E2\) carácter de la etapa de formación de cetonas se ha demostrado de dos maneras. Primero, la velocidad de descomposición del cromato de hidrógeno isopropílico a 2-propanona y\(\ce{H_2CrO_3}\) es fuertemente acelerada por sustancias eficientes que eliminan protones. Segundo, el hidrógeno en el\(\alpha\) carbono claramente se elimina en una reacción lenta debido a que la velocidad de oxidación global se reduce siete veces al tener un deuterio en lugar del\(\alpha\) hidrógeno. No se observa una ralentización significativa de la oxidación para el 2-propanol que tiene deuterio en los grupos metilo:
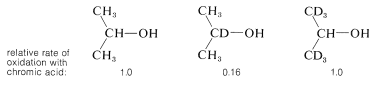
Los enlaces carbono-deuterio normalmente se rompen más lentamente que los enlaces carbono-hidrógeno. Este llamado efecto de isótopo cinético proporciona un método general para determinar si los enlaces carbono-hidrógeno particulares se rompen en etapas de reacción lentas.
Los alcoholes primarios son oxidados por ácido crómico en solución de ácido sulfúrico a aldehídos, pero para detener la reacción en la etapa de aldehído, generalmente es necesario eliminar el aldehído de la mezcla de reacción a medida que se forma. Esto se puede hacer por destilación si el aldehído es razonablemente volátil:
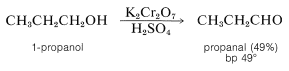
Los alcoholes insaturados pueden ser oxidados a cetonas insaturadas por el ácido crómico, porque el ácido crómico generalmente ataca los dobles enlaces con relativa lentitud:
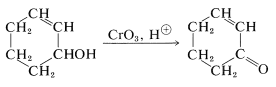
Sin embargo, se esperan complicaciones cuando el doble enlace de un alcohol insaturado es particularmente reactivo o cuando el alcohol se reorganiza fácilmente en condiciones fuertemente ácidas. Es posible evitar el uso de ácido fuerte a través de la combinación de óxido crómico con la base débil azabenceno (piridina). Se forma un sólido cristalino de composición\(\ce{(C_5H_5N)_2} \cdot \ce{CrO_3}\) cuando\(\ce{CrO_3}\) se agrega al exceso de piridina a bajas temperaturas. (La adición de piridina a\(\ce{CrO_3}\) es probable que dé una reacción incontrolable que resulte en un incendio).
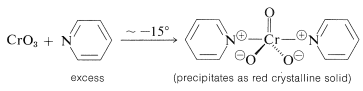
El\(\ce{CrO_3}\) reactivo piridina es soluble en disolventes clorados como el diclorometano, y las soluciones resultantes se oxidan rápidamente a
a temperaturas ordinarias:
temperaturas ordinarias:
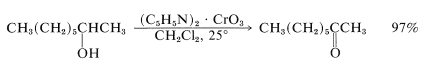
Los rendimientos suelen ser buenos, en parte porque la ausencia de ácido fuerte minimiza la degradación y el reordenamiento, y en parte porque el producto puede aislarse fácilmente. Los productos inorgánicos son insolubles y pueden separarse por filtración, dejando así el producto oxidado en diclorometano del que se puede recuperar fácilmente.
Oxidación de Permanganato
El ion permanganato\(\ce{MnO_4^-}\), oxida tanto los alcoholes primarios como secundarios en solución básica o ácida. Con alcoholes primarios el producto normalmente es el ácido carboxílico porque el aldehído intermedio se oxida rápidamente por permanganato:
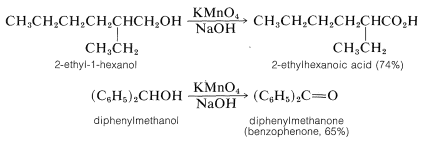
La oxidación en condiciones básicas implica evidentemente el ion alcóxido en lugar del alcohol neutro. El agente oxidante,\(\ce{MnO_4^-}\), abstrae el hidrógeno alfa del ion alcóxido ya sea como un átomo (transferencia de un electrón) o como hidruro,\(\ce{H}^\ominus\) (transferencia de dos electrones). Los pasos para la secuencia de dos electrones son:
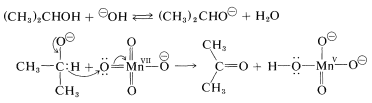
En la segunda etapa, el ion permanganato se reduce de Mn (VII) a Mn (V). Sin embargo, los estados estables de oxidación del manganeso son\(+2\)\(+4\), y\(+7\); así, el ion Mn (V) formado se desproporciona a Mn (VII) y Mn (IV). El producto final de manganeso normal de las oxidaciones en solución básica es el dióxido de manganeso\(\ce{MnO_2}\), en el que\(\ce{Mn}\) tiene un estado de oxidación\(+4\) correspondiente a Mn (IV).
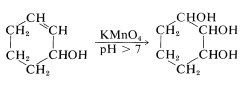
En la Sección 11-7C describimos el uso de permanganato para la oxidación de alquenos a 1,2-dioles. ¿Cómo es posible controlar esta reacción para que se detenga en la etapa de diol cuando el permanganato también pueda oxidarse
oxidarse ? La sobreoxidación con permanganato siempre es un problema, pero las velocidades de reacción relativas son en gran medida una función del pH de la mezcla de reacción y, en solución básica, el permanganato de potasio oxida los grupos insaturados más rápidamente que oxida los alcoholes:
? La sobreoxidación con permanganato siempre es un problema, pero las velocidades de reacción relativas son en gran medida una función del pH de la mezcla de reacción y, en solución básica, el permanganato de potasio oxida los grupos insaturados más rápidamente que oxida los alcoholes:
Oxidaciones Biológicas
Existen muchas oxidaciones biológicas que convierten un alcohol primario o secundario en un compuesto carbonilo. Estas reacciones no pueden implicar las condiciones extremas de pH y oxidantes inorgánicos vigorosos utilizados en las oxidaciones típicas de laboratorio. Más bien, ocurren a valores de pH casi neutros y todos requieren enzimas como catalizadores, que para estas reacciones suelen llamarse deshidrogenasas.
Un grupo importante de agentes oxidantes biológicos incluye los nucleótidos de piridina, de los cuales nicotinamida adenina dinucleótido (\(\ce{NAD}^\oplus\),\(13\)) es un ejemplo:
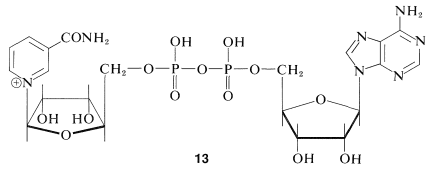
Esta molécula muy compleja funciona para aceptar hidruro\(\left( \ce{H}^\ominus \right)\) o el equivalente\(\left( \ce{H}^\oplus + 2 \ce{e^-} \right)\) del\(\alpha\) carbono de un alcohol:
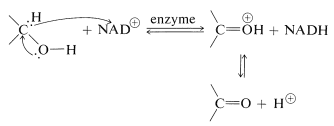
La forma reducida de\(\ce{NAD}^\oplus\) se abrevia como\(\ce{NADH}\) y\(\ce{H}^\ominus\) se añade en la posición 4 del anillo de piridina:
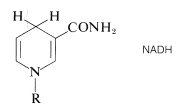
A continuación se presentan algunos ejemplos que ilustran la notable especificidad de este tipo de sistema redox. Uno de los últimos pasos en la descomposición metabólica de la glucosa (glucólisis; Sección 20-10A) es la reducción del ácido 2-oxopropanoico (pirúvico) a ácido\(L\) -2-hidroxipropanoico (láctico). El proceso inverso es la oxidación del ácido\(L\) láctico. La enzima ácido láctico d ehidrogenasa cataliza esta reacción, y solo funciona con el\(L\) enantiómero del ácido láctico:

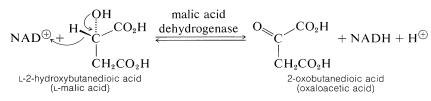
Un segundo ejemplo, proporcionado por una de las etapas en el metabolismo a través del ciclo del ácido cítrico de Krebs (ver Sección 20-10B), es la oxidación del ácido\(L\) -2-hidroxi-butanodioico (\(L\)-málico) a ácido 2-oxobutanodioico (oxaloacético). Esta enzima funciona solo con ácido\(L\) málico:
Todas estas reacciones liberan energía. En las oxidaciones biológicas gran parte de la energía se utiliza para formar ATP a partir de ADP y fosfato inorgánico (Sección 15-5F). Es decir, las reacciones de transferencia de electrones se acoplan con la formación de ATP. El proceso general se llama fosforilación oxidativa.
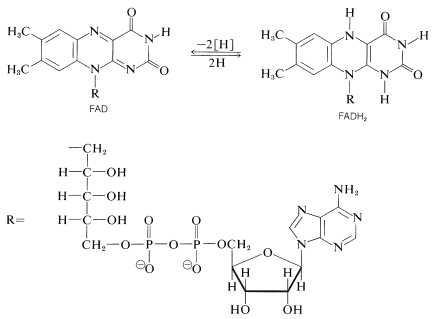
Otro agente oxidante importante en los sistemas biológicos es el dinucleótido flavina adenina,\(\ce{FAD}\). Al igual que\(\ce{NAD}^\oplus\), es un aceptor de dos electrones, pero a diferencia\(\ce{NAD}^\oplus\), acepta dos electrones como\(2 \ce{H} \cdot\) en lugar de como\(\ce{H}^\ominus\). La forma reducida,\(\ce{FADH_2}\), tiene los hidrógenos en los nitrógenos del anillo:
Colaboradores
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


