15.11: Tipos y reacciones de éteres simples
- Page ID
- 73000
La sustitución de los hidrógenos hidroxílicos de los alcoholes por grupos hidrocarbonados da compuestos conocidos como éteres. Estos compuestos pueden clasificarse adicionalmente como de cadena abierta, cíclicos, saturados, insaturados, aromáticos, etc. Para la denominación de los éteres, consulte las Secciones 7-3 y 15-11A.
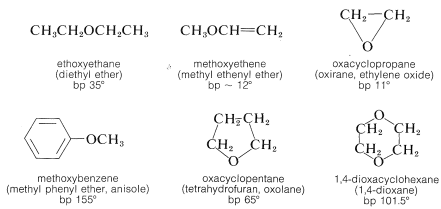
Ya se han discutido los métodos más generalmente útiles para preparar éteres (Secciones 8-7C, 8-7E, 15-4C y 15-5C). Estos y algunos procedimientos especiales adicionales se resumen en el Cuadro 15-4.
Cuadro 15-4: Métodos generales de preparación de éteres

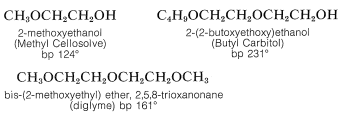
En general, los éteres son bajos en la escala de reactividad química debido a que el enlace carbono-oxígeno no se escinde fácilmente. Por esta razón los éteres se emplean frecuentemente como disolventes inertes en la síntesis orgánica. Particularmente importantes a este respecto son el éter dietílico, el éter diisoprolico, el tetrahidrofurano y el 1,4-dioxano. Los éteres mono y dialquílicos de 1,2-etandiol, 3-oxa-1,5-pentandiol y sustancias relacionadas son solventes útiles de alto punto de ebullición. Desafortunadamente, sus nombres comerciales no son muy racionales. Los nombres abreviados son de uso común, como “poliglimas”, “Cellosolves” y “Carbitoles”. Como referencia, los Cellosolves son éteres monoalquílicos de 1,2-etandiol; los carbitoles son éteres monoalquílicos de 3-oxa-1,5-pentanodiol; los poliglimes son éteres dimetílicos de 3-oxa-1,5-pentanodiol o 3,6-dioxa-1,8-octanodiol y se denominan diglima y triglima, respectivamente.
Las propiedades espectroscópicas de los éteres no son excepcionales. Al igual que los alcoholes, no tienen absorción electrónica más allá\(185 \: \text{nm}\); las bandas infrarrojas importantes son las vibraciones de\(\ce{C-O}\) estiramiento en la región\(1000\) -\(1230 \: \text{cm}^{-1}\); sus espectros de RMN protónica muestran deshielding de los hidrógenos alfa por el oxígeno éter\(\left( \delta_{HC_{\alpha}OC} \sim 3.4 \: \text{ppm} \right)\). Los espectros de masas de éteres y alcoholes son muy similares y dan abundantes iones del tipo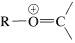 (\(\ce{R} = \ce{H}\)o alquilo) por\(\alpha\) -escisión (ver Sección 15-2).
(\(\ce{R} = \ce{H}\)o alquilo) por\(\alpha\) -escisión (ver Sección 15-2).
A diferencia de los alcoholes, los éteres no son ácidos y generalmente no reaccionan con bases. Sin embargo, reactivos básicos excepcionalmente fuertes, particularmente ciertos alquilos de metales alcalinos, reaccionarán destructivamente con muchos éteres:
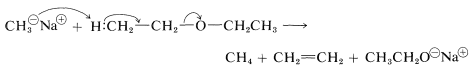
Los éteres, como los alcoholes, son débilmente básicos y se convierten en sales altamente reactivas por ácidos fuertes (por ejemplo\(\ce{H_2SO_4}\),\(\ce{HClO_4}\), y\(\ce{HBr}\)) y en complejos de coordinación relativamente estables con ácidos de Lewis (por ejemplo,\(\ce{BF_3}\) y\(\ce{RMgX}\)):
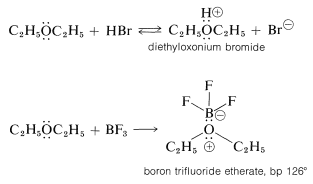
El éter dimetílico se convierte en fluoroborato de trimetiloxonio mediante la combinación de trifluoruro de boro y fluoruro de metilo:
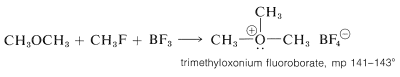
Tanto las sales de trimetil como trietiloxonio son bastante estables y pueden aislarse como sólidos cristalinos. Se preparan más convenientemente a partir del eterato de trifluoruro de boro y clorometiloxaciclopropano (epiclorhidrina) apropiados.
Los iones trialquiloxonio son mucho más susceptibles a las reacciones de desplazamiento nucleofílico que las moléculas de éter neutras. La razón es que\(\ce{ROR}\) es un mejor grupo que se va que\(\ce{RO}^\ominus\). De hecho, las sales de trimetiloxonio se encuentran entre los reactivos metilantes más efectivos conocidos:
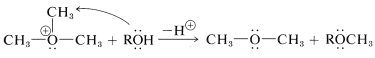
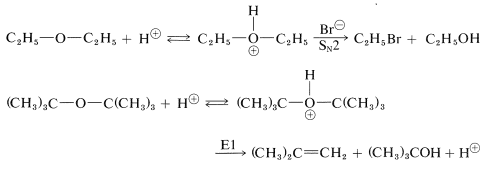
Los éteres pueden ser escindidos bajo condiciones fuertemente ácidas mediante la formación intermedia de sales de dialquiloxonio. Los ácidos bromhídrico e yodhídrico son especialmente útiles para la escisión de éter porque ambos son ácidos fuertes y sus aniones son buenos nucleófilos. Los éteres alquílicos terciarios se escinden muy fácilmente mediante reactivos ácidos:
Los éteres son susceptibles al ataque por átomos de halógeno y radicales, y por esta razón no son buenos solventes para reacciones radicales. De hecho, los éteres son productos químicos potencialmente peligrosos, porque en presencia de oxígeno atmosférico se produce la formación de cadenas radicales de peróxidos, y los peróxidos son compuestos inestables y propensos a la explosión. Este proceso se llama autooxidación y ocurre no sólo con éteres sino con muchos aldehídos e hidrocarburos. La reacción puede generalizarse en términos de las siguientes etapas que implican iniciación (1), propagación (2 y 3) y terminación (4).

Los pasos de iniciación y terminación pueden ocurrir de diversas maneras, pero son los pasos portadores de cadena, 2 y 3, los que afectan la destrucción general del compuesto. Los éteres de uso común, como el éter dietílico, el éter diisoprolico, el tetrahidrofurano y el 1,4-dioxano, a menudo se contaminan seriamente con peróxidos formados por autooxidación en almacenamiento prolongado y exposición al aire y la luz. La purificación de los éteres frecuentemente es necesaria antes de su uso, y siempre se debe tener precaución en las últimas etapas de destilarlos, ya que los residuos de destilación pueden contener concentraciones peligrosamente altas de peróxidos explosivos.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


