15.12: Éteres cíclicos
- Page ID
- 72993
Nomenclatura de Éteres Cíclicos
Los compuestos de anillo que contienen nitrógeno, oxígeno, azufre u otros elementos como átomos del anillo generalmente se conocen como compuestos heterocíclicos, y los átomos del anillo distintos del carbono son los heteroátomos. A lo largo de los años, los compuestos heterocíclicos más comunes han adquirido una mezcolanza de nombres triviales, como óxido de etileno, tetrahidrofurano y dioxano. La nomenclatura sistemática de los compuestos de anillo es necesaria pero, desafortunadamente, se han desarrollado varios sistemas competidores. Preferimos el procedimiento más simple, que consiste en nombrar a los heterociclos simples como oxa, aza y thia-derivados de cicloalcanos. Sin embargo, este procedimiento no ha sido aceptado (o adoptado) universalmente y estamos obligados a tratar los usos en la literatura existente. Habiendo vivido al menos dos ciclos de cambios drásticos en estas materias, los autores esperan que el procedimiento simple prevalezca a la larga, pero el largo plazo aún está por delante.
Resumimos aquí las reglas del llamado sistema de nomenclatura Hantzsch-Widman para heterociclos, que actualmente es el procedimiento de moda, aunque relegado a la categoría de segunda clase por un enfoque reciente y muy práctico de la nomenclatura orgánica. \(^1\)
- El tamaño del anillo se denota por el tallo, ir, et, ol, in, ep, oc, on o ec para anillos de 3-, 4-, 5-, 6-, 7-, 8-, 9-, o 10 miembros, respectivamente.
- El tipo de heteroátomo presente se indica con el prefijo oxa, thia o aza para oxígeno, azufre o nitrógeno, respectivamente; los prefijos dioxa, ditia o diaza denotan dos átomos de oxígeno, azufre o nitrógeno. Cuando están presentes dos o más heteroátomos diferentes, se citan en orden de preferencia: oxígeno antes que azufre antes que nitrógeno, como en los prefijos oxaza para un oxígeno y un nitrógeno, y tiaza para un azufre y un nitrógeno.
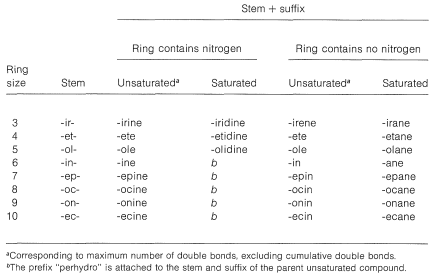
- El grado de insaturación se especifica en el sufijo. En la Tabla 15-5 se da una lista de sufijos apropiados y sus tallos de acuerdo con los tamaños de anillo. Observe que el sufijo cambia ligeramente según si el anillo contiene nitrógeno.
Cuadro 15-5: Tallos, sufijo y tamaño de anillo de compuestos heterocíclicos
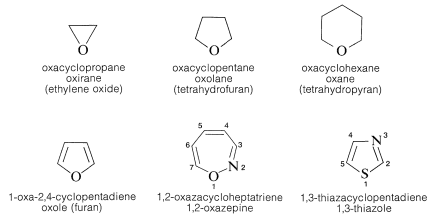
4. La numeración del anillo comienza con el heteroátomo y procede alrededor del anillo para dar sustituyentes (u otros heteroátomos) las posiciones numeradas más bajas. Cuando dos o más heteroátomos diferentes están presentes, el oxígeno tiene prioridad sobre el azufre y el azufre sobre el nitrógeno para la posición número uno. A continuación se presentan ejemplos para ilustrar los sistemas heterocicloalcano y Hantzsch-Widman. También se incluyen nombres triviales.
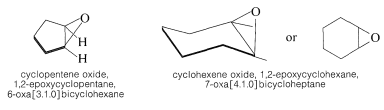
Aunque el sistema Hantzsch-Widman funciona satisfactoriamente (si recuerdas las reglas) para los compuestos monocíclicos, es engorroso para los compuestos policíclicos. En el caso de los oxiranos es más sencillo para fines conversacionales nombrarlos como óxidos de los cicloalquenos o derivados epoxídicos de los cicloalcanos correspondientes. Los nombres de oxabicicloalcanos parecen preferibles para fines de indexación, particularmente porque la palabra “óxido” se usa en muchas otras conexiones.
Reactividad de Éteres Cíclicos - Oxaciclopropanos (Oxiranos)
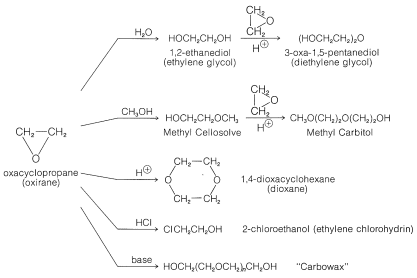
El oxaciclopropano (oxirano), el éter cíclico más simple, es una excepción excepcional a la generalización de que la mayoría de los éteres son resistentes a la escisión. Al igual que el ciclopropano, el anillo de tres elementos está muy tenso y se abre fácilmente en condiciones suaves. En efecto, la importancia del oxaciclopropano como químico industrial radica en su disposición para formar otros compuestos importantes. Los principales productos derivados de ella se muestran en la Figura 15-5.
El éter cíclico de cuatro miembros menos conocido, el oxaciclobutano (oxetano)\(\ce{(CH_2)_3O}\), también se escinde fácilmente, pero menos que el oxaciclopropano. El oxaciclopentano (oxolano, tetrahidrofurano) es un compuesto miscible en agua relativamente no reactivo con propiedades deseables como disolvente orgánico. A menudo se usa en lugar de éter dietílico en reacciones de Grignard y reducciones con hidruro de litio y aluminio.
Preparación de Oxaciclopropano
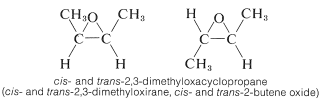
Los éteres cíclicos de tres elementos son importantes como intermedios reactivos en la síntesis orgánica. Al igual que los ciclopropanos, los compuestos\(^2\) disustituidos vecinales tienen isómeros cis y trans:
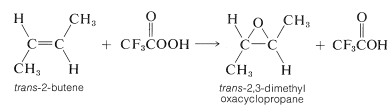
El método de preparación más importante implica la oxidación, o “epoxidación”, de un alqueno con un ácido peroxicarboxílico,\(\ce{RCO_3H}\). Esta reacción logra la adición suprafacial de oxígeno a través del doble enlace, y es un tipo de adición electrófila a los alquenos:
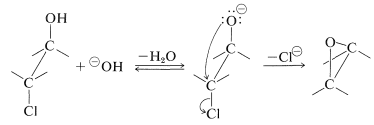
Los oxaciclopropanos también se pueden preparar a partir de cloro o bromoalcoholes vecinales y una base. Esta es una\(S_\text{N}2\) reacción interna y, si la estereoquímica es correcta, procede con bastante rapidez, incluso si se forma un anillo tenso:
Reacciones de apertura de anillo de oxaciclopropanos
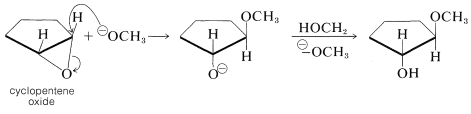
A diferencia de la mayoría de los éteres, los oxaciclopropanos reaccionan fácilmente con reactivos nucleofílicos. Estas reacciones no son diferentes de los desplazamientos nucleofílicos previamente encontrados en el Capítulo 8, salvo que el grupo saliente, que es el oxígeno del anillo de óxido, sigue siendo parte de la molécula original. La estereoquímica es consistente con un\(S_\text{N}2\) mecanismo porque se produce la inversión de la configuración en el sitio de ataque. Así, el óxido de ciclopenteno produce productos con la configuración trans:
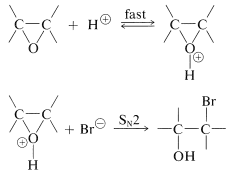
También se pueden usar condiciones ácidas para la escisión de anillos de oxaciclopropano. Primero se forma un ion oxonio, que posteriormente es atacado por el nucleófilo en un\(S_\text{N}2\) desplazamiento o forma un carbocatión en una\(S_\text{N}1\) reacción. La evidencia del\(S_\text{N}2\) mecanismo, que produce inversión, proviene no sólo de la estereoquímica sino también del hecho de que la tasa depende de la concentración del nucleófilo. Un ejemplo es la apertura del anillo con bromuro de hidrógeno:
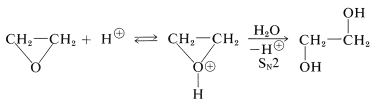
El mismo tipo de mecanismo puede operar en la formación de 1,2-dioles por apertura de anillo catalizada por ácido con agua que el nucleófilo:
Algunas reacciones de solvolisis catalizadas por ácido de oxaciclopropanos parecen proceder por\(S_\text{N}1\) mecanismos que involucran intermedios de carbocationes. La evidencia del\(S_\text{N}1\) mecanismo está disponible a partir de las reacciones de oxaciclopropanos sustituidos asimétricamente. Por ejemplo, esperaríamos que el ácido conjugado de 2,2-dimetiloxaciclopropano sea atacado por metanol en el carbono primario por una\(S_\text{N}2\) reacción y en el carbono terciario por una\(S_\text{N}1\) reacción:
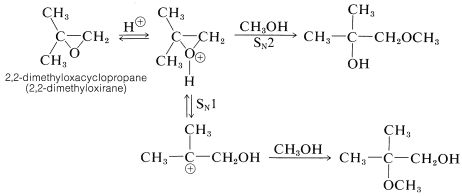
Debido a que en realidad se obtienen ambos productos, podemos concluir que se producen tanto\(S_\text{N}1\) los\(S_\text{N}2\) mecanismos como. El\(S_\text{N}1\) producto, el éter terciario, es el producto principal.
Complejos Metálicos de Poliéteres Cíclicos
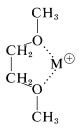
Hemos enfatizado los contrastes en propiedades entre los compuestos iónicos como el cloruro de sodio, y los compuestos orgánicos no polares, como los alcanos y arenos. Existen grandes dificultades para disolver los tipos extremos de estas sustancias en un medio mutuamente compatible para llevar a cabo reacciones químicas, como, por ejemplo, en\(S_\text{N}\) reacciones de haluros orgánicos con sales de metales alcalinos (Secciones 8-3 y 8-7F). La esencia del problema es que las fuerzas electrostáticas en los cristales iónicos de sales inorgánicas son fuertes, y los disolventes no polares simplemente no tienen el poder solvatante de los iones para hacer de la disolución de los cristales un proceso favorable. “Sin embargo, desde hace tiempo se sabe que los poliéteres, tales como los “" glimas "” (Sección 15-10), son capaces de ayudar en la disolución de compuestos iónicos a través de su capacidad para solvatar cationes metálicos proporcionando múltiples sitios de complejación:”
En 1967, C. J. Pedersen reportó la síntesis de una serie de poliéteres cíclicos, a los que llamó "éteres corona “, que han mostrado una gran promesa para unir lo que tradicionalmente se ha considerado como sustancias totalmente incompatibles -incluso logrando solubilidades mensurables de sales como \(\ce{NaCl}\),\(\ce{KOH}\), y\(\ce{KMnO_4}\) en benceno. Los éteres corona pueden considerarse como “glimas” cíclicos y están disponibles por reacciones de ciclación de\(S_\text{N}2\) tipo:
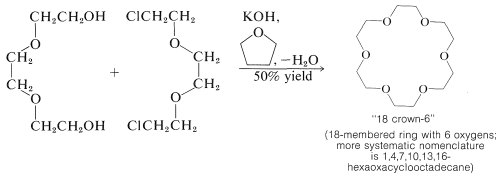
Los éteres corona y muchas modificaciones de los mismos (especialmente con nitrógeno reemplazando a uno o más de los oxígenos) funcionan coordinándose con cationes metálicos y convirtiéndolos en entidades menos polares que son más estables en solución, incluso en un disolvente no polar, que en el cristal.
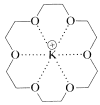
Muchos de los éteres corona tienen una especificidad considerable con respecto al metal con el que se complejan. El tamaño del anillo así como el número y tipo de heteroátomos son muy importantes en este sentido. 18-Corona-6 es especialmente efectivo para el potasio:
Una aplicación importante para los éteres corona en el trabajo sintético es para la solubilización de sales como\(\ce{KCN}\) en disolventes no polares para su uso en\(S_\text{N}2\) desplazamientos. Si el disolvente tiene una baja capacidad de solvatación aniónica, entonces la reactividad del anión se mejora enormemente. En consecuencia, muchas reacciones de desplazamiento que proceden lentamente a temperaturas elevadas procederán a tasas útiles a temperatura ambiente, debido a que la energía de “desolvar” el anión antes de\(S_\text{N}2\) sufrir desplazamiento es baja (Sección 8-7F). Por ejemplo, el fluoruro de potasio se convierte en un potente reactivo nucleófilo en disolventes no polares cuando se compleja con 18-corona-6:
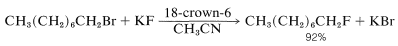
Acetales y Cetales como Éteres
El agrupamiento\(\ce{C-O-C-O-C}\) es característico de un acetal o un cetal (ver Sección 15-4E), pero también puede considerarse como un éter con dos enlaces éter a un carbono. En comparación con otros éteres (excepto los oxaciclopropanos), las sustancias con el\(\ce{C-O-C-O-C}\) grupo son muy activas hacia los reactivos ácidos, como se señala en relación con su formación a partir de alcoholes (Sección 15-4E) y su sue como grupos protectores para la\(\ce{OH}\) función (Sección 15-9C).
\(^1\)J. H. Fletcher, O. C. Dermer, y R. B. Fox (Editores), “Nomenclatura de Compuestos Orgánicos, Principios y Práctica”. Serie Avances en Química, No. 126, American Chemical Society, Washington, D.C., 1974.
\(^2\)Las medias vecinales sustituidas en carbonos adyacentes.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


