16.2: El enlace carbonilo
- Page ID
- 73579
Comparación con los dobles enlaces carbono-carbono
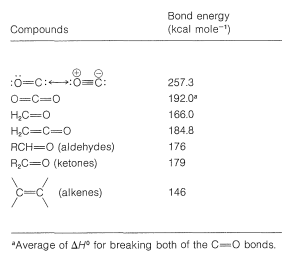
El enlace carbonilo es tanto un enlace fuerte como un enlace reactivo. La energía de enlace varía ampliamente con la estructura, como podemos ver en las energías de enlace carbonilo en el Cuadro 16-1. El metanal tiene el enlace más débil\(\left( 166 \: \text{kcal} \right)\) y el monóxido de carbono el más fuerte\(\left( 237.3 \: \text{kcal} \right)\). Independientemente de estas variaciones, el enlace carbonilo no solo es significativamente más fuerte sino que también es más reactivo que un doble enlace carbono-carbono. Una diferencia típica en estabilidad y reactividad se observa en la hidratación:
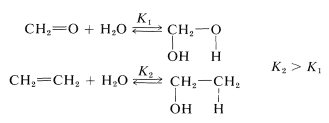
La constante de equilibrio para la hidratación del eteno es considerablemente mayor que para la hidratación metanal, en gran parte debido a que el doble enlace carbono-carbono es más débil. Aun así, el metanal agrega agua rápida y reversiblemente a temperatura ambiente sin necesidad de un catalizador. La adición correspondiente de agua al eteno ocurre únicamente en presencia de catálisis fuertemente ácida (Sección 10-3E, Cuadro 15-2).
Cuadro 16-1: Energías de enlace carbonilo
Estructura y Reactividad
La reactividad del enlace carbonilo se debe principalmente a la diferencia de electronegatividad entre carbono y oxígeno, lo que conduce a una contribución considerable de la forma de resonancia dipolar con oxígeno negativo y carbono positivo:
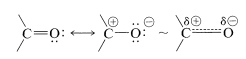
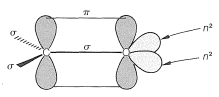
La polaridad del enlace carbonilo facilita la adición de agua y otros reactivos polares en relación con la adición del mismo reactivo a los dobles enlaces alquenos. Esto lo hemos visto previamente en la adición de compuestos organometálicos\(\overset{\delta \ominus}{\ce{R}} \overset{\delta \oplus}{\ce{-MgX}}\) y\(\overset{\delta \ominus}{\ce{R}} \overset{\delta \oplus}{\ce{-Li}}\) a compuestos carbonílicos (Sección 14-12A). Los dobles enlaces alquenos normalmente no son tocados por estos reactivos:
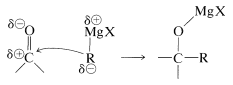
Asimismo, los alcoholes se añaden fácilmente a los compuestos carbonílicos, como se describe en la Sección 15-4E. Sin embargo, debemos tener en cuenta la posibilidad de que, mientras que las adiciones a los grupos carbonilo pueden ser rápidas, las constantes de equilibrio pueden ser pequeñas debido a la fuerza del enlace carbonilo.
Consideraciones adicionales de reactividad
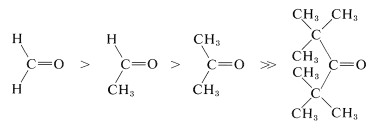
Las reacciones importantes de los grupos carbonilo implican característicamente la adición en una etapa u otra. Para las reacciones de reactivos organometálicos y alcoholes con compuestos carbonílicos (Capítulos 14 y 15), tal vez recuerde que el impedimento estérico juega un papel importante en la determinación de la relación entre la adición y otras reacciones competitivas. Efectos similares se observan en una amplia variedad de otras reacciones. Se espera que la reactividad de los grupos carbonilo en los procesos de adición se vea influenciada por el tamaño de los sustituyentes sobre los mismos, ya que cuando se produce la adición los grupos sustituyentes son empujados hacia atrás más cerca entre sí. De hecho, la reactividad y la constante de equilibrio disminuyen con el aumento del volumen de los sustituyentes, como en las siguientes series (ver también Tabla 15-3):
Los efectos de la cepa también contribuyen a la reactividad de compuestos de carbonilo cíclicos. Los ángulos de enlace normales alrededor de un grupo carbonilo son aproximadamente\(120^\text{o}\):
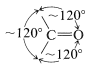
En consecuencia, si el grupo carbonilo está en un anillo carbocíclico pequeño, habrá una tensión angular sustancial y esto ascenderá a aproximadamente\(120^\text{o} - 60^\text{o} = 60^\text{o}\) la cepa para la ciclopropanona.
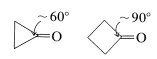
y\(120^\text{o} - 90^\text{o} = 30^\text{o}\) de cepa para ciclobutanona (siendo ambos valores para\(\angle \ce{C-C-C}\) el grupo carbonilo). La adición de un nucleófilo tal como\(\ce{CH_3OH}\) (ver Sección 15-4E) a estos enlaces carbonilo crea un centro tetraédrico con menos tensión en los enlaces del anillo para\(\ce{C_1}\):
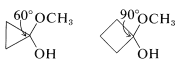
Así el hemicetal de ciclopropanona tendrá\(109.5^\text{o} = 60^\text{o} = 49.5^\text{o}\), y el de ciclobutanona\(109.5^\text{o} - 90^\text{o} = 19.5^\text{o}\) de cepa at\(\ce{C_1}\). Este cambio en la deformación angular significa que se espera una mejora considerable tanto de la reactividad como de la constante de equilibrio para la adición. En la práctica, el efecto de la cepa es tan grande que la ciclopropanona reacciona rápidamente con el metanol para dar un hemicetal estable del que no se puede recuperar la cetona. La ciclobutanona es menos reactiva que la ciclopropanona, pero más reactiva que la ciclohexanona o la ciclopentanona.
Los efectos eléctricos también son importantes para influir en la facilidad de adición a los grupos carbonilo. Los grupos que atraen electrones facilitan la adición de reactivos nucleofílicos al carbono al aumentar su carácter positivo:

Así, compuestos tales como los siguientes añaden fácilmente reactivos nucleofílicos:
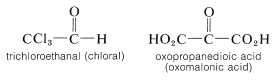
\(^1\)Un dipolo eléctrico resulta cuando se separan cargas diferentes. La magnitud del dipolo, su momento dipolar, viene dada por\(e \times r\), donde\(e\) está la magnitud de las cargas y\(r\) es la distancia a la que se separan las cargas. Los momentos dipolares moleculares se miden en unidades debye\(\left( \text{D} \right)\). Un par de iones,\(\overset{\oplus}{\ce{C}}\) y\(\overset{\ominus}{\ce{O}}\), como cargas puntuales a la\(\ce{C=O}\) distancia de\(1.22 \: Å\), tendrían un momento dipolar de\(5.9 \: \text{D}\). Así, si el momento dipolar de un compuesto carbonilo es\(2.7 \: \text{D}\), podemos estimar que el "carácter\(\%\) iónico” del enlace es\(\left( 2.7/5.9 \right) \times 100 = 46\%\). El análisis se simplifica en exceso ya que las cargas en el átomo no son cargas puntuales y hemos asumido que todo el carácter iónico de la molécula está asociado con el\(\ce{C=O}\) enlace. Uno debe ser cauteloso al interpretar los momentos dipolares en términos del carácter iónico de los enlaces. El dióxido de carbono no tiene momento dipolar, pero ciertamente tiene\(\ce{C=O}\) enlaces polares. El problema es que los dipolos asociados a los\(\ce{C=O}\) enlaces de\(\ce{CO_2}\) son iguales y opuestos en dirección entre sí y, en consecuencia, cancelan. Por lo tanto, no\(\overset{\delta \ominus}{\ce{O}} \overset{\delta \oplus}{\ce{-C}} \overset{\delta \ominus}{\ce{-O}}\) tiene momento dipolo neto, a pesar de que tiene enlaces altamente polares.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


